基于NE-4C细胞模型制备猪脑促增殖肽
2021-09-09肖朝耿卢文静唐宏刚张治国周天琼
谌 迪,肖朝耿*,卢文静,叶 沁,唐宏刚,张 怡,张治国,周天琼
(1 浙江省农业科学院食品科学研究所 杭州 310021 2 上海市农业科学院农产品保鲜加工研究中心 上海 201403 3 杭州华津药业股份有限公司 杭州 311241)
猪脑鲜嫩可口,富含蛋白质、脑磷脂和各种矿物质,可増加机体的免疫力,是传统的健脑食品[1]。Sharma 等[2]发现猪脑水解产物多肽可以减缓脑水肿,抑制神经元损伤。林元藻等[3]发现猪脑水解物可显著增强小鼠的学习记忆能力。研究表明,猪脑多肽对大脑的改善作用可能与其NSC-34 细胞的神经保护作用有关,然而过高浓度的猪脑多肽会抑制细胞的增殖[4]。临床上,Ziganshina 等[5]发现猪脑多肽可以改善急性缺血性脑卒中患者的症状并延缓病情进展,其水解物还可用于治疗神经系统疾病并预防年龄依赖性痴呆[6-8]。Guekht 等[9]将猪脑多肽水解物用于治疗认知能力逐渐丧失的血管型失智。猪脑多肽水解物可以通过提高脑组织无氧代谢的ATP 生成量、减少氧自由基生成等作用机制促进脑代谢,增加脑活性[10]。临床上采用猪脑水解物治疗脑功能障碍疾病已有数十年,早在上世纪我国就已开发出中药制剂用于治疗头痛,如镇脑宁就是以猪脑为原料开发而成,采用乳猪制备的脑活性多肽与价格昂贵的进口脑活素具有类似作用[11]。脑活素已在临床上广泛应用40 多年,已知脑活素是75%游离氨基酸和25%短链肽的混合物,短肽可能是其生理活性成分[12]。综上,猪脑多肽具有重要的药学价值。
与酸碱水解等方法相比,生物酶解法制备多肽具有专一性强,反应条件温和,反应过程容易控制,对环境友好,无毒性物质产生等优点[13-15]。采用酶解制备的生物活性肽具有抗氧化、抗菌、免疫调节等多种功能[16-19]。猪脑酶解产物已被用于治疗脑功能障碍疾病,如奥地利生产的脑活素(Cerebrolyzin),日本生产的Ceremon 及德国、罗马尼亚生产的Crelizin 都是通过酶水解脑蛋白获得的制剂。猪脑多肽可保护神经元防止大脑损伤,还能预防炎症,抑制细胞凋亡[20]。猪脑多肽水解物中的活性短肽与内源神经营养因子有类似的作用[21]。基于促增殖活性优化猪脑多肽的提取制备技术很有必要。
本文以猪脑蛋白为材料,通过胃蛋白酶、胰蛋白酶和脂肪酶等制备猪脑促增殖肽,采用色谱法比较猪脑酶解液中多肽分子质量的分布。确定了猪脑促增殖肽培养小鼠神经干细胞的条件,基于NE-4C 神经干细胞模型,考查了加酶量,酶解温度、酶解时间和pH 值等对其促增殖活性的影响,以NE-4C 促增殖活性为指标,通过正交法优化酶解工艺,以期为猪脑促增殖肽的制备提供理论参考。
1 材料与方法
1.1 材料与试剂
冷冻鲜猪脑,购自农贸市场。胰蛋白酶(1∶250)、胃蛋白酶(1∶30 000),上海源叶生物科技有限公司;脂肪酶(Palatase 2000L,20 000 U/g),诺维信(中国)生物技术有限公司;标准牛血清蛋白,生工生物工程(上海)股份有限公司;Eagle MEM 培养基,Gibco 公司;胎牛血清,Hyclon 公司;MTT 试剂盒,南京凯基生物技术有限公司;多聚赖氨酸(cat#P-9155),Sigma 公司;谷氨酰胺(35050)、非必需氨基酸(100×,11140),Invitrogen 公司;其它试剂均为国产分析纯级。
1.2 主要仪器与设备
5424R 冷冻离心机,德国Eppendorf 公司;Spectra MAX190 全波长酶标仪,美国MD 公司;超滤设备,美国Millipore 公司;超净工作台,HITIK公司;二氧化碳培养箱,Thermo 公司;pH 计,上海三星仪器有限公司;ULTRA-TURRAXT1.8basic 匀浆机,德国IKA 公司;电热恒温水浴锅,上海精宏实验设备有限公司;粉碎机,德清拜杰电器有限公司;烘箱,上海一恒科学仪器有限公司。
1.3 试验方法
1.3.1 猪脑促增殖肽制备酶的筛选 冷冻的鲜猪脑自然解冻后,除去血块和脑膜(软脑膜和蛛网膜),用生理盐水冲洗,均质机匀浆得到猪脑匀浆[22],密封于冰箱中冷藏储存备用。
1.3.2 NE-4C 神经干细胞培养 将Eagle MEM、胎牛血清、谷氨酰胺和非必需氨基酸(100×)按88∶10∶1∶1 的比例在无菌条件下制备小鼠神经干细胞完全培养液。细胞复苏及传代前至少提前2 h在T25 培养瓶中铺15 μg/mL 多聚赖氨酸进行预处理。在无菌件下,将NE-4C 细胞接种于小鼠神经干细胞完全培养基中,在CO2培养箱中(37 ℃、5% CO2)环境培养,每天更换完全培养基。当细胞生长至培养瓶总体积的70%~80%时,用0.25%胰酶消化,多聚赖氨酸预处理2 h 后传代并继续培养。试验所需细胞取自同代。
1.3.3 MTT 法测定NE-4C 的细胞促增殖活性促增殖活性检测参考文献并作适当修改[23]:将NE-4C 细胞按2 000 个/孔接种至96 孔板中,接种前2 h 用15 μg/mL 多聚赖氨酸预处理T25 培养瓶,培养过夜去后去掉培养基。酶解液中多肽含量用Bradford 法检测[24],用完全培养基将猪脑多肽稀释至0.5 mg/mL,培养NE-4C 细胞48 h,每孔加入50 μL MTT 工作液4 h 后去掉培养基,加入150 μL 二甲亚砜(DMSO)混匀,室温摇床15 min,于波长492 nm 处检测吸光值。
1.3.4 色谱法检测酶解后猪脑多肽分子质量分布 采用高效凝胶渗透色谱法对猪脑多肽的分子质量分布进行表征,参考文献中方法并作适当修改[25]。色谱条件:Ultrahydrogel TM Linear 2 根串联(7.8 mm×300 mm),柱温45 ℃,流动相0.1 mol/L NaNO3,流速0.6 mL/min,进样量20 μL。采用RID示差折光检测器进行检测。用流动相配制1.0 mg/mL 猪脑多肽酶解物及系列葡聚糖标准品溶液,过0.22 μm 水系滤膜后分析。系列标准样品的保留时间和对应分子质量的对数值,由GPC 软件自动分析并生成分子质量标准曲线。待测样品色谱图中各个峰的相对分子质量由GPC 软件基于标准曲线自动计算。
1.3.5 加酶量、pH 值、酶解温度和酶解时间对促增殖活性的影响 准确称取猪脑匀浆(1.00±0.01)g,置于250 mL 锥形瓶中,加入200 mL 去离子水,磁力搅拌30 min,依次研究加酶量、pH 值、酶解温度和酶解时间对酶解液促增殖活性的影响。
1.3.6 猪脑促增殖肽提取工艺优化 针对猪脑促增殖肽提取制备工艺,采用L9(34)正交试验优化胰蛋白酶的加入量(A,mg)、pH 值(B)、酶解温度(C,℃)以及酶解时间(D,h),因素与水平见表1。

表1 因素与水平Table 1 Factors and levels
1.3.7 数据统计试验结果 通过SPSS 18.0 软件分析,组间差异比较采用One-way ANOVA 检验比较其差异显著性。
2 结果与分析
2.1 猪脑促增殖肽制备酶的筛选
由图1a 可知,与对照组相比,胰蛋白酶酶解猪脑后,其多肽水解物的促增殖活性显著高于对照组(P<0.05),而胃蛋白酶及脂肪酶的酶解产物与对照组无显著性差异(P>0.05),这可能与胰蛋白酶酶解猪脑后,其小分子质量多肽占比较高相关。很多调控促进细胞增殖的多肽以短肽的形式存在,分子质量较小,如蚕蛹蛋白肽[26]、成骨生长肽[27]及神经肽P 物质[28]等。
由图1b 可以发现,采用胰蛋白酶酶解猪脑蛋白,随着酶解物中多肽质量浓度的增加,对NE-4C 细胞的促增殖能力提高,但当质量浓度高于5 mg/mL 时,促增殖能力未出现继续增强的现象,因此,猪脑多肽添加质量浓度为5 mg/mL 时,可适于NE-4C 细胞培养。
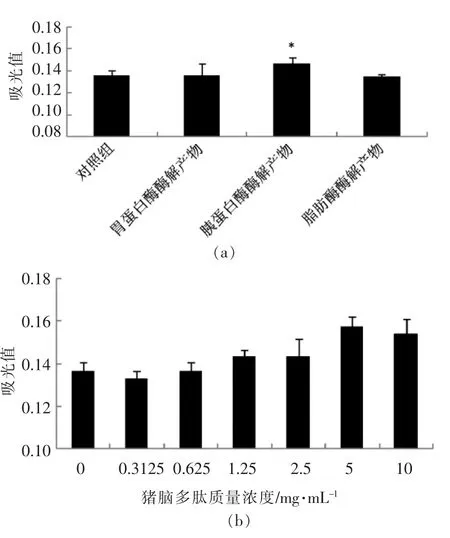
图1 不同猪脑酶解物对NE-4C 细胞促增殖活性的影响Fig.1 Effects of different enzymic hydrolysis on proliferative activities of porcine brain
2.2 猪脑酶解物中多肽分子质量分布
由图2和表2可知,猪脑匀浆液在未酶解前,其多肽含量较低,仪器无法检出。胃蛋白酶、胰蛋白酶及复合酶(胃蛋白酶和胰蛋白酶依次酶解)酶解猪脑蛋白后,多肽分子质量分布主要集中在2 000 u 以下。胰蛋白酶酶解产物中,多肽分子质量分布主要集中在500 u 以下,而此分子质量的多肽多表现出较高的生物活性[29]。猪脑经胰蛋白酶酶解后,分子质量在180~500 u 范围的多肽占总多肽含量的41.42%,其次为分子质量低于180 u 的多肽,占30.67%,均高于胃蛋白酶和复合酶酶解产物,表明在制备猪脑小分子肽方面,胰蛋白酶优于胃蛋白酶及复合酶。

图2 猪脑酶解物中多肽分子质量分布Fig.2 Polypeptide molecular weight distribution of porcine brain enzymic hydrolysates
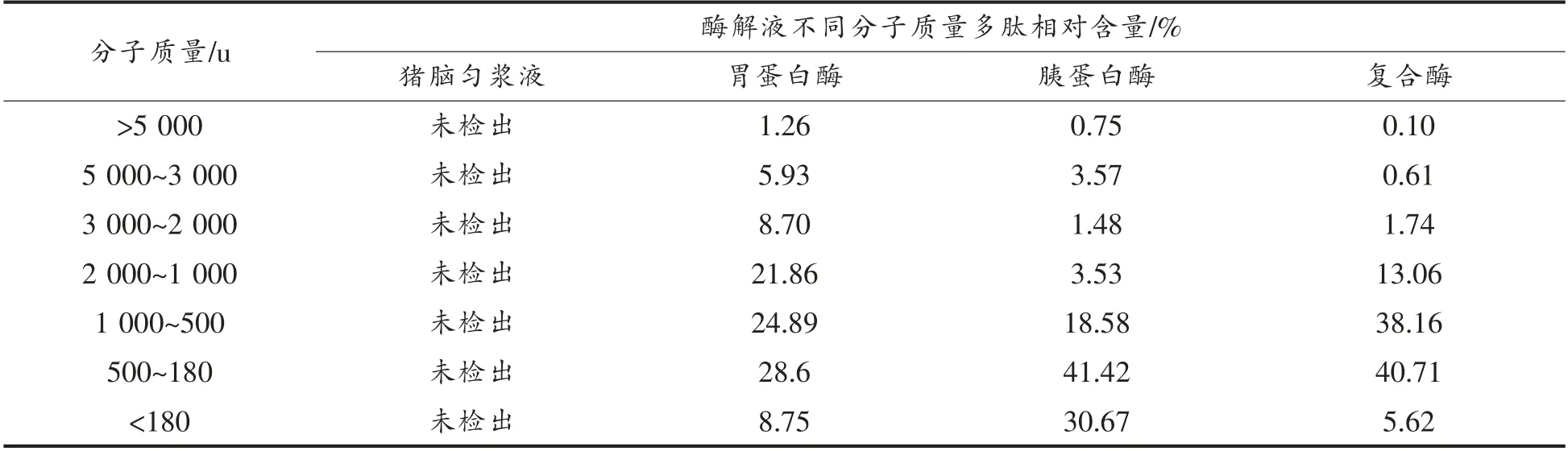
表2 猪脑酶解液中多肽分子质量分布Table 2 Polypeptides molecular weight distribution of porcine brain enzymic hydrolysates
复合酶酶解液中大于5 000 u 和5 000~3 000 u 范围的多肽含量均低于另外2 种酶,分别仅占总多肽含量的0.10%和0.61%。结果表明,复合酶可以提高分子质量小于2 000 u 的多肽比例,然而制备分子质量小于180 u 多肽的效果不如胰蛋白酶,推测胰蛋白酶酶解产物的促增殖活性与其较高比例分子质量小于180 u 的短肽相关。
2.3 各因素对促增殖活性的影响
由图3可知,加酶量为20 mg 和30 mg 时,猪脑促增殖肽的活性最强;随着酶解时间的增加,促增殖活性逐渐增加,但无显著性差异;酶解温度为30 ℃时,制备的猪脑促增殖肽活性最低,而当酶解温度为45 ℃时可显著增加其促增殖活性;pH 值对促增殖活性的影响无显著性差异。

图3 不同因素对猪脑多肽促增殖活性的影响Fig.3 Effects of different factors on the proliferative activity of porcine brain polypeptides
2.4 猪脑多肽制备的最适条件
根据单因素实验结果,按表1中所列的因素与水平,以促增殖活性为指标,通过L9(34)正交试验优化猪脑促增殖肽提取工艺,结果见表3。
此试验研究了4 个因素对猪脑促增殖肽酶解工艺的影响,分别是加酶量、pH 值、酶解温度和酶解时间。由表3可以看出,影响酶解工艺的主次因素依次是加酶量、酶解时间、酶解温度和pH 值。较优水平是加酶量25 mg,酶解时间4 h,酶解温度45 ℃,pH 7.5。在最适条件下,NE-4C 相对活力为0.161。

表3 L9 (34)正交试验Table 3 L9 (34)orthogonal tests
3 结论
本试验通过酶促水解猪脑制备促增殖肽,以酶解液的促增殖能力为指标,发现胰蛋白酶较胃蛋白酶和脂肪酶更适合用于猪脑促增殖肽的制备。利用高效凝胶渗透色谱法发现胰蛋白酶解产物中分子质量小于500 u 的多肽占总多肽含量的72.09%,特别是分子质量小于180 u 的多肽含量为30.67%,远高于胃蛋白的8.75%和复合酶的5.62%,表明胰蛋白酶酶解猪脑产物的促增殖活性与其较高比例的低分子质量肽相关。针对胰蛋白酶的加酶量、酶解时间、酶解温度和pH 值设计正交试验,最终得到较优水平为加酶量25 mg,酶解时间4 h,酶解温度45 ℃,pH 7.5。在最适条件下,NE-4C 相对活力为0.161。本试验制备的猪脑多肽具有一定的促增殖活性,可作为功能性配料应用于相关食品中,为猪脑的高值化利用提供了新的参考。
