响应面法优化豆粕肽制备工艺
2021-09-09刘静波王子秦于一丁刘博群
刘静波,王子秦,于一丁,张 婷,刘博群*
(1 吉林大学 吉林省营养与功能重点实验室 长春 130062 2 吉林大学食品科学与工程学院 长春 130062)
大豆粕是大豆经过压榨提取油脂后的副产品,其蛋白质含量随大豆品种与产地的不同而有所不同[1]。由于大豆粕中的蛋白分子质量较大,禽消化率仅为80%~85%[2],因此造成蛋白质资源的大量浪费,加剧了蛋白质资源日益紧缺的局面。如何挖掘豆粕的潜力,提高消化利用率,尤其是将豆粕转化为肽类或功能性肽类已成为目前研究的热点。
豆粕肽是豆粕水解后产生的分子质量小于10 ku 肽类物质[3],除易于吸收外,还具有抗癌活性[4]、改善睡眠[5]、降血压[6-7]、抗氧化[8-9]、降胆固醇[10]、抗菌消炎[11-12]、调节血糖[13]等生物活性。豆粕肽的制备方法主要有酸水解[14]、酶水解[15-20]、生物发酵[21-22]及菌酶协同发酵[23]。酶解法是目前最常用的方法,酶水解条件温和,易于控制,选用复合风味蛋白酶可以把处于肽键末端的疏水性氨基酸水解掉,降低豆粕肽苦味,提高人们对豆粕肽制品的接受度。
在前人研究的基础上,本文以豆粕为原料,采用复合风味蛋白酶优化工艺参数,以期制备较高产率且苦味较低的豆粕肽产品,为豆粕原料深加工提供理论参考。
1 材料与方法
1.1 材料与试剂
脱脂大豆粕,长春市华程生物技术有限公司;木瓜蛋白酶(1.1×104U/g),广西南宁杰沃生物制品有限公司;胃蛋白酶(酶活2.5×104U/g)、胰蛋白酶(酶活0.3×104U/g),Sigma 公司;复合风味蛋白酶(酶活500 LAPU/g)、中性蛋白酶(酶活1.5 AU/g),诺维信公司;马尿酸(98%)、氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠、硫酸,北京化工厂;乙腈、甲酸(色谱纯级),美国Fisher Scientific 公司;定氮催化片,北京粮食科学研究所;三氯乙酸(分析纯级),天津北联精细化学品开发有限公司;BCA 蛋白浓度测定试剂盒,碧云天生物技术研究所。
1.2 仪器与设备
STARTER 3100 实验室pH 计,奥豪斯仪器(上海)有限公司;SynergyHT 酶标仪,BioTek;CR20B2 高速冷冻离心机,日立公司;XX8200230小型切向流超滤系统,Millipore 公司;JJ-1 精密定时电动搅拌器,江苏金坛荣华仪器制造有限公司;FD-1A-50 冷冻干燥机,上海比朗仪器制造有限公司;DG-800 漩涡混合器,北京鼎国昌盛生物技术有限责任公司;K1100 全自动凯氏定氮仪,海能仪器有限责任公司;恒温水浴锅,上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 豆粕中蛋白质的含量测定 称取豆粕约0.5 g,采用凯氏定氮法测定豆粕中蛋白质的含量。按公式(1)计算:

式中,X——样品(豆粕)中蛋白质的含量,g;V1——样品消耗盐酸滴定液(0.05 mol/L)的体积,mL;V2——空白消耗盐酸滴定液(0.05 mol/L)的体积,mL;m——样品的质量,g。
1.3.2 豆粕肽的制备 将脱脂大豆粕粉碎过60目筛,称取4 g 放入锥形瓶中,加水100 mL 溶解,磁力搅拌15 min,置恒温水浴锅中。用盐酸或氢氧化钠溶液调节pH 值,设定适当温度,添加定量的蛋白酶,水解一定时间后,进行灭酶操作(90 ℃,10 min),将酶解液冷却至室温后,进行离心处理(4 000 r/min,10 min),保留上清液供后期分析。
1.3.3 豆粕肽得率测定 取上清液5 mL,加入等量的10%三氯乙酸溶液,混匀后静置10 min,离心分离(4 000 r/min,20 min),用BCA 试剂盒测定上清液中豆粕肽质量浓度(g/mL)。按公式(2)计算:

式中:N1——上清液中豆粕肽质量浓度,g/mL;V——稀释体积,mL;m——豆粕质量,g。
1.3.4 水解蛋白酶的筛选 以豆粕肽得率为指标,考察复合风味蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶5 种酶在各适宜的条件下(见表1)酶的水解活性,确定最佳蛋白酶的类型。

表1 5 种蛋白酶最佳酶解温度和最适pH 值表Table 1 Optimum hydrolysis temperature and optimum pH value of five proteases
1.3.5 单因素实验 在底物质量浓度4 g/100 mL、酶解时间7 h、酶解温度50 ℃、加酶量0.8%条件下,考察酶解pH 值(4,5,6,7,8,9)对肽得率的影响。
在底物质量浓度4 g/100 mL、酶解时间7 h、酶解pH=6、加酶量0.8%条件下,考察酶解温度(35,40,45,50,55,60 ℃)对肽得率的影响。
在酶解时间7 h、酶解温度50 ℃、酶解pH=6、加酶量0.8%条件下,考察底物质量浓度(1,2,3,4,5,6 g/100 mL)对肽得率的影响。
在底物质量浓度4 g/100 mL、酶解时间7 h、酶解pH=6、酶解温度50 ℃条件下,考察加酶量(0.2%,0.4%,0.6%,0.8%,1.0%,1.2%)对肽得率的影响。
在底物质量浓度4 g/100 mL、酶解pH=6、酶解温度50 ℃、加酶量0.8%条件下,考察酶解时间(4,5,6,7,8,9 h)对肽得率的影响。
1.3.6 响应面优化试验 在单因素实验基础上,应用Box-Behnken Design 进行响应面优化试验(三因素三水平),因素与水平的具体参数见表2。

表2 响应面设计因素水平表Table 2 Factors and levels of response surface design
1.3.7 感官评定 按GB/T 12312-2012 《感官分析味觉敏感度的测定方法》 分别配置结晶咖啡因质量浓度为:0.06,0.07,0.09,0.11,0.14,0.17,0.22,0.27 g/L 的(等比比率R=0.8)溶液,设5 个人组成的感官评定小组。根据8 个苦味等级打分:0分-完全不苦,1 分-几乎无苦味,2 分-刚好可尝到苦味,3 分-微苦,4 分-中等苦味,5 分-带稍许强烈苦味,6 分-有强烈的苦味,7 分-非常强烈的苦味[24-26]。
2 结果与分析
2.1 豆粕中蛋白质的含量测定结果
经测定,豆粕中蛋白质含量为34.68%。当pH为7 时,按1.3.3 节方法测定未经蛋白酶水解过的豆粕中可溶性小肽含量为1.82%,说明豆粕中可溶性小分子肽含量较少。
2.2 蛋白酶的筛选
由图1a~d 可知,中性蛋白酶、复合风味蛋白酶、木瓜蛋白酶、胰蛋白酶随着加酶量增大、酶解时间延长,豆粕肽得率明显上升,且复合风味蛋白酶在酶解时间为7 h,加酶量为1.0%条件下豆粕得率最高。由图1e 可知,胃蛋白酶对豆粕肽得率的影响不显著,且得率偏低。故选择复合风味蛋白酶作为最优水解酶。
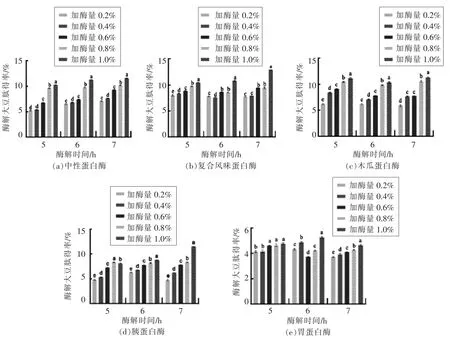
图1 酶解条件对酶解豆粕肽得率的影响Fig.1 Effect of enzymatic hydrolysis conditions on yield of soybean meal peptide by enzymatic hydrolysis
2.3 单因素实验结果
2.3.1 pH 值对肽得率的影响 由图2所示,当酶解pH 值为6~7 时,豆粕肽得率较高,这是由于溶液pH 值是决定蛋白酶催化活性的主要参数之一。一方面pH 值会改变试验底物的解离状态,影响其与蛋白酶的结合;另一方面,过酸过碱的试验环境,还可改变蛋白酶的空间构象,导致蛋白酶失活[27],故酶解pH 值确定为6.5 左右。
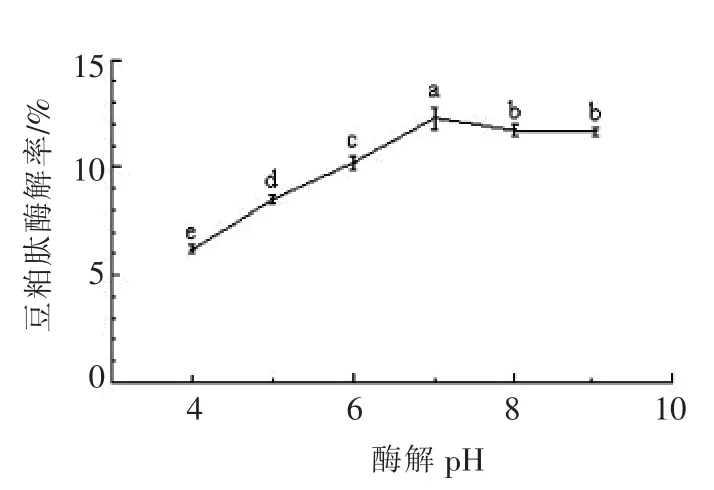
图2 酶解pH 值对酶解豆粕肽得率的影响Fig.2 Effect of enzymatic hydrolysis of pH value on yield of soybean meal peptide by enzymatic hydrolysis
2.3.2 酶解温度对肽得率的影响 由图3所示,当酶解温度45~55 ℃时,豆粕肽得率较高。适当的升温可以通过酶的催化作用提高豆粕肽得率,然而温度过高会导致酶失活,故酶解温度值确定为50 ℃左右。
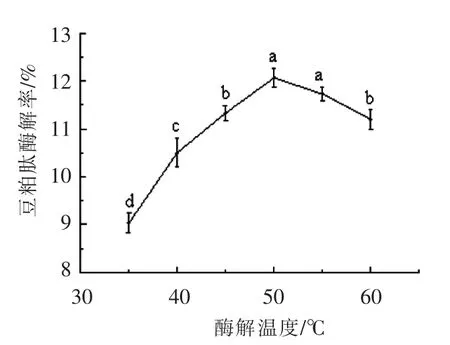
图3 酶解温度对酶解豆粕肽得率的影响Fig.3 Effect of enzymatic hydrolysis temperature on yield of soybean meal peptide by enzymatic hydrolysis
2.3.3 底物质量浓度对肽得率的影响 由图4所示,当底物质量浓度4.0 g/100 mL 左右时,豆粕肽得率较高。这是由于随着底物质量浓度的增加,酶解速度加快,但底物质量浓度过高时,一方面大量底物聚集在酶分子上,生成无活性的中间产物,不能释放出酶分子;另一方面高质量浓度底物降低了水的有效浓度,降低了分子扩散性,从而影响豆粕肽得率,故酶解底物质量浓度确定为4 g/100 mL。
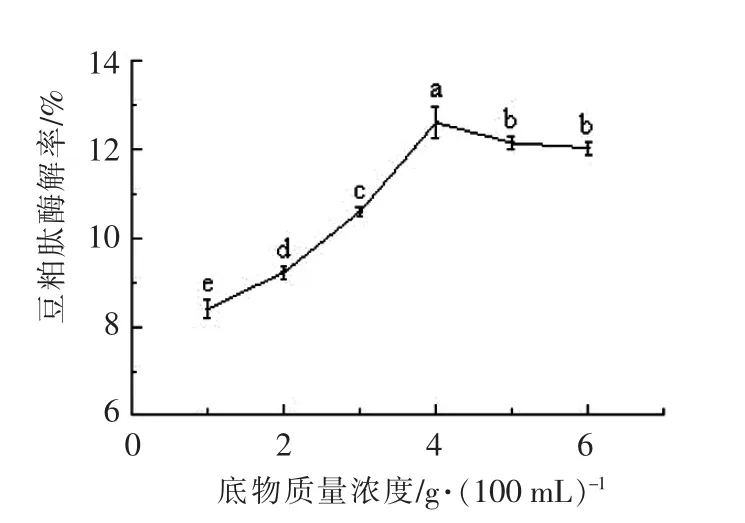
图4 底物质量浓度对酶解豆粕肽得率的影响Fig.4 Effect of enzymatic substrate concentration on yield of soybean meal peptide by enzymatic hydrolysis
2.3.4 加酶量对肽得率的影响 由图5所示,当加酶量0.9%~1.1%时,豆粕肽得率较高。随着加酶量的增加,豆粕肽得率呈现不断上升的趋势;当加酶量达到1.0%时豆粕肽得率增长趋于平缓。为降低成本,故加酶量为1.0%左右。
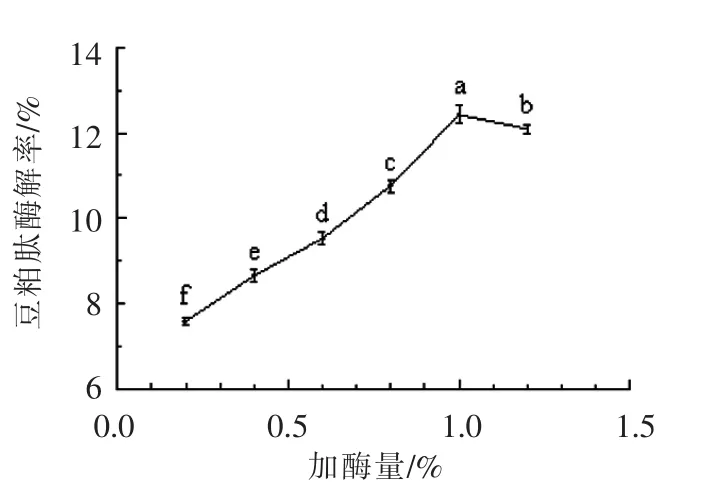
图5 加酶量对酶解豆粕肽得率的影响Fig.5 Effect of enzymatic hydrolysis of enzyme concentration on yield of soybean meal peptide by enzymatic hydrolysis
2.3.5 酶解时间对肽得率的影响 由图6所示,当酶解时间7 h 时,豆粕肽得率较高。随着时间的延长,肽得率随之升高,超过7 h 后,趋于平缓甚至下降,故酶解时间确定为7 h 左右。
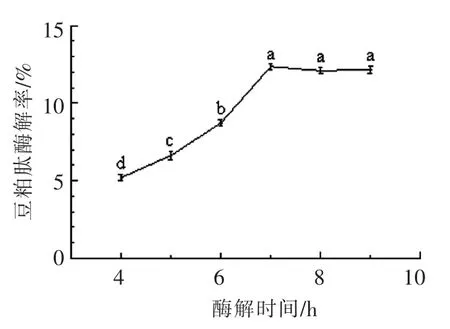
图6 酶解时间对酶解豆粕肽得率的影响Fig.6 Influence of enzymatic hydrolysis time on yield of soybean meal peptide by enzymatic hydrolysis
2.4 响应面法优化试验结果
2.4.1 响应面试验设计及回归模型的建立 以单因素实验结果为基础,以酶解时间(A)、加酶量(B)、底物质量浓度(C)3 个因素为相应变量,以肽得率为响应值(Y),设计三因素三水平试验17 组,结果见表3。
对表3进行回归分析,回归方程如下:

表3 试验方案和结果Table 3 Experimental scheme and results
Y=-21.60038+5.46488A+12.43150B+3.77038C-0.34750AB-0.021250AC-0.0075BC-0.35325A2-4.60200B2-0.44450C2。
对回归方程进行方差分析,结果见表4。

表4 回归模型方差分析及回归方程系数显著性检验Table 4 Significance test for variance analysis and coefficient constants of regression models
由表4可知,回归模型P<0.001,说明该模型极显著;一次项中,B 影响显著,A、C 影响不显著,说明单因素中加酶量对豆粕肽得率影响更显著。根据F 值大小,可以判断3 个因素对豆粕肽得率影响的主次顺序为加酶量(B)>酶解时间(A)>底物质量浓度(C);相互作用项AB 显著(P<0.05);失拟项不显著(P=0.4745>0.05),R2=0.9481 说明回归方程拟合度好,该模型成立,可进行分析和预测。
2.4.2 各因素之间交互作用对豆粕肽的率的影响 由图7可知,加酶量与酶解时间的交互作用较强,与表4的方差分析中显著性检验结果一致。
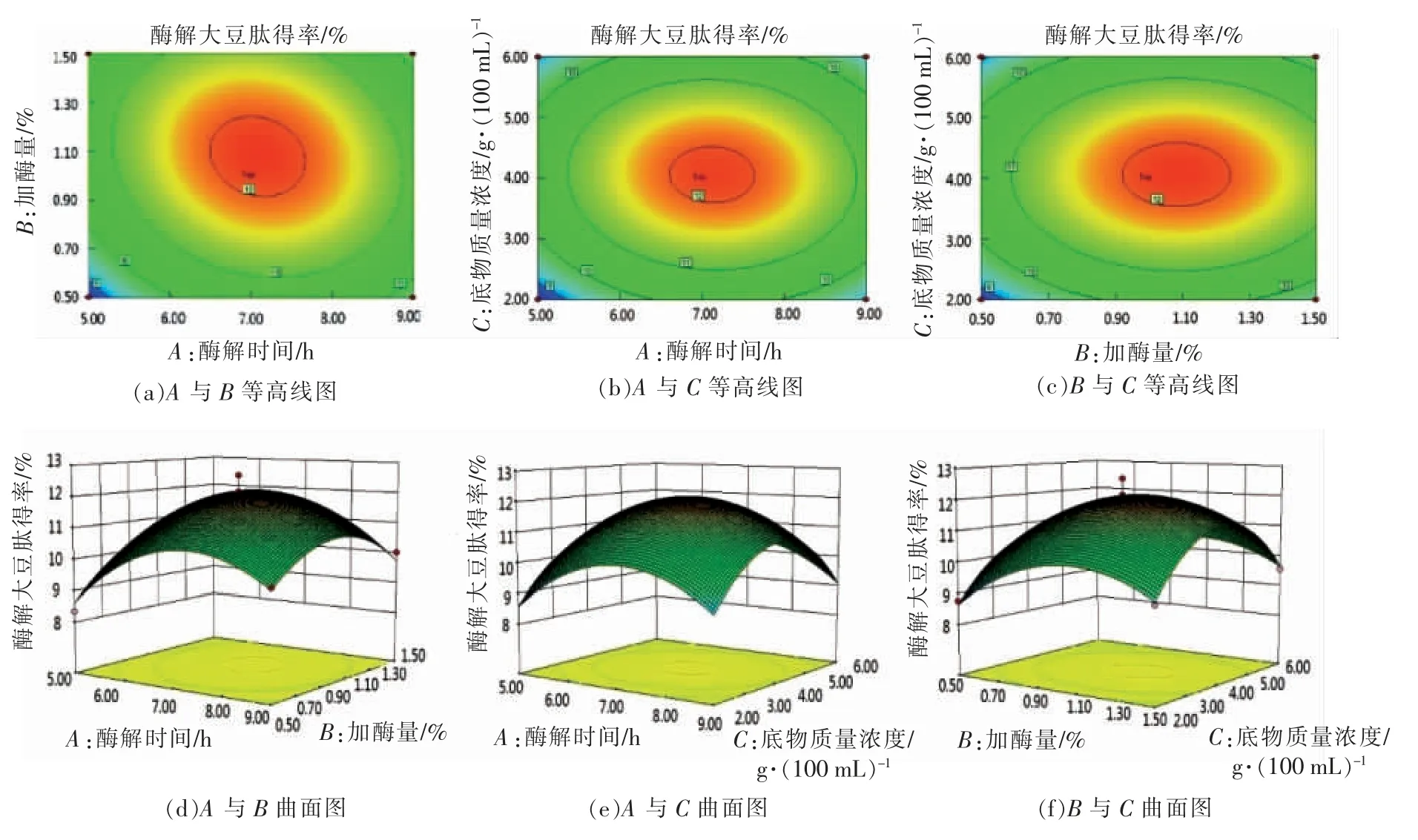
图7 各因子交互作用的等高线图和曲面图Fig.7 Contour maps and surface maps for each factor interaction
2.4.3 响应面优化验证 响应面优化最优条件:酶加量1.08%,酶解时间6.95 h,底物质量浓度4.06 g/100 mL,豆粕肽得率预测值为(12.42±0.06)%。为验证预测的准确性,考虑到实际操作的方便和经济效益,确定最优制备条件:酶加量1%,酶解时间7 h,底物质量浓度4 g/100 mL,酶解温度50 ℃,酶解pH 6.5。该条件下经过3 次平行试验,测得豆粕肽得率为12.63%,与理论预测值基本吻合,说明响应面分析法对豆粕肽制备条件优化是可行的。
2.5 感官评定结果与分析
对得到的酶水解上清液经感官评定小组评定,分值为:1,1,1,0,1 分,均值为0.8 分,说明复合风味蛋白酶酶解制备的豆粕肽液几乎无苦味。刘大川等[28]的试验表明,复合风味蛋白酶含有外切酶,能将处于肽键末端的多种疏水性氨基酸水解出来,因而会降低多肽的苦味,从而提高消费者对豆粕肽加工制品的接受度。
3 结论
本研究结合感官评定技术、采用响应面分析方法优化豆粕肽工艺参数,获得了苦味低且豆粕肽得率较高的制备方法。工艺简单,酶用量较少,酶解时间较短,符合大规模生产要求,为豆粕资源的开发利用提供了数据支持与参考。
