熊果酸对酒精诱导的大鼠小肠黏膜屏障损伤的保护作用
2021-09-09贾逸林杨冬晗李可欣张文龙王朝亮
贾逸林,杨冬晗,李可欣,张文龙,王朝亮,戈 娜*
(1 包头医学院营养与食品健康研究所 内蒙古包头 014040 2 包头医学院第一附属医院骨外科 内蒙古包头 014010 3 包头医学院公共卫生学院 内蒙古包头 014040)
世界卫生组织(WHO)2019年报道,全球饮酒人数多达24 亿,酗酒已成为世界性重大公共卫生问题[1]。酒中所含的主要成分酒精及其代谢产物是导致消化系统、神经系统、心血管系统和骨质疏松等多种疾病和伤害的共同原因[2-3]。肝脏作为代谢酒精的主要场所,长期和/或过量饮酒会导致酒精性肝损伤,又称酒精性肝病 (Alcohol liver disease,ALD)。现有研究发现,肠道黏膜屏障和ALD 的发生发展紧密相关。ALD 患者肠黏膜屏障稳定性降低,通透性增加,肠道菌群组成发生变化[4]。动物实验也表明,ALD 大鼠的肠上皮细胞受损严重,绒毛高度明显缩短;血浆内毒素水平增高,肠黏膜屏障功能被破坏[5]。此外,由于过量饮酒导致小肠黏膜通透性增加,使得肠腔中革兰氏阴性菌过度繁殖产生的过量内毒素穿越肠黏膜屏障渗漏入血,形成肠源性内毒素血症,进而通过Toll样受体激活肝巨噬细胞,分泌大量促炎细胞因子,进一步加重炎症反应和肝脏损伤[6]。有效改善肠黏膜损伤,成为目前防治ALD 的新思路。
熊果酸(UA)是一种天然的α-香树脂烷型五环三萜类化合物,广泛存在于山楂、熊果、女贞子等植物中[7]。它不仅具有抗炎、抗癌、抗氧化及抑菌等多种生物学活性[8-10],还具有安全性高、毒性低(口服LD50为8 330 mg/kg)的优点[11]。有研究发现,UA 可减轻ALD 啮齿动物的脂质过氧化,抑制氧化应激和炎性因子的大量释放[12-13]。本课题组前期发现,UA 可通过改善肠道菌群失调,调节肠道微环境,减少内毒素的产生和释放,从而缓解ALD大鼠肝脏损伤[14]。然而,UA 是否可通过保护肠黏膜机械屏障进而发挥其肝脏保护作用鲜有报道。本研究探讨UA 对酒精致大鼠小肠黏膜屏障损伤的保护作用,为应激状态下肠黏膜屏障保护研究提供依据。
1 材料与方法
1.1 动物
2月龄雄性SD 大鼠,SPF 级,40 只,体质量180~200 g,购自北京市中国食品药品鉴定研究院(大兴),动物合格证号:SCXK(京)2017-0005。
1.2 材料与试剂
熊果酸(纯度98%),长沙麓园生物科技有限公司;谷氨酰胺;日本寿制药株式会社;无水乙醇(纯度99.9%),天津市凯通化学试剂有限公司(灌胃前用生理盐水稀释至50%纯度);D-乳酸 (DLA)试剂盒;江苏酶标生物科技有限公司;肠脂肪酸结合蛋白(FABP2)试剂盒,武汉Elabscience 生物公司,肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)试剂盒,依科赛生物公司。免疫印迹所需BCA 蛋白浓度测定试剂盒、超敏ECL 化学发光试剂盒、RIPA 裂解液、苯甲基磺酰氟(PMSF)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGF)蛋白上样缓冲液,江苏碧云天生物研究所;聚偏二氟乙烯(PVDF)膜,美国Millpore 公司;一抗(兔抗):叉头框转录因子O4(FOXO4)、磷酸化叉头框转录因子O4(p-FOXO4)、闭锁小带蛋白-1(ZO-1);美国Abcam 公司,二抗:辣根酶标记山羊抗兔IgG;北京中杉金桥生物技术有限公司。
1.3 主要仪器
JEM1200EX 透射电镜,日本电子株式会社;ELx808 型酶标仪,美国Bio-Tek 公司;电泳仪、UVP-GDS-8000 凝胶成像分析系统,美国Bio-Red公司。
1.4 方法
1.4.1 动物分组及给药方法 大鼠适应性喂养1周后,按照随机数字表进行完全随机分组。共分为4 组,每组10 只,分别是正常对照组、酒精模型组、熊果酸组和谷氨酰胺组。正常对照组每日给予生理盐水灌胃;酒精模型组前2 周给予50%酒精8 mL/(kg bw·d)灌胃,第3 周把酒精剂量提高至12 mL/(kg bw·d),持续灌胃6 周;熊果酸组给予150 mg/(kg bw·d)熊果酸灌胃;谷氨酰胺组给予300 mg/(kg bw·d)谷氨酰胺灌胃,后2 组受试物灌胃1 h 后再给予酒精灌胃,熊果酸组和谷氨酰胺组酒精剂量同模型组,试验持续8 周。依据每周体重测量结果,及时调整灌胃量。末次灌胃并禁食12 h 后,用1%戊巴比妥钠按0.5 mL/100 g 剂量进行腹腔麻醉,腹主动脉取血,室温下静置30 min后,3 500 r/min 离心15 min,分离血浆,同时留取小肠组织,固定部分小肠组织用于观察组织病理学变化,其余部分-80 ℃保存用于后续试验。
1.4.2 小肠组织HE 染色观察 取回盲部小肠组织1 cm3于4%的多聚甲醛中固定过夜,经石蜡包埋、切片、脱蜡、苏木精-伊红(Hematoxylin-eosin,HE)染色、中性树胶封片,在光学显微镜下观察小肠组织形态学变化。
1.4.3 小肠组织超微结构观察 小肠分离为1 mm3于2.5%戊二醛固定4 h,用0.1 mol/L 磷酸缓冲液冲洗数遍后固定于1%的氧化锇中,最后用环氧树脂包埋,制成超薄切片(70 nm),2%乙酸铀酰和3%柠檬酸铅双重染色,透射电镜下观察大鼠小肠超微结构。
1.4.4 大鼠血浆中TNF-α、IL-1β、D-LA 和FABP2 水平检测 采用ELISA 法检测血浆TNFα、IL-1β、D-LA 和FABP2 含量,试验步骤按照试剂盒说明书进行。
1.4.5 免疫印迹法检测大鼠小肠组织ZO-1 和FOXO4/p-FOXO4 的蛋白表达量 裂解小肠组织并提取总蛋白,测定蛋白浓度,经SDS-聚丙烯酰胺凝胶电泳分离蛋白样品后将蛋白转移到PVDF膜上,以5%脱脂奶粉封闭2 h,按操作步骤加入相应一抗(抗体体积比为1∶1 000),4 ℃孵育过夜。洗膜后再加入HRP 酶标记的二抗稀释液孵育。ECL 显影,采用凝胶成像系统拍照并分析蛋白条带灰度值。

1.5 统计学分析
应用SPSS 17.0 软件分析试验数据。符合正态分布且方差齐的计量资料,采取单因素方差分析(one-way ANOVA)比较组间差异,结果以±s表示,不同组间两两比较采用LSD-t 检验,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 熊果酸对酒精诱导大鼠小肠组织病理学改变的影响
由图1可知,正常对照组小肠绒毛排列整齐,未见水肿及炎性细胞浸润,而酒精模型组小肠绒毛萎缩、变短,黏膜层有大量炎症细胞浸润,腺体数目减少,局部可见残留的腺体。熊果酸组与谷氨酰胺组小肠绒毛排列情况有明显改善,浸润的炎症细胞不明显,说明UA 对酒精诱导的大鼠肠黏膜损伤具有一定的保护作用。

图1 HE 染色法观察大鼠小肠组织病理学改变(200×)Fig.1 The histopathological changes of small intestine observed by HE staining in rats(200×)
2.2 熊果酸对酒精诱导大鼠小肠组织超微结构的影响
由图2可知,正常对照组大鼠小肠微绒毛致密丰满,排列有序,无损伤,紧密连接完整清晰,线粒体形态正常,内嵴分明。酒精组模型组大鼠小肠微绒毛大量脱落,肿胀明显,长度缩短,紧密连接肿大,线粒体结构受损。熊果酸组与谷氨酰胺组大鼠小肠微绒毛排列较为齐整,紧密连接肿大及线粒体病变也有所缓解,再次印证UA 能够保护酒精所致的小肠黏膜损伤。

图2 各组大鼠小肠黏膜细胞超微结构Fig.2 Ultrastructure of intestinal mucosal cells of each group
2.3 熊果酸对酒精诱导大鼠血浆D-LA 和FABP2 含量的影响
由表1可知,酒精模型组大鼠血浆D-LA 和FABP2 质量浓度较正常对照组显著升高(P≤0.05)。与酒精模型组相比,熊果酸组和谷氨酰胺组D-LA 和FABP2 质量浓度明显降低(P≤0.05)。虽然熊果酸组D-LA 和FABP2 质量浓度在数值上较正常对照组和谷氨酰胺组略高,但均无统计学差异(P>0.05)。上述结果表明,酒精的摄入可以导致肠黏膜通透性的增加,而UA 与谷氨酰胺一样,具有保护肠黏膜的作用。
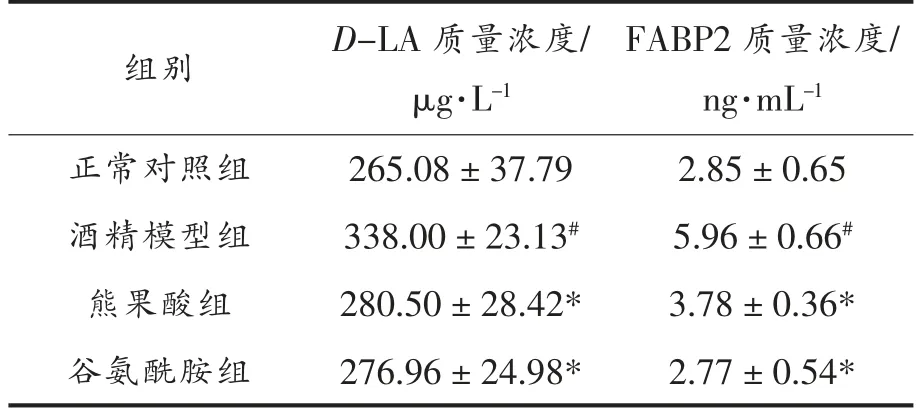
表1 熊果酸对大鼠血浆中D-LA 和FABP2含量的影响Table 1 Effects of UA on contents D-LA and FABP2 in rats plasma
2.4 熊果酸对酒精诱导大鼠血浆TNF-α 和IL-1β 含量的影响
由表2可知,酒精模型组大鼠血浆TNF-α 和IL-1β 质量浓度较正常对照组明显升高(P<0.05),而UA 和谷氨酰胺干预显著抑制了酒精所致的TNF-α 和IL-1β 质量浓度升高,且差异具有统计学意义(P<0.05)。同时,正常对照组、熊果酸组及谷氨酰胺组三者间的TNF-α 和IL-1β 质量浓度并无统计学差异(P>0.05),提示UA 能够调节促炎因子表达,减轻酒精导致的大鼠肠道炎症反应。
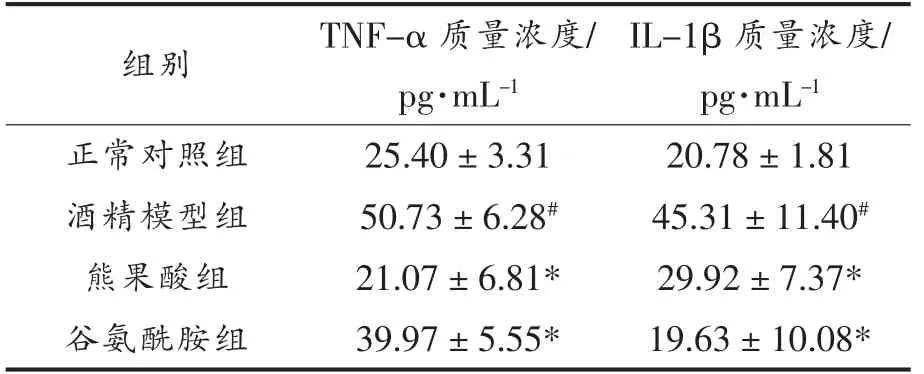
表2 熊果酸对大鼠血浆中TNF-α 和IL-1β含量的影响Table 2 Effects of UA on contents TNF-α and IL-1β in rats plasma
2.5 熊果酸对酒精诱导大鼠ZO-1、FOXO4 和p-FOXO4 蛋白表达的影响
如图3所示,与正常对照组相比,酒精模型组大鼠小肠组织中ZO-1 蛋白表达量显著降低,p-FOXO4 的蛋白表达量明显升高,差异均具有统计学意义(P<0.05)。与酒精模型组相比,熊果酸组和谷氨酰胺组大鼠小肠组织ZO-1 蛋白表达量明显增加,而p-FOXO4 蛋白表达量明显降低,且差异均具有统计学意义(P<0.05),这也说明UA 能明显缓解酒精诱导引起的ZO-1 蛋白表达降低,减少FOXO4 的磷酸化表达。
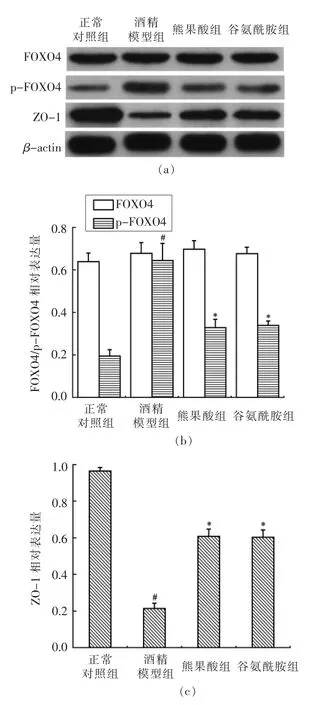
图3 熊果酸对酒精诱导大鼠ZO-1、FOXO4 和p-FOXO4 蛋白表达的影响Fig.3 Effects of UA on ZO-1,FOXO4 and p-FOXO4 protein expression in alcohol-treated rats
3 讨论
肝脏与肠道在解剖结构和生理功能上具有密切的联系。肠道将富含水、各种营养素和微生物分解产物的血液以不同的途径通过门静脉运送至肝脏代谢,二者间各因素产生的信号相互作用形成“肠—肝轴”[15]。目前的研究发现,大量饮酒不仅对肝脏造成损害,还会导致肠黏膜屏障受损。Shao等[16]发现酒精暴露小鼠体内血清谷丙转氨酶和内毒素的水平升高,肝脏可见大量中性粒细胞浸润,TNF-α、IL-6 mRNA 表达量显著增加,部分肝组织发生纤维化;同时,肠紧密连接蛋白表达降低,肠道屏障完整性遭到破坏。Antón 等[17]利用酒精喂养大鼠一段时间后发现,它们的结肠微绒毛缺失,紧密连接扩大,炎性细胞增多,肠组织中TNF-α水平升高,ZO-1 表达下降,表明大量酒精摄入会降低肠黏膜屏障的完整性,引发肠道内炎症反应增强。本文HE 染色结果显示,肠组织正常对照组大鼠小肠绒毛排列整齐,未见水肿及炎性细胞浸润,而酒精模型组大鼠小肠绒毛萎缩、变短,黏膜层有大量炎症细胞浸润。熊果酸组大鼠小肠绒毛排列情况有明显改善,浸润的炎症细胞不明显。电镜结果显示,正常对照组微绒毛致密丰满,排列有序,紧密连接完整;酒精模型组微绒毛脱落肿胀,紧密连接受损;熊果酸组较酒精模型组损伤情况明显改善。以上结果均说明酒精破坏了小肠黏膜和紧密连接的完整性,而UA 对酒精引起的小肠黏膜损伤有保护作用。
众所周知,肠黏膜通透性改变能准确反映肠道屏障功能,而血浆D-LA 和FABP2 水平常作为肠道屏障损伤敏感评价指标用于肠黏膜屏障功能的评价。当肠上皮细胞脱落时,肠黏膜通透性增加,肠道菌群发酵产生的D-LA 从黏膜受损处入血[18]。FABP2 是仅存在于成熟的小肠黏膜微绒毛顶端的低分子蛋白物质,具有较好的器官特异性[19]。正常生理状态下,D-LA 和FABP2 水平较低,当酒精刺激或其它应激反应导致肠黏膜受损时,D-LA和FABP2 会释放入血,导致血浆中二者水平升高[20-21]。本研究结果表明,酒精模型组相较于正常对照组大鼠血浆中D-LA 与FABP2 的质量浓度明显升高;UA 干预后,大鼠血浆中D-LA 与FABP2 的水平显著降低,表明摄入UA 可修复酒精对大鼠肠黏膜屏障造成的损伤。
肠道屏障主要由肠上皮细胞通过紧密连接蛋白和黏合连接蛋白与临近细胞紧密结合构成,是保护肠黏膜免受有害因素侵袭的重要保障[22]。细菌等大分子物质主要通过肠上皮细胞的胞吞作用和细胞旁隙穿透肠黏膜上皮[23],肠上皮细胞连接直接决定了细胞旁隙的紧密程度。在众多连接方式中,紧密连接最为重要。ZO-1 作为膜结合鸟苷酸激酶家族中形成紧密连接所必需的多域支架蛋白,在维持紧密连接结构和功能方面起着不可替代的作用[24]。随着ZO-1 表达的变化,紧密连接的结构和功能也发生相应的变化,因此,通过检测ZO-1 蛋白,可间接反映肠道黏膜的完整性和通透性变化[25]。有学者通过研究肠上皮Caco-2 细胞发现,加入乙醇可使Caco-2 细胞间的紧密连接蛋白遭到破坏,从而使肠上皮细胞屏障通透性增加[26]。免疫印迹结果显示,酒精模型组大鼠ZO-1 表达量明显低于其它3 组,熊果酸组ZO-1 表达量显著增多,但仍低于正常对照组,这说明大量酒精摄入后可能通过破坏肠上皮细胞间紧密连接,使肠道通透性增加,而适量补充UA 可修复肠上皮紧密连接,改善肠道通透性。
TNF-α 和IL-1β 作为促炎细胞因子,在炎症反应中具有重要的调节作用。持续的酒精摄入会刺激肠上皮细胞释放TNF-α、IL-1β 等促炎细胞因子[27]。有研究表明,TNF-α 和IL-1β 可通过肌球蛋白轻链激酶途径引起Caco-2 细胞ZO-1 表达下降,增加肠上皮紧密连接通透性[28]。此外,肠黏膜对酒精及其代谢产物乙醛的氧化能力非常弱,长期酒精摄入会使细胞间紧密连接蛋白和黏合连接蛋白重新分配,肠黏膜通透性进一步增加,导致内毒素大量释放入血并通过门静脉入肝,引起炎症反应,使得肝细胞损伤[29-30]。本课题组前期研究发现,大量酒精的摄入导致大量的内毒素产生,而UA 干预能够减少内毒素的产生和释放[14]。本次试验中可以看到酒精造成了大鼠血浆TNF-α、IL-1β 质量浓度升高,病理切片也显示腺体数目减少,部分腺体被破坏,可见炎性细胞浸润;而UA干预后,能够显著降低TNF-α、IL-1β 水平,改善肠黏膜上皮形态及减轻炎性细胞浸润。说明UA能通过降低促炎因子TNF-α、IL-1β 的表达保护肠黏膜屏障。
叉头框转录因子O4 是叉头框蛋白家族中“O”亚家族成员之一,主要分布于胃肠道,具有调控细胞增殖、分化、凋亡等多种生物学功能[31-32]。研究表明,FOXO4 可能通过调节紧密连接蛋白表达从而保护肠黏膜屏障。Zhou 等[33]发现,体内FOXO4 缺失上皮细胞和体外培养FOXO4 缺失上皮细胞中紧密连接蛋白表达降低可能为FOXO4 缺失小鼠肠黏膜屏障受损提供了结构基础。此外,FOXO4 还可能通过干扰核因子κB(NF-κB)进入细胞核以及直接抑制NF-κB 的转录活性发挥肠黏膜保护作用。Chang 等[34]在ALD 大鼠模型中看到血清中TNF-α 水平升高,会使FOXO4 发生磷酸化出核而失去活性,磷酸化的FOXO4 无法抑制NF-κB 的转录活性,启动炎症介质基因的转录,使促炎细胞因子 (如TNF-α、IL-1β 和IL-6 等)分泌、释放,引发炎症反应,致使肠紧密连接受损,最终导致肠黏膜屏障功能破坏,进而加重肝脏损伤。本研究结果表明,与酒精模型组相比,补充UA 后大鼠小肠组织中p-FOXO4 蛋白表达量明显降低,FOXO4 的磷酸化得到有效的抑制,提示UA 对酒精所致肠黏膜损伤具有改善作用,其机制可能与抑制FOXO4 的磷酸化,进而减轻炎症反应的发生有关。
4 结论
本研究发现,长期和/或大量的酒精摄入会造成肠黏膜屏障受损。UA 对酒精致肠上皮黏膜损伤有保护作用,其机制可能与改善肠黏膜通透性,减少促炎细胞因子释放,抑制FOXO4 蛋白发生磷酸化有关。
