新型水解蛋清蛋白短肽对大鼠结肠炎症的保护作用
2021-09-09魏秋红刘晓月翟婧卉宋燕青
魏秋红,高 欢,刘晓月,翟婧卉,宋燕青
(吉林大学第一医院药学部 长春 130000)
炎症性肠病 (Inflammatory bowel disease,IBD)主要病变部位是结肠黏膜和黏膜下层,临床表现为腹痛、腹泻及血便等[1]。相关研究表明,炎症因子、活性氧以及外源性有害物质均能够导致机体自发免疫通路活化,直接或间接调控炎症通路的激活和炎症因子的释放,最终导致肠黏膜病理性损伤[2]。
通过不同酶解方法可获得具有抗炎、抗病毒、抗高血压和抗肿瘤等功能的蛋清蛋白活性肽,在营养食品和药物研发方面具有重要的意义[3-4]。本研究用水解蛋清蛋白短肽(HEpep)是以蛋清蛋白为原料,通过酶解方法获得平均分子质量为1 300 u 的短肽,拟建立LPS 所致大鼠结肠炎症模型,通过免疫组化染色、生化试剂盒检测等多种技术手段观察HEpep 对大鼠结肠炎是否具有缓解作用,分析其作用机制。
1 材料与方法
1.1 实验动物
SPF 级雄性SD 大鼠60 只(200~220 g),由吉林大学实验动物中心提供,动物合格证号:0191551。所有大鼠饲养于吉林大学实验动物中心,保证光照/黑暗时间各12 h 循环交替;保证大鼠正常饮食和饮水;实验动物使用许可证号:SYXK(吉)2018-0001。
1.2 材料与试剂
超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒、过氧化氢酶(Catalase,CAT)检测试剂盒,碧云天生物科技有限公司。肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)试剂盒,联科生物科技有限公司;TUNEL 试剂盒,罗氏生物科技公司;DAB 显色试剂盒(20×)、KIT-9921 即用型免疫组化试剂盒(鼠/兔),福州迈新试剂生物技术开发有限公司;其它试剂均为国产分析纯级。
1.3 仪器与设备
分析天平 (精度0.001 g),日本岛津公司;BX53 生物光学显微镜,Olympus 公司;高速低温离心机,BIO-RAD 公司;7600-210 酶标仪,HITACHI 公司;RM2235 石蜡切片机,Leica 公司;1525 高效液相色谱仪、2487 紫外检测器,Waters公司。
1.4 水解蛋清蛋白肽的制备
1.4.1 水解蛋清蛋白肽的制备工艺 水解蛋清蛋白短肽(HEpep,Mw=1 310 u)制备工艺如下:蛋清蛋白→酶解→酶解液→膜分离→浓缩喷雾干燥→蛋清蛋白肽。
1.4.2 水解蛋清蛋白肽分子质量的测定 采用高效液相色谱仪进行分子质量的测定;色谱柱为TSKgel 2000 SWXL 300 mm×7.8 mm,流动相为V乙腈∶V水∶V三氟乙酸=45∶55∶0.1;检测波长220 nm,流速0.5 mL/min,柱温30 ℃[5]。
1.4.3 HEpep 氨基酸含量的测定 准确称取HEpep 样品0.5 g 于水解管中,加入5 mL 水溶解并滴加适量浓盐酸,混匀。向水解管中充入高纯氮气,采用酒精喷灯密封水解管,冷却后置于(105±1)℃的恒温干燥箱内水解21 h。冷却后将水解液转移至20 mL 刻度试管定容。吸取滤液1 mL 至10 mL 刻度试管中,于40~50 ℃真空条件水浴加热干燥。残留物经0.02 mol/L 盐酸溶液溶解后定容至10 mL,0.2 μm 滤膜过滤后上机检测[6]。
1.5 试验方法
1.5.1 动物分组及样品采集 60 只雄性SD 大鼠随机分为空白组、模型组、蛋清蛋白肽高剂量组和低剂量组,每组15 只。HEpep 高【2 g/(kg·d)】、低剂量组【1 g/(kg·d)】连续7 d 分别灌胃给药,空白组和模型组采用生理盐水进行同步处理;第7 天给药结束后,所有大鼠腹腔注射LPS 10 mg/kg,给药8 h 后经腹主动脉取血并收集结肠组织,用于生化指标检测和HE 染色。
1.5.2 生化指标的测定 按照试剂盒说明书对各组SD 大鼠血清和组织中的SOD 活力、MDA 水平、CAT 活力、TNF-α 和IL-6 含量进行检测,并根据标准品浓度建立标准曲线,计算血清和组织中各项指标的含量。
1.5.3 结肠组织HE 染色 取各组结肠接近部位新鲜组织于10%多聚甲醛中固定、脱水,经石蜡包埋后切片,HE 染色观察结肠组织的病理变化。
1.5.4 TUNEL 染色检测细胞凋亡 采用TUNEL染色法检测组织细胞凋亡情况。根据试剂盒说明书进行操作:常规石蜡切片脱蜡→经蛋白酶K 工作液在37 ℃处理15 min→PBS 冲洗3~5 次→加入TUNEL 反应混合液(含TdT 酶和dUTP)→反应体系放于暗盒中37 ℃孵育1 h→PBS 冲洗3~5次→加封闭液,放于暗盒中37 ℃孵育0.5 h→PBS冲洗3~5 次→加入DAB 底物,室温反应5 min→PBS 冲洗3~5 次→苏木素复染→切片经梯度酒精、二甲苯依次处理后,中性树胶封片→采用光学显微镜观察并拍照。
1.5.5 数据处理 应用SPSS 18.0 统计软件进行统计学分析。数据以±s 表示,多组间采用单因素方差分析,以P<0.05 为存在显著性差异。
2 结果与分析
2.1 HEpep 分子质量分布
采用高效液相色谱法测定HEpep 分子质量分布,结果见图1,检测结果表明,HEpep 主要由小分子肽组成,其中分子质量在2 500 u 以下的组分大于95%,平均分子质量1 310 u。
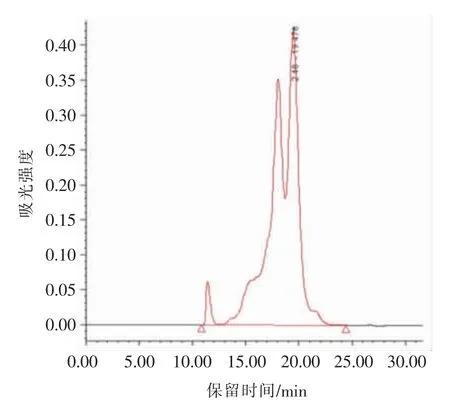
图1 HEpep 分子质量分布图谱Fig.1 Molecular weight distribution of HEpep
2.2 HEpep 的氨基酸含量检测结果
本研究对HEpep 的氨基酸含量进行分析,结果如表1所示,HEpep 中必需氨基酸占氨基酸总量的35.92%。
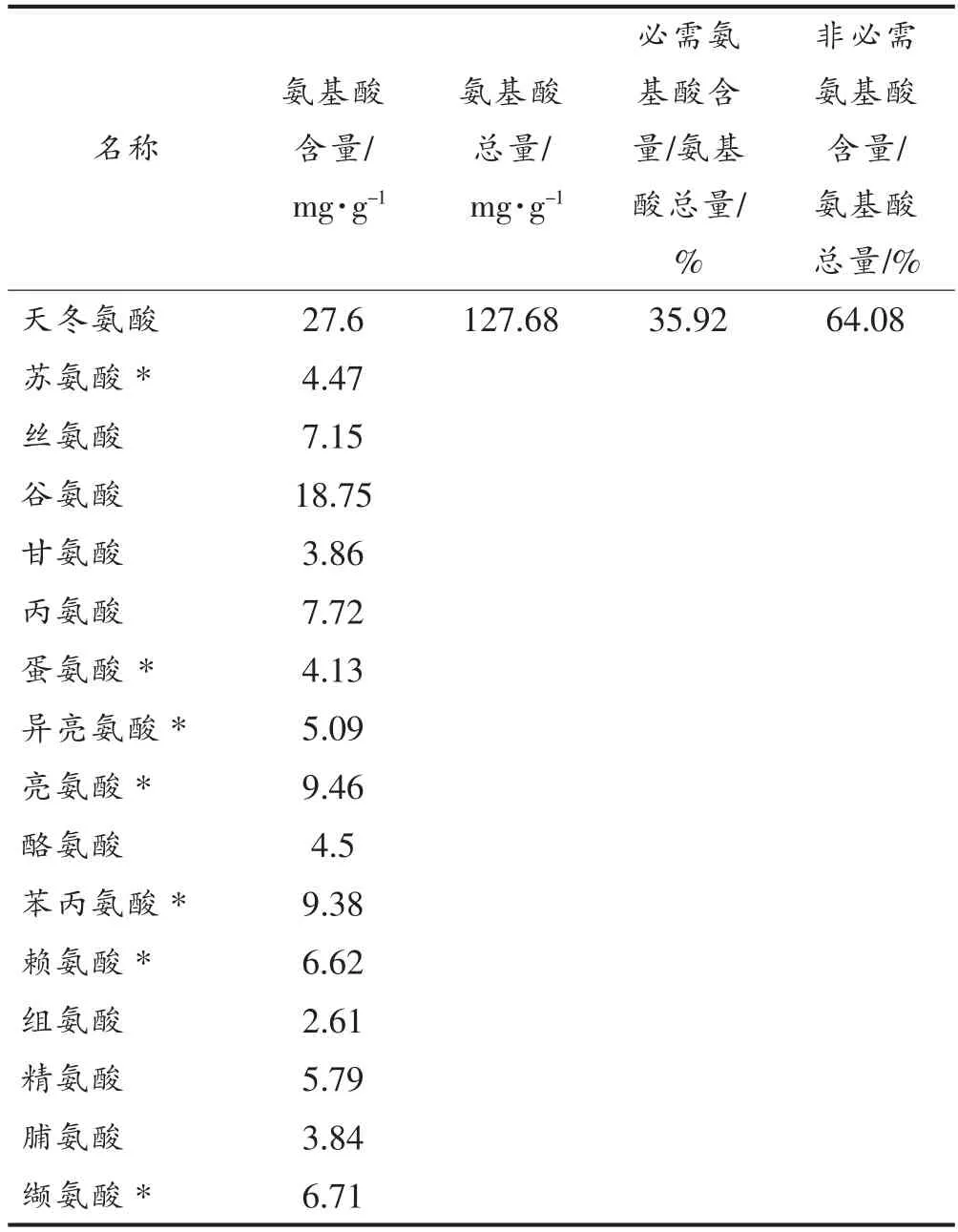
表1 HEpep 的氨基酸含量检测结果Table 1 Results of amino acid content of HEpep
2.3 HEpep 对大鼠结肠组织病理学变化的影响
如图2所示,空白组结肠组织表面光滑,无溃疡、炎症及水肿出现;模型组结肠组织出现明显的炎性变化,肠腔内大量炎细胞浸润,肠上皮出现嗜酸性变、破损,杯状细胞大量缺失、固有层较多炎细胞浸润;HEpep 低剂量组部分肠上皮细胞、结肠腺上皮细胞出现嗜酸性变,固有层较多炎细胞,整体损伤情况较模型组减轻;HEpep 高剂量组结肠组织肠腔内炎细胞少见,上皮黏膜层较为规整,固有层炎细胞浸润减少,炎症反应明显减轻,说明HEpep 能够缓解LPS 所致大鼠结肠炎症损伤,其保护作用随给药剂量的增加而增加。
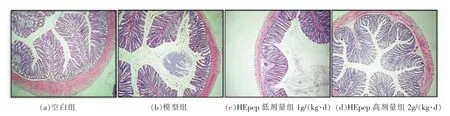
图2 大鼠远端结肠组织病理学HE 染色(×40)Fig.2 HE staining of distal colonic tissues in rats(×40)
2.4 HEpep 对大鼠结肠组织和血清中炎症因子水平的影响
试验结果表明,与空白组相比模型组大鼠结肠组织和血清中的炎症因子均显著升高,而HEpep 处理能够有效降低血清及组织中的炎症因子水平,其中高剂量组改善效果更加明显。
2.5 HEpep 对大鼠血清抗氧化能力的影响
试验结果表明,与空白组相比LPS 模型组大鼠血清中的抗氧化物质SOD 和CAT 活力显著下降(P<0.05),而脂质过氧化物MDA 水平显著升高,提示存在氧化应激损伤;与模型组相比不同剂量蛋清蛋白肽组SD 大鼠血清中抗氧化物水平均不同程度升高,MDA 水平下降,其中高剂量组改善效果更加明显。
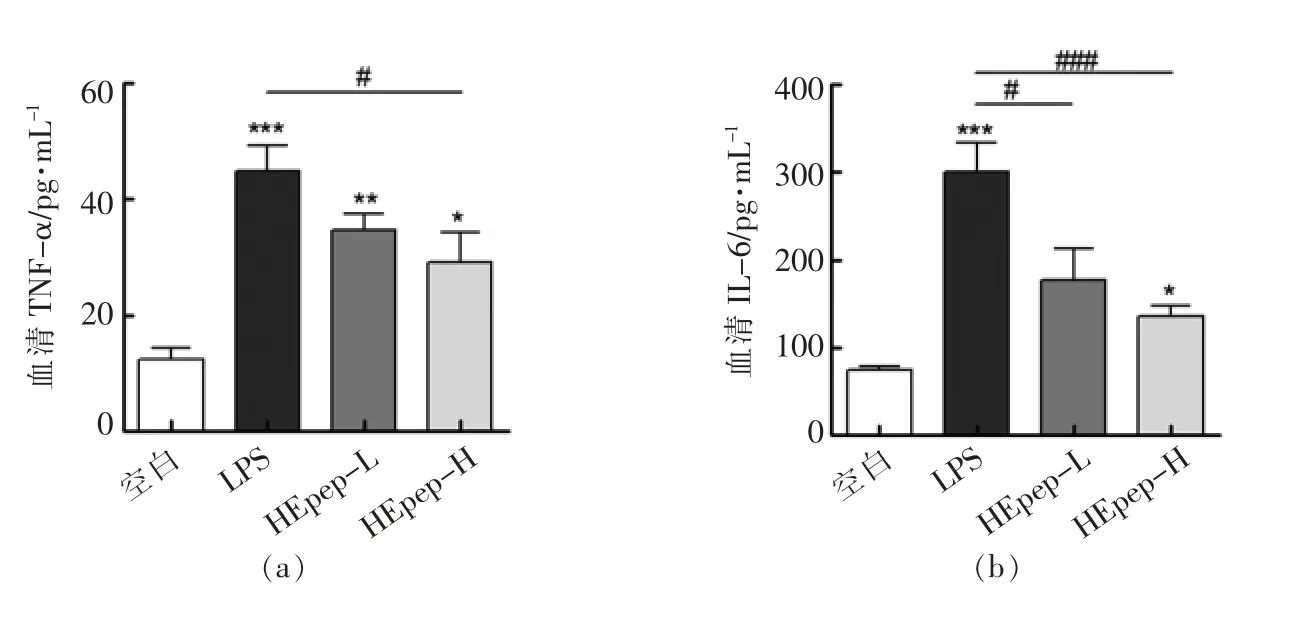
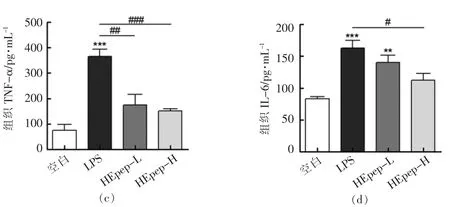
图3 HEpep 对大鼠结肠组织和血清中炎症因子水平的影响Fig.3 Effects of HEpep on the levels of inflammatory factors in colon tissues and serum
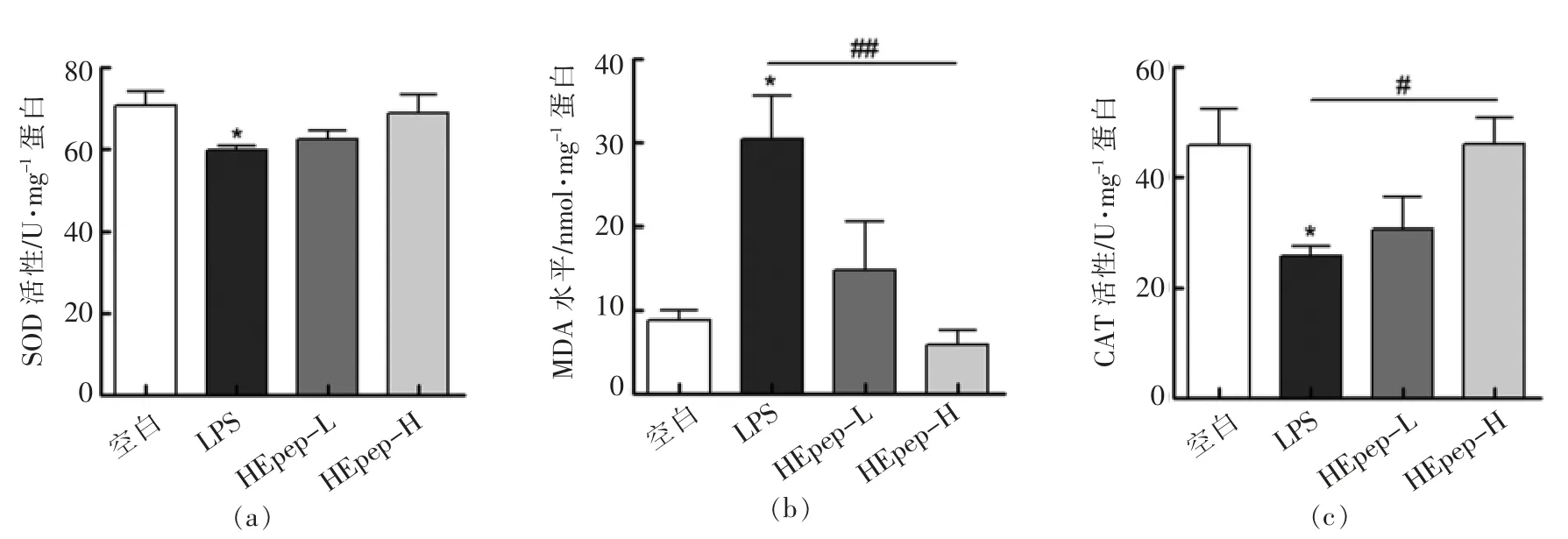
图4 HEpep 对大鼠血清抗氧化能力的影响Fig.4 Effects of HEpep on the antioxidant capacity in serum
2.6 HEpep 对大鼠结肠组织抗氧化能力的影响
试验结果表明,与空白组相比LPS 模型组大鼠结肠组织中的抗氧化物质SOD 和CAT 酶活力显著下降(P<0.05),而脂质过氧化物MDA 水平显著升高,提示存在氧化应激损伤;与模型组相比不同剂量HEpep 组SD 大鼠结肠组织中抗氧化物水平均不同程度升高,MDA 水平下降,其中高剂量组改善效果更加明显。
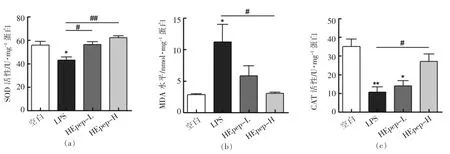
图5 HEpep 对大鼠结肠组织抗氧化能力的影响Fig.5 Effects of HEpep on the antioxidant capacity in colon tissues
2.7 HEpep 对大鼠结肠上皮细胞凋亡的影响
TUNEL 法能够标记出凋亡细胞的数量和分布,光学显微镜下观察细胞呈深棕色为凋亡细胞。图6表明,空白组大鼠结肠上皮偶见凋亡细胞,模型组凋亡细胞明显增多,说明LPS 诱导炎症反应发生,促使细胞凋亡,使结肠上皮黏膜屏障受损;HEpep 低、高剂量组使结肠上皮细胞凋亡明显减少,表明HEpep 能够缓解LPS 所致炎症反应,使结肠上皮黏膜屏障损伤减轻,抑制细胞凋亡。
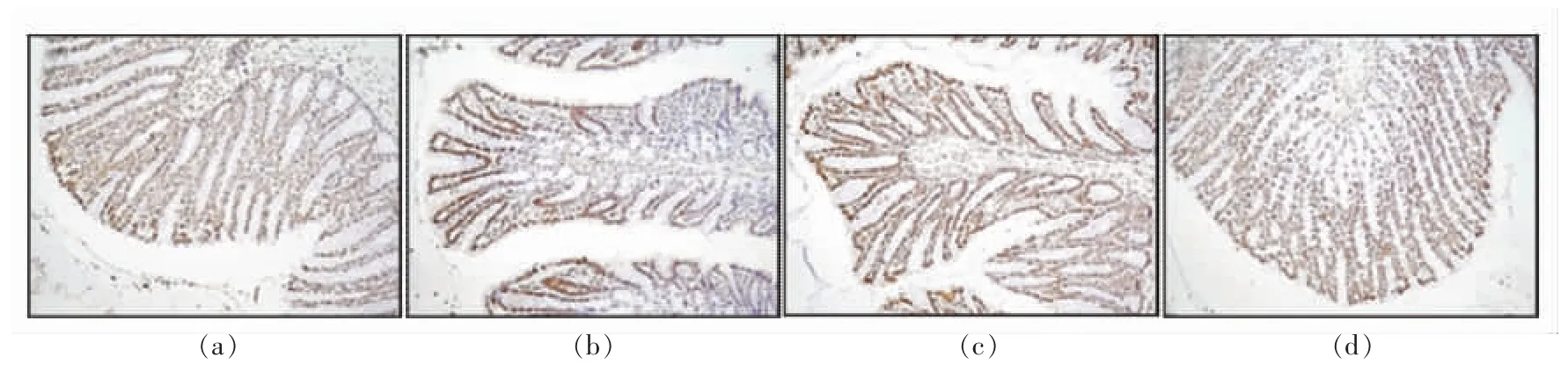
图6 大鼠结肠组织TUNEL 染色结果(×100)Fig.6 TUNEL staining of colon tissues(×100)
3 结论与讨论
蛋清蛋白因其广泛的生物学特性,在营养食品和制药工业的开发和研究中广泛应用[7-8]。蛋清蛋白不仅在人类日常饮食中提供营养,在体内经胃肠蛋白酶解消化后产生的生物活性肽也具有重要的调节功能[3-4]。相关研究表明,蛋清蛋白经胃肠蛋白酶(如胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶)和植物、微生物来源蛋白酶(如木瓜蛋白酶、碱性蛋白酶和热溶酶)水解后可获得不同肽链长度的活性蛋白肽[9],而不同的肽序列生物功能各异,包括抑制血管紧张素转化酶(Angiotensin converting enzyme,ACE)、抗氧化、抗炎、抑制铁/钙离子结合以及缓解高血压、糖尿病等,因此具有重要的研究价值[10-12]。相关研究表明,蛋清多肽(如RADHPFL、YAEERYPIL 和IVF)口服或注射给药时通过有效抑制ACE 活性,对于自发性高血压大鼠的降压效果与卡托普利持平甚至更优[13]。蛋清蛋白通过酶解作用可产生抗氧化氨基酸,包括半胱氨酸、蛋氨酸、色氨酸、酪氨酸、苯丙氨酸和组氨酸等[14],可清除体内超氧阴离子和羟自由基(·OH)[15],维持机体氧化还原平衡,而不同肽链序列(如WNIP、GWNI、IRW 和LKP)抗氧化能力也存在较大差异[16-17]。此外,部分短肽(如GW)表现出较强的抗炎和抗肿瘤活性[18]。因此,蛋清蛋白来源的生物活性肽可作为药物成分,具有重要的发展前景。本研究检测氨基酸含量后发现,HEpep 氨基酸含量127.68 mg/g,其中必需氨基酸占氨基酸总量的35.92%,符合FAO/WHO 对肽类产品的要求,具有进一步研究价值。
细菌内毒素LPS 可诱导结肠组织细胞发生炎症应答和氧化还原稳态失衡,而游离的氧自由基可进一步加重炎症反应继而损伤细胞结构与功能[19]。本研究通过检测血清和结肠组织中氧化应激相关指标SOD、CAT 酶活力和MDA 含量水平,发现蛋清蛋白来源的短肽HEpep 能够有效改善血清、组织中的氧化应激损伤,促进氧化还原平衡,保护细胞和组织完整性。
炎症因子在结肠炎的发生、发展中起重要作用[20-21]。TNF-α 由活化的单核巨噬细胞产生,能够在炎症部位通过调控白细胞聚集,刺激单核细胞、血管内皮细胞等产生细胞因子,导致组织结构病理性损伤[22];而IL-6 与炎性肠病患者免疫应答关系密切,活化的巨噬细胞、淋巴细胞及上皮细胞分泌IL-6 进入血液和细胞间隙后,可激活STAT-3/NF-κB/ICAM-1 通路,诱发炎症反应[23-24]。当采用外源性因子细菌脂多糖(LPS)刺激SD 大鼠时,中性粒细胞被激活并促进溶酶体酶活性和吞噬作用,白细胞在炎症局部聚集并刺激单核-巨噬细胞释放细胞因子。在本研究中,当SD 大鼠腹腔注射LPS(10 mg/kg)时,血清和结肠组织中TNF-α、IL-6 水平显著升高,结肠组织的HE 染色和TUNEL染色结果可见明显的病理性损伤,表明LPS 诱导大鼠结肠炎模型建立成功。而给与HEpep 后血清和结肠组织中炎症因子水平显著下降,结肠组织的病理性损伤减轻,其中高剂量HEpep 改善效果更加明显,表明HEpep 可有效缓解LPS 所致结肠炎症反应。
综上所述,蛋清蛋白短肽(HEpep)能够通过抑制炎症反应和氧化应激损伤进而改善由细菌内毒素LPS 诱导的大鼠结肠炎。
