长链非编码RNA LINC01006在前列腺癌组织中的表达水平及临床意义
2021-09-09杨晓峰王倩倩田涛
杨晓峰,王倩倩,田涛
前列腺癌(PCa)是全世界公认的老年男性恶性肿瘤,发病率和死亡率较高,被列为第三大常见的致命癌症之一[1-3]。PCa早期缺乏特异性生物标志物导致诊断较难。因此,深入研究PCa中潜在的分子机制对PCa诊治具有重要意义。长链非编码RNA(Long non-coding RNAs,lncRNAs)是一组长度大于200 nt的转录物,没有蛋白质编码动能[4]。既往研究显示,lncRNAs为多种癌细胞凋亡机制中的重要调节因子[5-7]。LINC01006在PCa发病中的作用机制仍不清楚。lncRNAs作为一种竞争性内源性RNA(ceRNA)参与肿瘤的发生发展,也可作为miRNAs调节mRNAs的海绵吸附作用[8-10]。本文研究LINC01006在PCa中的ceRNA调控机制,并对其作用机理进行探讨。
1 材料与方法
1.1 资料 选取2016年1月—2020年6月本院确诊并进行前列腺癌根治术治疗的患者34例为研究对象,年龄44~78( 64.75±8.04) 岁。纳 入 标 准:(1)经病理确诊为前列腺癌;(2)临床及随访资料完整;(3)行手术治疗;(4)本人及家属知情并签署知情同意书。排除标准:(1)非新发前列腺癌患者;(2)合并糖尿病、高血压、冠心病等疾病的患者;(3)其他恶性肿瘤患者。本研究经医院伦理委员会批准通过。
1.2 材料 人正常细胞系(RWPE-1)和DU145、PC3、LNCAP及VCaP 4种人PCa细胞系均来自美国典型菌种保藏中心ATCC (Manassas, VA)。将所有细胞置于含10% FBS的DMEM培养基中,在37 ℃、5% CO2环境中培养。LINC01006的shRNA及相应的对照shRNA质粒均由Genechem公司(中国 上海)合成。miR-34a-5p模拟物/抑制剂和NC模拟物/抑制剂购自RiboBio公司(中国 上海)。TRIzol试剂(Invitrogen, USA)分离总RNA,使用反转录试剂盒PrimeScript RT master mix (Takara, Tokyo, Japan)合成cDNA。BeyoClick EdU-594细胞增殖检测试剂盒来自Beyotime公司(中国 上海)。TUNEL试剂使用Merck KGaA(Darmstadt, Germany)。基质凝胶使用BD Biosciences(San Diego, CA, USA)。BALB/c裸鼠(5~6周龄)来自SLRC实验动物(中国 上海)。
1.3 实验方法
1.3.1 质粒的构建和转染 将pcDNA3.1载体(Invitrogen)用LINC01006亚克隆过表达,空pcDNA3.1载体作为阴性对照。所有细胞转染均使用Lipofectamine 3000 (Invitrogen)。
1.3.2 总RNA提取及实时定量聚合酶链反应(RT-qPCR) 使用TRIzol试剂分离总RNA,使用反转录试剂盒合成cDNA。应用SYBR Green PCR试剂盒进行qPCR测定分子表达水平。分别以U6、GAPDH作为内参对照,再用2-△△Ct法计算结果。
1.3.3 集落形成实验 细胞以每孔500个细胞的密度接种于6孔板中孵育2周。4% PFA固定30 min后,用0.5%结晶紫溶液染色5 min,最后手工记录可见集落。
1.3.4 EdU实验 使用细胞增殖检测试剂盒进行EdU增殖测定。将转染的细胞以1×104细胞/孔在96孔板中培养。 使用EdU和DAPI溶液进行双重染色后,在激光共聚焦显微镜下观察细胞。
1.3.5 TUNEL检测 将转染的DU145和LNCAP细胞用4%的PFA处理,然后加入TUNEL试剂,DAPI染料染色后,使用光学显微镜对标记的样品进行分析。
1.3.6 流式细胞仪 双染细胞凋亡检测试剂盒检测细胞凋亡。用结合缓冲液双重染色15 min后,用流式细胞仪(FACScan,BD Biosciences)测定细胞样品。
1.3.7 Transwell检测 取2×104细胞加入transwell板的上腔室。然后在底腔中加入100%完全的培养基。将基质凝胶加入细胞中进行侵袭实验。24 h后,细胞用结晶紫染色计数。
1.3.8 动物实验 取BALB/c裸鼠(5~6周龄),将sh-NC和sh-LINC01006#1转染的DU145细胞悬浮在PBS中,然后注射到小鼠体内。每5天测量肿瘤体积。1个月后,对小鼠实施安乐死。将小鼠体内肿瘤切除并称重。将转染sh-NC和sh-LINC01006#1的DU145细胞注射到裸鼠尾静脉进行肿瘤转移实验。50 d后对小鼠实施安乐死。取肺后用湿甲醛溶液固定,进行苏木精-伊红染色。最后在显微镜下观察肺转移灶。所有动物实验均经山东省济宁医学院附属枣庄市立医院伦理委员会批准。

2 结果
2.1 LINC01006对PCa细胞增殖、凋亡和侵袭功能的影响 GEPIA数据库分析LINC01006表达水平(http://gepia.cancer-pku.cn/),LINC01006在PCa组织和非癌组织中表达差异具有统计学意义(P<0.05);以正常人前列腺上皮细胞系(RWPE-1)为对照,LINC01006在PCa细胞系(DU145、PC3、LNCAP和VCaP)中明显表达上调(图1)。敲除了PCa细胞中的LINC01006,通过细胞克隆增殖和EdU分析显示,LINC01006沉默后细胞增殖显著下降,组间比较差异有统计学意义(P<0.05)(图2)。TUNEL实验分析显示,LINC01006下调促进细胞凋亡(图3)。transwell分析结果显示,LINC01006缺陷后DU145和LNCAP细胞的迁移和侵袭能力显著降低(图4)。即LINC01006对PCa细胞增殖、迁移和侵袭有明显的促进作用。
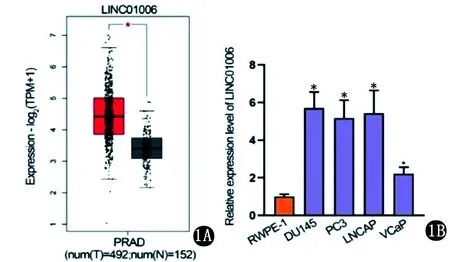
1A GEPIA数据库分析LINC01006的表达水平 1B PCa细胞系中LINC01006表达水平(与RWPE-1比较,*P<0.05)图1 GEPIA数据及PCa细胞系中LINC01006表达
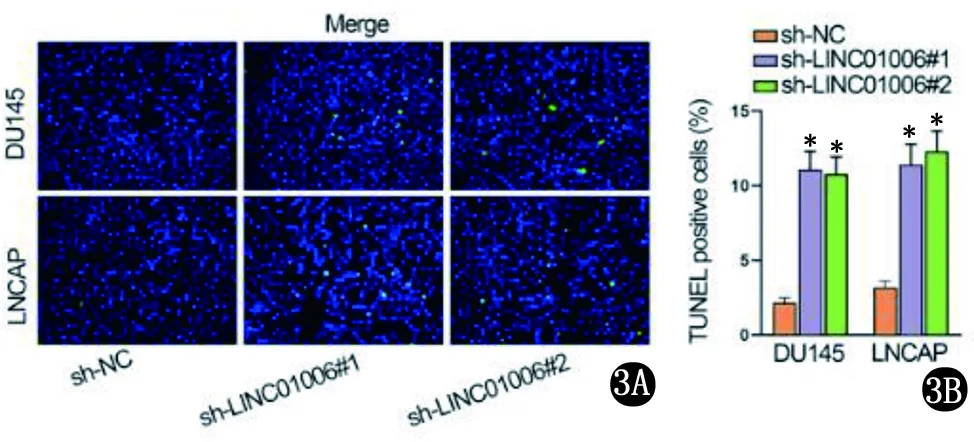
3A TUNEL实验显示细胞凋亡视野 3B 转染细胞凋亡率(sh-NC与sh-LINC01006#1,sh-NC与sh-LINC01006#2比较,*P<0.05)图3 TUNEL实验分析结果
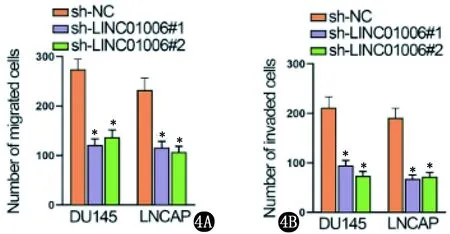
4A 下调LINC01006,ytranswell分析迁移能力结果 4B 下调LINC01006,ytranswell分析侵袭能力结果(sh-NC与sh-LINC01006#1,sh-NC与sh-LINC01006#2比较,*P<0.05)图4 transwell分析迁移和侵袭结果
2.2 LINC01006的海绵吸附作用 以starBase(http://starbase.sysu.edu.cn/)在CLIP数据>=1,Degradome数据>=0,泛癌>=6的条件下,筛选出3个miRNA(miR-148b-3p、miR-34a-5p和miR-6783-3p),因miR-34a-5p是唯一显示下调表达的miRNA,假设LIN01006是miR-34a-5p的海绵,图5显示了预测结合位点。将miR-34a-5p模拟物转染到PCa细胞中,显示miR-34a-5p过度表达抑制了细胞增殖(图6);流式细胞仪检测发现细胞凋亡率提高(图7);transwell分析显示miR-34a-5p模拟物降低细胞的迁移和侵袭能力(图8)。即miR-34a-5p为LINC01006海绵吸附作用位点,能减缓PCa的进展。

图5 star Base预测LIN01006与miR-34a-5p结合位点
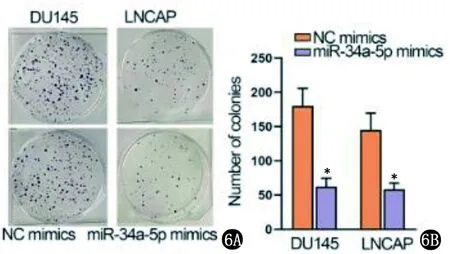
6A 模拟物转染细胞,细胞克隆增殖视野 6B 细胞增殖结果比较(2组比较,*P<0.05)图6 细胞克隆增殖结果
2.3 LINC01006基因对实验动物体内肿瘤生长和转移的影响 将转染sh-NC和sh-linc1006#1的DU145细胞注入6周龄裸鼠体内。结果显示,与对照组相比,sh-LINC01006#1敲除组的肿瘤体积变小(图9)。LINC01006被敲除后,肿瘤生长速度变慢(图10)。建立肺转移模型结果显示,sh-LINC01006#1组的转移结节数量明显减少(图11),LINC01006沉默后体内转移受到抑制。即通过敲除LINC01006,可以抑制动物体内PCa肿瘤的生长和转移。
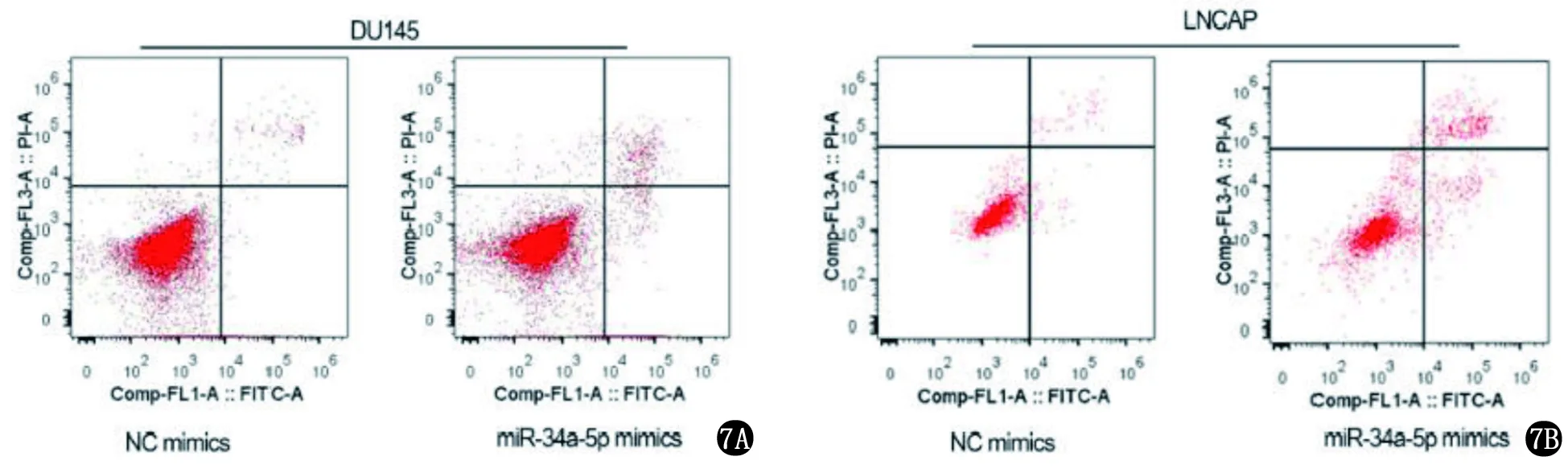
7A miR-36a-5p上调后DU145细胞株凋亡率 7B miR-36a-5p上调后LNCAP细胞株凋亡率图7 流式细胞检测
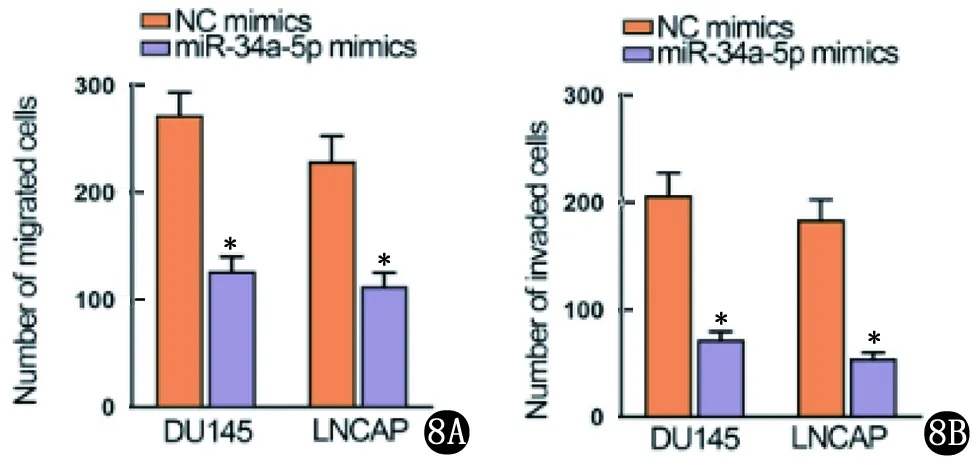
8A miR-36a-5p上调后,transwell检测细胞迁移能力 8B miR-36a-5p上调后,transwell分析侵袭能力(NC与miR-34a-5组比较,*P<0.05)图8 transwell分析迁移和侵袭结果
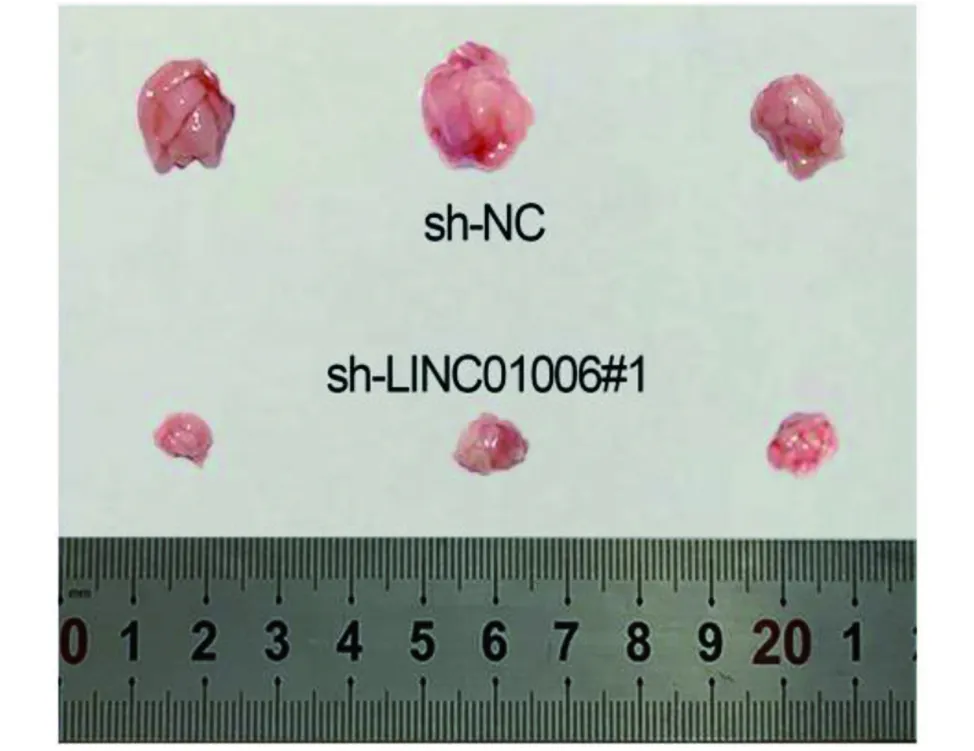
图9 2组实验动物肿瘤比较
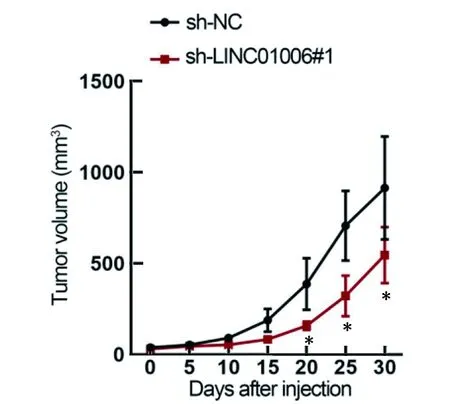
图10 2组实验动物肿瘤生长测量图。(组间比较,*P<0.05)
2.4 LINC01006表达与术后病理和患者预后的关联性 前列腺癌患者癌组织中LINC01006表达量水平为5.82±0.14,以≥5.50为LINC01006高表达,<5.50为LINC01006低表达,分析前列腺癌患者临床参数与LINC01006表达的关联性。如表1所示,前列腺癌组织中LINC01006的表达水平与前列腺癌患者的年龄和肿瘤大小无关(P>0.05) ;与前列腺癌患者的术前PSA值、病理Gleason 评分及远处或淋巴结转移有关(P<0.05)。
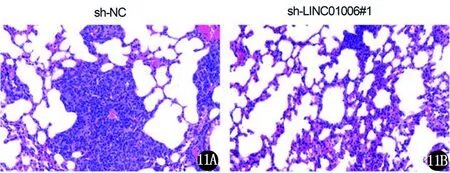
11A 转染sh-NC组肺细胞转移瘤(×200) 11B 转染sh-linc1006#1组肺细胞转移瘤(×200)(每视野计数比较,P<0.05)图11 HE染色,肺转移模型比较
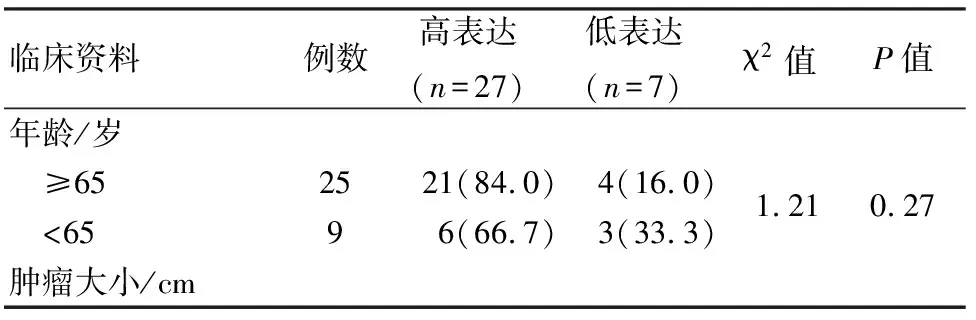
表1 LINC01006表达与临床资料的关联性
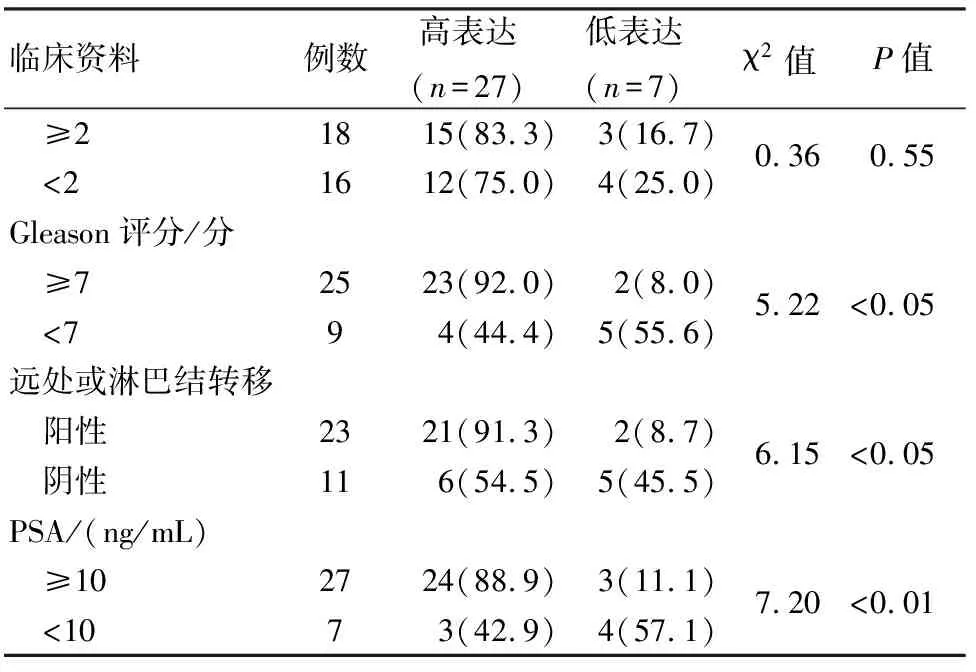
续表1
3 讨论
前列腺癌是老年男性常见的恶性肿瘤,近几年发病更有年轻化趋势,危害男性健康。随着疾病进展会引发排尿障碍、疼痛、肾功能衰竭及尿潴留等症状,甚至转移至骨骼、淋巴结及全身多器官。探索新的特异性分子生物标志物及与前列腺癌增殖、扩散及转移机制对前列腺癌诊疗有重要意义。lncRNAs异常表达影响癌症的发病进展,主要通过影响细胞的增殖、迁移和侵袭能力[11-12]。如,PCGEM1/miR-433-3p/FGF2信号通路异常导致肾癌细胞的恶性表型[13],PVT1通过隔离miR-526b调节EZH2在非小细胞肺癌中作为肿瘤启动子发挥作用[14],OIP5-AS1上调促进胃癌发病进展[15]。LINC01006在前列腺癌中的作用及机制的研究少有报道。本研究发现LINC01006沉默后细胞增殖显著下降,细胞凋亡增加,动物实验进一步证实敲除LINC01006基因抑制了前列腺癌细胞在体内扩散及转移。而前列腺癌细胞中LINC01006表达上调促进前列腺癌的发病进展,以上结果表明LINC01006在前列腺癌发病中的作用。
研究表明,ceRNA网络通路是lncRNAs潜在的致病机制,如lncRNA XIST通过介导的ceRNA调控信号通路促进肿瘤进展[16]。张荣魁等[17]研究发现BCAR4通过作为miR-370-3p海绵激活Wnt信号通路加重膀胱癌进展[18]。LINC01006作为miR-2682-5p的ceRNA增强HOXB8活性,从而促进胰腺癌的进展[18]。在本研究中,通过基因数据库预测LINC01006在前列腺癌中的靶作用点,发现miR-34a-5p作为LINC01006海绵化作用对象,抑制前列腺癌的发生和发展,这与既往研究报道的miR-34a-5p阻止细胞迁移和侵袭结论相符[19]。
进一步研究发现,LINC01006在前列腺癌术后病理组织中呈高表达,表达水平与前列腺癌患者的年龄和肿瘤大小无关,与前列腺癌患者的术前PSA值、病理Gleason 评分和病灶转移情况有关。其表达水平与预后相关,呈现表达越高预后越差,可作为预后评判的分子标志物。
综上所述,LINC01006在前列腺癌细胞中表达上调,通过调控miR-34a-5p表达,抑制前列腺癌的恶性程度进度,降低复发及转移率,从而为前列腺癌的早期诊断、治疗及预后评估提供理论依据。
