健脾化浊饮对代谢相关脂肪性肝病大鼠肠肝轴体系影响的研究
2021-09-09杨洪超徐龙进孙建光
杨洪超,徐龙进,孙建光
(1.青岛市中医医院(青岛市海慈医院),山东 青岛 266000;2. 山东省疾病预防控制中心,山东 济南 250000;3. 山东省中医院,山东 济南 250000)
代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)在2020年初发布的MAFLD新定义的国际专家共识声明中正式提出(该声明由22个国家的30位专家共同参与),自此MAFLD取代了沿用40年的非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)一名,新的病名强调了该病是代谢功能障碍性疾病,代谢功能紊乱是其发生的前提和基础,亦是核心发病机制[1-3]。肠道是人体重要的消化吸收代谢器官之一,近10年随着对“肠肝轴”病理生理认识的不断加深,肠道微生态环境紊乱、肠源性内毒素血症、胆汁酸代谢紊乱等机制一直备受瞩目,极有可能成为治疗MAFLD的重要突破点。目前中医学对MAFLD的病因病机、辨证论治已经有较为深入的认识,认为该病属于气血津液病变范畴,脏腑功能失调、气血津液代谢障碍,痰湿浊瘀内生蕴于肝而发[4],这与目前现代医学对该病的认识不谋而合。健脾化浊饮是在中医气血津液代谢理论指导下,结合临床实践,以健脾化浊、祛湿化痰为主要治法组方而成,前期临床研究证实健脾化浊饮可明显改善MAFLD患者胰岛素抵抗[5]。本实验旨在围绕肠肝轴体系探讨健脾化浊饮作用机制,希望为MAFLD的治疗及中药复方作用机制研究提供一定的参考。
1 实验材料与方法
1.1动物与饲料 SPF级6周龄雄性SD大鼠44只,体重(200±20)g,购于济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)20140007。普通饲料:大小鼠维持饲料,购于北京华阜康生物科技股份有限公司;高脂饲料,由北京华阜康生物科技股份有限公司制作,4 ℃冷藏。高脂饲料配方:维持饲料52.9 %,蔗糖20%,猪油15%,胆固醇1.5%,胆酸钠0.5%,酪蛋白9.1%,磷酸氢钙0.6%,石粉0.4%。所有饲料均进行钴-60辐射消毒。
1.2药物及试剂 健脾化浊饮组方:麸炒苍术(18050031)15 g、麸炒白术(18050137)15 g、炒薏苡仁(18030739)30 g、云茯苓(18062077)15 g、陈皮(18040836)9 g、泽泻(18051200)12 g、决明子(18041796)15 g、荷叶(18060269)15 g、炒冬瓜仁(18041578)30 g、莪术(18050366)9 g、生山楂(18041326)15 g、败酱草(18054624)20 g、茵陈(18041042)30 g、白豆蔻(18051384)9 g,以上中药均为中药配方颗粒,购于山东中医药大学附属医院门诊,由江阴天江药业有限公司生产。每剂药浓缩至50 mL,约含生药2 g/mL。粪便基因组DNA提取试剂盒(货号:DP328),天根生化科技(北京)有限公司;Occludin抗体(货号:GB11049),武汉赛维尔生物科技有限公司;大鼠D-乳酸(D-Lac)ELISA试剂盒(批号:20190228),南京建成生物工程研究所。TLR4抗体(货号:BA1717),武汉博士德生物工程有限公司;NF-κB抗体(货号:GB11142),武汉赛维尔生物科技有限公司;大鼠脂多糖/内毒素(LPS)ELISA试剂盒(批号:Y19017504),武汉华美生物工程有限公司。
1.3仪器 DxC800 型全自动生化仪 (美国Beckman Coulter 公司);离心机(型号:H1650R),湖南湘仪实验室仪器开发有限公司;凝胶成像系统(型号:JY04S-3C),北京君意东方电泳设备有限公司;荧光定量PCR仪(型号:PIC-200),BIO-RAD;冷冻离心机(型号:neofuge13R),力康生物医疗科技控股有限公司;转印电泳仪(型号:DYCZ-40D),北京六一仪器厂。
1.4实验方法 44只大鼠适应性喂养5 d,自由进食饮水。5 d后随机取8只大鼠作为正常组,给予普通饲料喂养;其余36只大鼠采用高脂饮食诱导的方法建立MAFLD模型,均自由进食饮水。饲养12周后,随机选取1只正常大鼠和1只造模大鼠行肝组织HE染色判断模型完成情况。判断造模成功后,将35只MAFLD模型大鼠随机分为模型组8只、健脾化浊饮低剂量组8只、健脾化浊饮中剂量组9只、健脾化浊饮高剂量组10只。正常组大鼠继续普通饲料喂养,给予生理盐水灌胃;各造模组继续给予高脂饲料喂养,其中模型组给予生理盐水灌胃,健脾化浊饮低、中、高剂量组分别给予含生药10,15,20 g/kg的健脾化浊饮灌胃。各组均每天灌胃1次,共灌胃8周。
1.5标本采集 灌胃结束后,以10%水合氯醛溶液(3 mL/kg)腹腔注射麻醉大鼠,心脏直接穿刺取血,血样静置30 min后离心,保存于-80 ℃冰箱备用。打开腹腔,摘取大鼠肝脏,观察外观并称重,一部分置于组织固定液中固定,剩余肝脏置于-80 ℃冰箱保存备用;取大鼠回肠2 cm置于组织固定液中固定,取大鼠结肠粪便3~4粒置于-80 ℃冰箱保存。上述过程严格按照无菌操作进行,避免标本污染。
1.6观察指标及方法
1.6.1大鼠一般情况 实验过程中观察各组大鼠精神状态、活动、大便、皮毛等情况。
1.6.2血清指标测定 取血样,采用全自动生化分析仪测定总胆固醇(TC)、三酰甘油(TG)、丙氨酸氨基转移酶(ALT)、天门冬氨酸基转移酶(AST)、空腹血糖(FPG)水平;采用ELISA法测定LPS、D-Lac水平,按照试剂盒说明操作。
1.6.3肝组织病理观察
1.6.3.1苏木素-伊红(HE)染色 取组织固定液固定后的大鼠肝组织,脱水后石蜡包埋,切片机石蜡切片,依次将切片脱蜡至水,苏木素染色、伊红染色,脱水,中性树胶封片。显微镜下观察,细胞核呈蓝色,细胞质呈红色,采集图像分析。
1.6.3.2油红O染色 将固定后的肝组织恒冷箱切片附贴于载片上,60%异丙醇稍洗切片,在密闭容器内油红O液染5~15 min,60%异丙醇洗去多余染液,自来水洗,苏木素染细胞核2 min,水洗至细胞核蓝化,甘油明胶封固。镜下观察,脂类物质显示红色,细胞核显示蓝色。将切片置于40倍物镜下观察并采集图像分析。
1.6.4回肠组织病理观察
1.6.4.1HE染色 取4%多聚甲醛固定液固定后的大鼠回肠组织,脱水后石蜡包埋,切片机石蜡切片,HE染色,脱水后中性树胶封片。显微镜下观察,细胞核呈蓝色,细胞质呈红色,采集图像分析。
1.6.4.2肠道紧密连接蛋白Occludin免疫组化 石蜡切片脱蜡至水,抗原修复,阻断内源性过氧化物酶,切片放入3%双氧水溶液,血清封闭,加一抗、二抗,DAB显色,复染细胞核,脱水封片。苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。运用Image-pro plus 6.0软件计算平均光密度值(AO值)以进行定量分析。
1.6.5肝组织中TLR4、NF-κB蛋白表达Western blot检测 取大鼠肝组织100 mg,液氮研磨后加入蛋白裂解液1 mL及相关抑制剂,4 ℃下12 000 r/min离心10 min,取上清,即为总蛋白溶液。采用BCA法测定蛋白浓度;SDS-PAGE电泳后进行湿转(300 mA恒流转膜30 min,或者200 mA转膜1 h),5%脱脂牛奶封闭1 h,分别稀释TLR4抗体(1∶300)、NF-κB抗体(1∶600),4 ℃孵育过夜,室温下TBST洗膜,加入二抗(辣根过氧化物酶标记的抗兔或抗鼠IgG,1∶3 000) ,摇床孵育1 h,洗膜后ECL试剂盒发光显影,Alpha Ease FC软件定量分析条带灰度值,结果采用Graph Prism7软件绘图。
1.6.6粪便中大肠杆菌、乳酸杆菌相对含量RT-PCR检测 取180~220 mg粪便样本进行粪便基因组提取,进行荧光定量PCR反应。根据16Sr DNA V3可变区基因序列,通过网络数据库资源比较并筛选出特异性和代表性强的引物,引物由Servicebio公司合成,内参16S rRNA由济南研达生物技术有限公司设计,青岛派森诺合成。大肠杆菌引物序列:F为5’-CGAGAAACTGGCGATCCTTA-3’,R为5’-CTTCATCAAGCGGTTTCACA-3’;乳酸杆菌引物序列:F为5’-AGCAGTAGGGAATCTTCCA-3’,R为5’-CACCGCTACACATGGAG-3’;16S rRNA:338F为5’-ACTCCTACGGGAGGCAGCA-3’,806R为5’-GGACTACHVGGGTWTCTAAT-3’。建立RT- PCR反应体系:溶解2×SuperReal PreMix Plus、模板、引物和RNase-Free ddH2O,将所有试剂在室温下平衡并彻底混匀,采用三步法PCR反应程序进行 PCR反应。盖上反应管,轻柔混匀,确保所有组分均在管底。将反应体系置于荧光定量PCR仪中,开始反应。空白组设为“1”,计算各组相对含量,结果采用Graph Prism7软件绘图。
2 结 果
2.1各组大鼠一般情况 造模4周时,各造模大鼠体重较正常大鼠增长迅速,而且造模大鼠开始出现行动迟缓、反应迟钝、嗜睡、大便稀溏、皮毛枯黄表现,随造模时间延长逐渐加重;实验过程中正常组大鼠体重均匀增长,行动敏捷,反应迅速,大便正常,皮毛润泽;灌胃结束时健脾化浊饮各组大鼠精神状态、活动、大便、皮毛等均有不同程度好转。
2.2各组大鼠血清学指标比较 模型组大鼠血清ALT、AST、TC、TG、FPG、LPS、D-Lac水平均明显高于正常组(P均<0.05);健脾化浊饮中、高剂量组血清ALT、AST、TC、TG、FPG、LPS、D-Lac水平及健脾化浊饮低剂量组ALT、AST水平均明显低于模型组(P均<0.05)。见表1。
表1 正常组和代谢相关脂肪性肝病各组大鼠血清学指标比较
2.3各组大鼠肝脏病理学表现
2.3.1HE染色表现 正常组大鼠肝小叶清晰完整,结构正常,肝索排列整齐,以中央静脉为中心向四周呈放射状排列,肝细胞胞浆致密均匀,细胞核位于中央,肝细胞无变性、坏死及炎性细胞浸润;模型组大鼠肝小叶结构紊乱,肝细胞肿胀,排列紊乱,边界不清,肝细胞内充满大小不等脂肪空泡,呈局灶分布,伴见空泡融合,细胞核被挤到细胞的一边,细胞核变形、深染,并出现气球样变,肝小叶内可见不同程度的局灶性炎性灶,有汇管区炎症、坏死;健脾化浊饮各组大鼠肝细胞内脂肪空泡不同程度减少,散在炎性细胞浸润,其中健脾化浊饮高剂量组病理改变更轻。见图1。
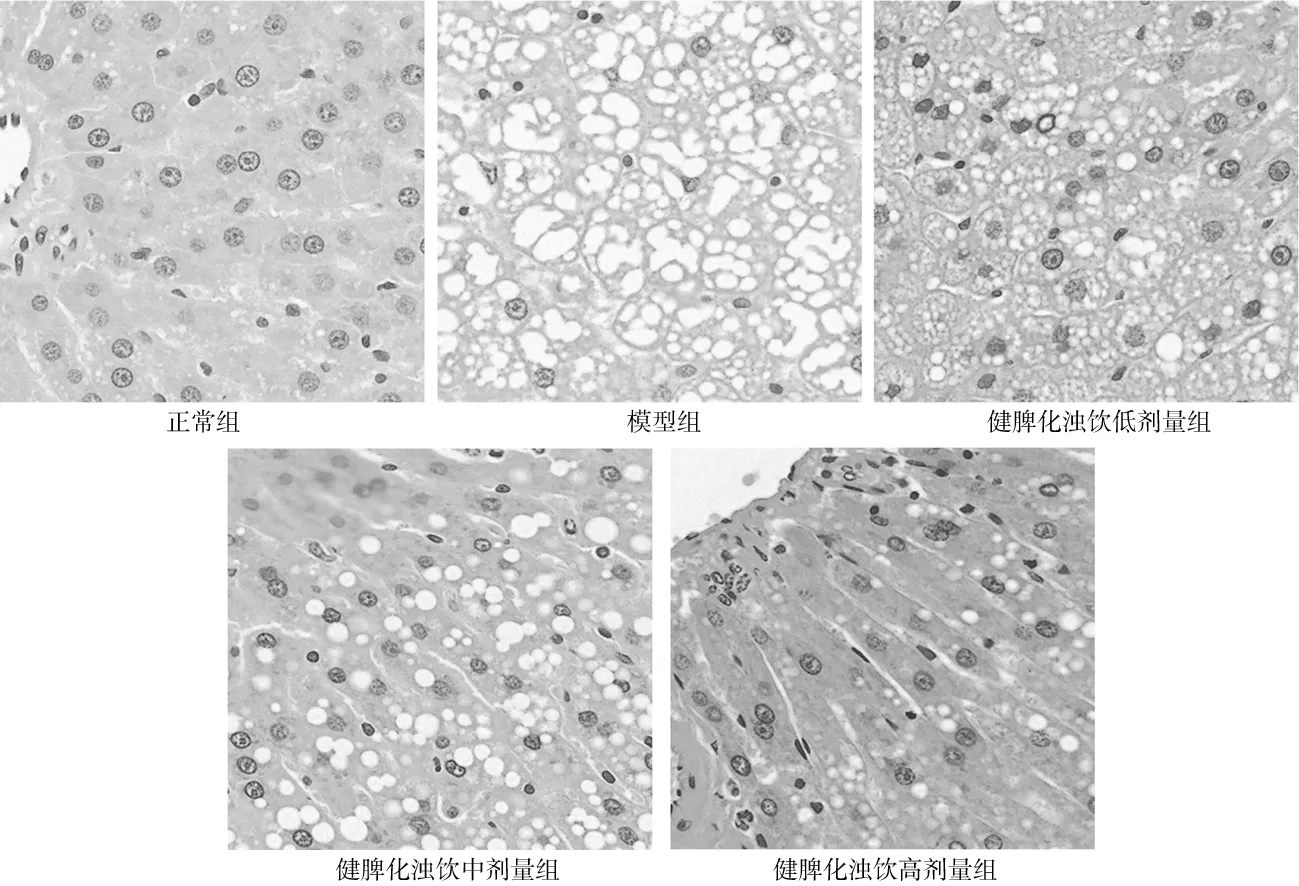
图1 正常组和代谢相关脂肪性肝病各组大鼠肝组织HE染色表现(×40)
2.3.2油红O染色表现 正常组大鼠肝细胞散在点状红色脂肪滴;模型组大鼠肝细胞出现大量红色脂滴,融合成片,核居于细胞边缘;健脾化浊饮各组大鼠肝细胞红色脂滴大小和范围均有不同程度的减少,其中健脾化浊饮高剂量组减少更明显。见图2。
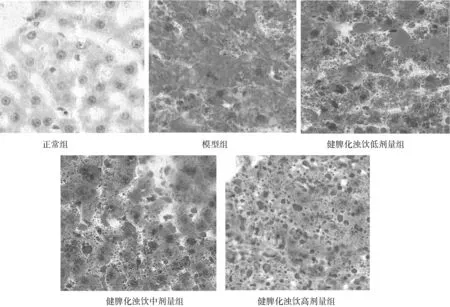
图2 正常组和代谢相关脂肪性肝病各组大鼠肝组织油红O染色表现(×40)
2.4各组大鼠回肠组织病理学表现
2.4.1HE染色表现 正常组大鼠小肠黏膜绒毛细长,排列整齐紧密,表面结构完整,无充血、水肿,上皮细胞无水肿、脱落,未见炎性细胞浸润;模型组大鼠小肠黏膜绒毛排列紊乱,出现断裂、缺失,间隙增宽,上皮细胞脱落,可见少量炎性细胞浸润;健脾化浊饮各组大鼠小肠黏膜绒毛排列较模型组整齐,缺失断裂减少,其中健脾化浊饮高剂量组更接近正常。见图3。
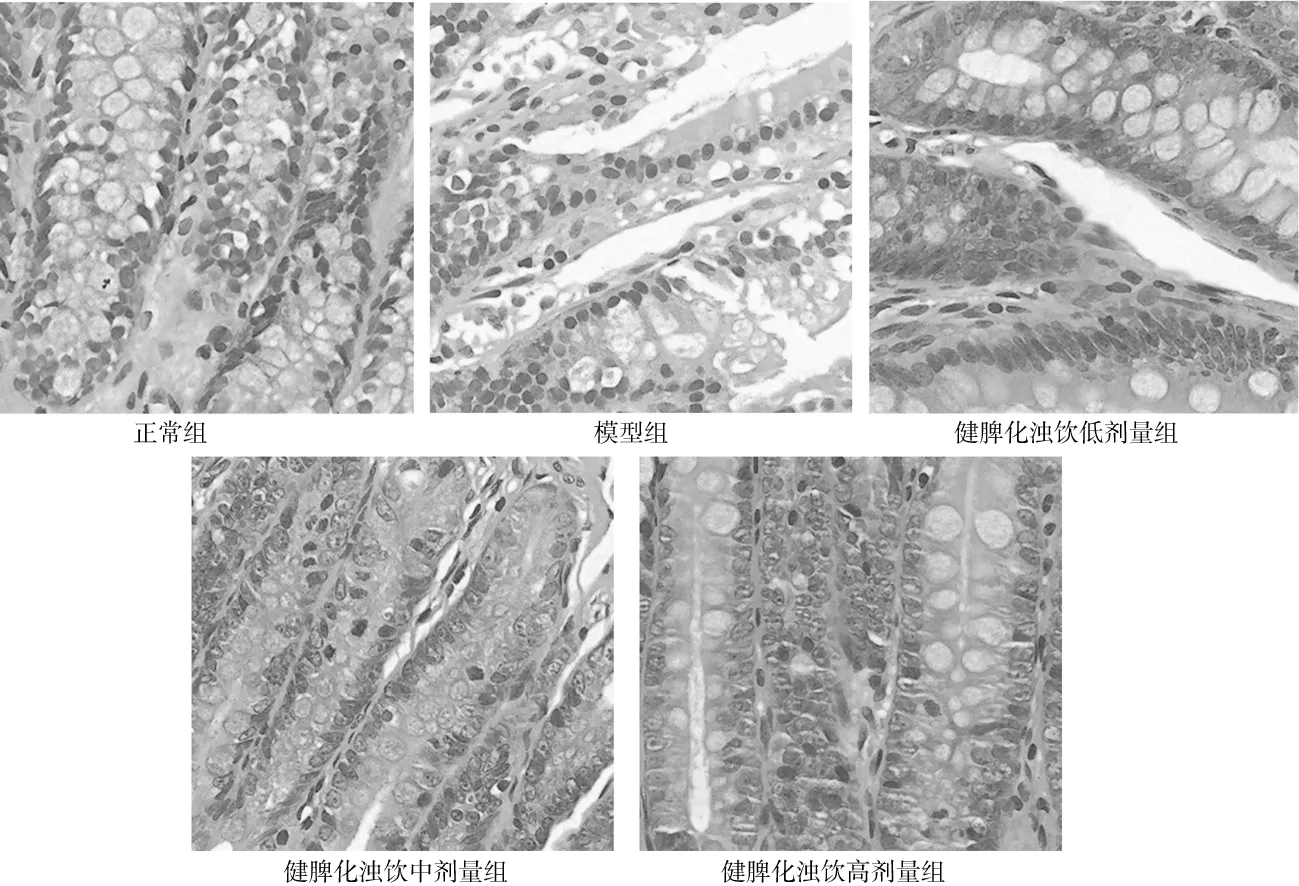
图3 正常组和代谢相关脂肪性肝病各组大鼠回肠组织HE染色(×40)
2.4.2Occludin蛋白免疫组化表现及定量 正常组大鼠小肠黏膜Occludin蛋白染色表现为棕黄色颗粒,沿小肠黏膜上皮细胞顶端呈线状连续性分布,染色均匀,定量为0.021±0.002。模型组大鼠小肠黏膜Occludin蛋白阳性染色颗粒减少明显,分布紊乱、不连续,染色分布不均匀,定量为0.006±0.001,明显低于正常组(P<0.05)。健脾化浊饮各组小肠黏膜Occludin蛋白阳性颗粒较模型组增多,分布较均匀,其中健脾化浊饮高剂量组改善更明显,低、中、高剂量组定量分别为0.006±0.001,0.016±0.003,0.018±0.002,中、高剂量组均明显高于模型组(P均<0.05)。见图4。
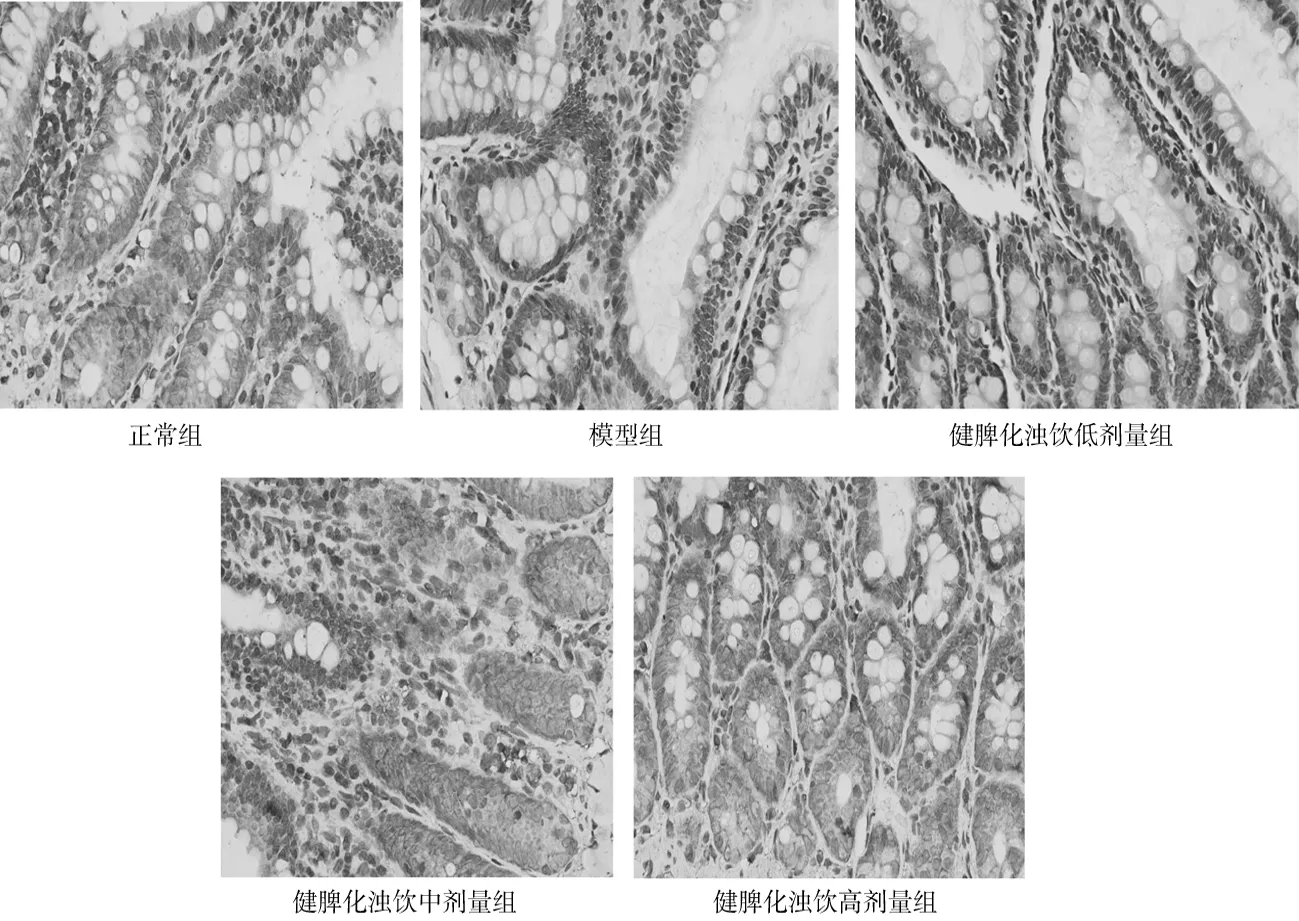
图4 正常组和代谢相关脂肪性肝病各组大鼠回肠组织Occludin蛋白免疫组化染色表现(×40)
2.5各组大鼠肝组织中TLR4、NF-κB蛋白表达情况 模型组大鼠肝组织中TLR4、NF-κB蛋白表达量均明显高于正常组(P均<0.05);健脾化浊饮中、高剂量组大鼠肝组织中TLR4、NF-κB蛋白表达量均明显低于模型组(P均<0.05),健脾化浊饮高剂量组均明显低于健脾化浊饮中剂量组(P均<0.05),健脾化浊饮低剂量组与模型组比较差异均无统计学意义(P均>0.05)。见图5。
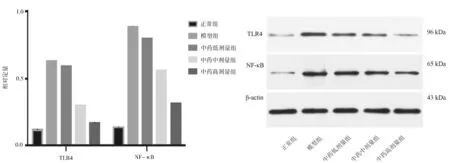
图5 正常组和代谢相关脂肪性肝病各组大鼠肝组织中TLR4、NF-κB蛋白表达情况
2.6各组大鼠粪便中大肠杆菌和乳酸杆菌相对含量比较 模型组大鼠粪便中大肠杆菌相对含量明显高于正常组(P<0.05),乳酸杆菌相对含量明显低于正常组(P<0.05);健脾化浊饮中、高剂量组大鼠粪便中大肠杆菌相对含量明显低于模型组(P均<0.05),乳酸杆菌相对含量明显高于模型组(P均<0.05),健脾化浊饮中剂量组与健脾化浊饮高剂量组比较、健脾化浊饮低剂量组与模型组比较差异均无统计学意义(P均>0.05)。见图6。
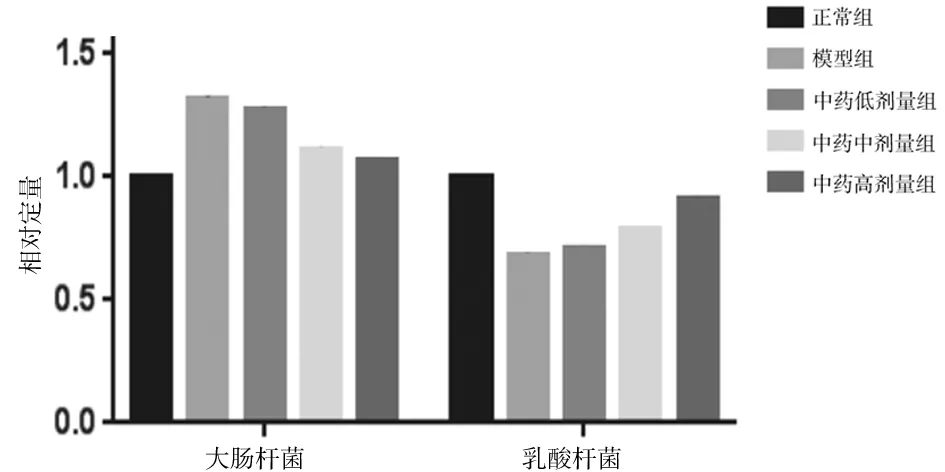
图6 正常组和代谢相关脂肪性肝病各组大鼠粪便中大肠杆菌和乳酸杆菌相对定量比
3 讨 论
1998年,Marshall正式提出“肠肝轴”概念,指出肠道与肝脏两大器官在解剖结构、生理病理和免疫防御等方面存在密切联系[6]。肠道与肝脏共同起源于内胚层的前肠,肠道通过门脉系统与肝脏相通,门静脉收集的肠道静脉血占肝脏血供的70%。肠道屏障参与构成了人体同外源性物质接触的第一道防线,肝脏提供第二道防线。肠道静脉血中富含各种细菌产物和毒素,经门静脉系统入肝后,肝脏固有免疫系统激活发挥防御和清除作用。当肠道屏障受损时,肠黏膜通透性增加,大量细菌和内毒素等通过门脉系统入肝,激活肝脏Kupffer细胞和肝细胞,释放一系列炎症因子,引发肝脏甚至全身性炎症反应,同时进一步加重肠黏膜损伤。肠道与肝脏之间存在的这种生理病理上的关系即表述为“肠肝轴”。
最新国际专家共识指出,对于肝活检组织学显示肝细胞脂肪变或者影像学弥漫性脂肪肝或者脂肪肝指数等判别模型提示脂肪肝的患者,只要合并超重/肥胖、2型糖尿病、代谢功能障碍(腹型肥胖、高血压、血TC水平升高、高密度脂蛋白水平下降、血糖升高但无糖尿病、胰岛素抵抗指数升高、超敏C反应蛋白升高等指标中2项及以上)中任一条件即可诊断为 MAFLD。这一诊断标准肯定了代谢紊乱是MAFLD的重要发病基础,而既往研究已证实肠肝轴是发生肥胖和MAFLD发病的关键机制,肠道细菌也是胰岛素抵抗、2型糖尿病和心血管疾病发生的关键性因子[7],肠道细菌在MAFLD发生发展中是一个驱动因素,肠道细菌引起MAFLD 是一个多因素复杂作用的结果,包括小肠细菌过度生长[8]、代谢内毒素血症、低度炎症、能量调节平衡失调、内源性大麻素样系统调节[9]、内源性乙醇产生增加[10]、胆碱代谢调节、胆汁酸平衡的调节[11]、肠道细菌通过刺激肝细胞Toll样受体( TLR) -9-依存性前纤维化途径导致肝纤维化[12]等。
肠道细菌可引起肠道炎症和肠黏膜屏障功能障碍。动物实验发现,进食高脂饲料的小鼠伴有明显肠道炎症,高脂饮食和肠道细菌之间相互作用促进炎症发生[13]。机械屏障在肠黏膜屏障中占据最重要的地位,完整的肠黏膜上皮细胞以及上皮细胞间的紧密连接是构成机械屏障的结构基础。Occludin蛋白是紧密连接蛋白最为重要的结构蛋白之一,亦是发现最早的参与肠道通透性调节的紧密连接蛋白[14]。肠黏膜机械屏障受损、菌群失调可导致肠黏膜通透性增高,使得肠道革兰阴性菌释放的内毒素大量入血,形成肠源性内毒素血症。菌群结构失衡,小肠细菌过度生长,又增加了内毒素等细菌代谢产物的产生,进一步加重肠黏膜的损伤并增加肠源性内毒素血症的发生风险。在MAFLD患者中,血清内毒素水平与D-Lac的浓度呈正相关,D-Lac可以反映肠道黏膜通透性的变化[15]。由于肠道屏障功能障碍,致使血清内毒素水平显著增高引发肝损伤,其机制为LPS或内毒素驱动肠道细菌易位,通过功能障碍的肠道屏障到达门静脉和肝,在肝激活炎症细胞引起炎症反应[16]。LPS是Kupffer细胞的强效激活剂,LPS可与TLR4、CD14、LBP、分泌蛋白MD-2组成受体复合物,活化Iκ-B激酶释放NF-κB,后者进入细胞核后,与启动子或增强子结合,增强TNF-α、IL-1和IL-6等前炎症细胞因子基因的表达,从而促进TNF-α、IL-1和IL-6等炎症因子的合成和释放,放大内毒素效应,诱发肝脏炎症和损伤。大量研究已经证实TLR4/NF-κB信号通路参与MAFLD的发生发展,正常情况下,TLR4等在肝内表达较低,当处于MAFLD状态下,该通路相关蛋白如TLR4、NF-κB等出现高表达,而且其表达与肝组织的炎症反应和脂肪变性呈正相关[17-18]。
中医认为脾为后天之本,气血生化之源,脾的运化功能在气血津液的运行过程中发挥了至关重要的作用。临床中饮食不节、情志失调、劳逸失度、禀赋不足和久病体虚是导致MAFLD的主要病因,这些因素均可损伤脾胃,导致脾胃虚弱、脾失健运。脾主运化功能受损,水谷精微输布失常,则导致痰湿浊邪内生而发为MAFLD,可见脾失健运、痰湿浊邪内生是该病的主要病机。健脾化浊饮方中苍术、白术健脾益气、燥湿化痰为君药;薏苡仁、茯苓健脾渗湿共为臣药;泽泻、荷叶、决明子利水渗湿、升清降浊,冬瓜子祛湿化痰,莪术破血行气、消积化瘀,山楂消食化积兼祛瘀浊共为佐药;茵陈、败酱草清热利湿、活血解毒,白蔻、陈皮行气化湿和中,共为使药。诸药配伍,共奏健脾化浊、祛湿化痰、消积化瘀之功。现代药理研究显示,苍术具有改善胃肠功能,调节肠道菌群以及保护肝脏的功能[19]。白术具有调节肠道功能、保护肠黏膜屏障等作用[20],并且白术精提物可调节高脂大鼠血脂水平,促进脂质代谢转运[21]。茯苓可降低肠道的pH值,对菌群失调小鼠的肠道菌群具有扶植作用,可提高双歧杆菌的黏附性[22]。薏苡仁能够影响肠道菌群多样性,薏苡仁的提取物能促进益生菌(乳酸杆菌、双歧杆菌等)的生长,抑制病原菌(埃希菌、葡萄球菌及沙门菌等)的生长,改善结肠炎症状[23-24]。郭雨雅[25]实验结果显示加味泽泻汤(泽泻、白术、大黄)治疗NAFLD患者疗效确切,而且对高脂饮食诱导的大鼠NAFLD模型TLR4/NF-κB信号通路相关蛋白具有抑制作用。荷叶、山楂、决明子具有降血脂、保肝等作用。茵陈、败酱草具有保肝及抗氧化等作用。
本实验结果显示,模型组大鼠血清ALT、AST、TC、TG、FPG水平明显升高,健脾化浊饮各组大鼠上述指标明显降低,肝组织脂肪变性和炎症程度亦明显减轻,说明健脾化浊饮可明显改善MAFLD;模型组大鼠血清LPS、D-Lac水平及肝组织中TLR4、NF-κB蛋白表达量明显增高,肠黏膜Occludin蛋白表达减少,粪便中大肠杆菌增加,乳酸杆菌减少,健脾化浊饮各组大鼠上述指标均不同程度改善,而且健脾化浊饮高剂量组改善更为显著。表明健脾化浊饮具有调节肠道菌群结构,降低肠黏膜通透性,保护肠黏膜屏障的作用,进而抑制LPS/TLR4/NF-κB信号通路,阻断肠肝损伤的恶性循环,从而达到治疗MAFLD的作用。
综上所述,MAFLD是一个慢性的、多系统的、代谢障碍性的复杂疾病,目前尚无有效而安全的治疗药物,新药的研发迫在眉睫。中医药在整体观念、辨证论治的指导下,具有多途径、多靶点、个体化的治疗特点,在MAFLD治疗方面具有独特的优势。肠道作为参与人体代谢的重要器官之一,也是中医药发挥作用的重要靶点。本研究显示健脾化浊饮对肠肝轴体系具有调节作用,肠道细菌可能是其调节的关键因子,值得后期进一步研究和挖掘,希望为MAFLD的治疗做出积极的贡献。
利益冲突:所有作者均声明不存在利益冲突。
