41 ℃温浴对高效价冷凝集素样本血常规检测结果的影响
2021-09-08解鸿翔庞珍珍王珍妮谢姝惠周永列
解鸿翔,沈 燕,庞珍珍,孙 彬,王珍妮,谢姝惠,周永列
1浙江省人民医院 杭州医学院附属人民医院检验医学中心 检验中心,杭州 3100142山东第一医科大学第一附属医院 山东省千佛山医院检验科,济南 2500143台州学院医学院检验系,浙江台州 318000
自动化血细胞分析仪的出现提高了全血细胞计数的检测通量和准确性。然而,分析前和分析过程中依然有许多因素可能会影响全血细胞计数结果的可靠性,冷凝集素(cold agglutinins,CAs)就是严重干扰血细胞分析仪检测结果的原因之一。CAs是一种红细胞自身抗体,主要为IgM型,少部分是IgG和IgA[1]。这些抗体在31 ℃以下温度时易与红细胞上的I、i或SP1 3种抗原结合,造成红细胞凝集,从而干扰红细胞计数和红细胞相关参数的分析,如红细胞压积(hematocrit,HCT)、平均血红蛋白含量(mean corpuscular hemoglobin,MCH)和平均血红蛋白浓度(mean cell hemoglobin concentration,MCHC)。同时,文献报道白细胞和血小板表面也存在I/i抗原,所以CAs对白细胞和血小板计数也会造成一定的影响[2- 3]。对于含有CAs的标本,日常工作中通常将其放置于37 ℃水浴一定时间后进行检测,以消除CAs对血常规检验的干扰。37 ℃水浴法对于CAs效价较低的标本可基本纠正,但对于CAs效价高者往往纠正程度不够。有研究表明,在39 ℃~41 ℃短时高温的情况下,血红蛋白构象和红细胞形态基本能维持在正常范围内[4- 5]。在实际工作中,笔者遇到2例含有高效价CAs的患者标本,用37 ℃水浴法处理后,红细胞参数未得到完全纠正。由于CAs抗体效价及凝集强度随温度上升而降低,本研究尝试41 ℃水浴30 min处理标本并探讨其可行性。
资料和方法
病历资料病例1,患者中年女性,40岁,因“发现左侧乳腺癌1月余,为行第2次术前化疗”入院。患者1月余前因“自觉左乳肿块2周”来浙江省人民医院行穿刺活检术,病理结果提示浸润性癌伴导管内癌(高核级)。患者予以表柔比星145 mg、环磷酰胺0.95 g方案化疗,化疗后患者无明显不适;现患者为求第2次术前化疗来浙江省人民医院就诊。查体:左乳外上象限可及2.0 cm大小肿块,界清,质稍硬,活动可。入院后B超提示脂肪肝,血常规提示冷凝集素存在,其他实验室检查:4 ℃时冷凝集素效价>512,Coomb’s试验阳性(C3d型),谷氨酰转肽酶67 U/L,碱性磷酸酶124 U/L,三酰甘油5.37 mmol/L,非高密度脂蛋白胆固醇4.42 mmol/L,乳酸脱氢酶289 U/L,雌二醇<10 pg/ml。病例2,患者老年女性,74岁,因“卵巢癌复发术后20余天,要求第1次化疗”入院。患者16年前诊断为卵巢恶性肿瘤(微乳头性浆液性癌)并行手术治疗。1月余前因“卵巢癌复发可能”于浙江省人民医院行开腹探查及肿瘤切除治疗,术后病理提示:淋巴结(45/61)转移性癌(低级别浆液性癌)。现患者为行第1次化疗来浙江省人民医院。查体:缺如子宫,空虚附件。入院后PET检查提示肿瘤多发淋巴结转移,血常规提示冷凝集素存在,其他实验室检查:4 ℃时冷凝集素效价>512,CA- 125 1674.0 U/ml,CA- 199 105.1 U/ml,CA72- 4 32.0 U/ml,D-二聚体3960.0 μg/L,大便常规白细胞镜检++/高倍镜视野。
检测方法每例患者采集静脉血4 ml用EDTA-K2抗凝,分为2管。其中一管分别在室温(25 ℃)及37 ℃温育不同时间混匀后,以手动进样方式用Sysmex XN- 9000血液分析仪进行血常规分析,另一管41 ℃温育30 min后以同样方式上机检测。血细胞分析仪配套稀释液、溶血剂均为原厂试剂。同时将上述标本分别用预热玻片制作外周血涂片进行瑞氏染色,用显微镜观察红细胞分布情况。
为了评估孵育本身对结果的影响,收集门诊和住院患者的血常规标本共74例,排除冷凝集素、溶血、黄疸和乳糜血的干扰,所有标本在室温下检测完成后,置于41 ℃水浴箱水浴30、60 min后分别再次上机检测。采用MedCalc软件进行Passing-Bablok回归分析对结果的一致性进行评价。进一步以1/2 美国临床实验室改进修正法规88允许总误差和中国卫生行业标准《WS/T406- 2012 临床血液学检验常规项目分析质量要求》为标准判断偏差是否可接受,各参数相对偏差可接受的样本比例应≥80%。
结 果
标本在不同温度条件下的血常规检测结果患者1标本在室温条件下进行血细胞分析,结果显示血红蛋白(hemoglobin,HGB)与红细胞计数(red blood cell count,RBC)严重比例失调,HCT明显减低,MCH及MCHC明显增高(表1)。观察标本显示试管壁上悬浮大量微小的颗粒,血涂片显示大量红细胞聚集成团,或成缗钱状排列(图1A)。随后改用37 ℃温育60 min,结果显示RBC值得到部分纠正,但HCT、MCH、MCHC仍显著异常。37 ℃温育120 min后进行检查,RBC明显升高,HCT、MCH、MCHC亦得到明显改善,但血涂片瑞氏染色镜检仍可见少量红细胞聚集成团(图1B)。将标本41 ℃水浴30 min 后再进行检查,显示红细胞参数均得到较好的纠正,RBC计数、HCT、MCH、MCHC较室温条件有显著提升,涂片染色镜检红细胞分布均匀,无聚集现象(图1C);同时处理前后白细胞计数(white blood cell count,WBC)、HGB和血小板计数(platelet count,PLT)等无差异。与室温检测结果相比,WBC在37 ℃ 60 min、37 ℃ 120 min、41 ℃ 30 min 温育后的检测结果相对偏差分别为5.7%、8.3%、3.0%,HGB相对偏差分别为1.4%、2.1%、0.7%,PLT相对偏差分别为10.3%、8.9%、10.8%(表1)。
患者2标本在不同温度条件检测结果显示,与室温检测结果相比,WBC在37 ℃ 30 min、37 ℃ 60 min、41 ℃ 30 min温育后的检测结果相对偏差分别为23.7%、21.9%、26.3%,HGB相对偏差分别为2.1%、1.1%、2.1%,PLT相对偏差分别为3.0%、5.9%、2.3%(表1)。
41 ℃温育对无冷凝集素标本血常规检测结果的影响进一步收集74例不含冷凝集素的血常规标本进行结果一致性和可比性验证,评估41 ℃孵育本身对结果的影响。74例标本在41 ℃温育30、60 min后的检测结果分别与室温条件下的检测结果进行Passing-Bablok回归分析。结果显示WBC、RBC、HCT、HGB、MCV、MCH和MCHC各参数回归方程的截距95%CI均包括0,斜率95%CI均包括1,说明各参数41 ℃温育后的检测结果和室温检测结果之间无系统差异和比例差异;PLT无系统差异,但有一定的比例差异(表2)。根据行业标准进一步进行结果可比性验证,结果显示与室温检测结果相比,41 ℃温育30、60 min后的血常规结果各项目相对偏差可接受的样本比例均≥80%,从专业上考虑41 ℃温育和室温检测结果之间的相对偏差均在临床可接受范围内(表3)。
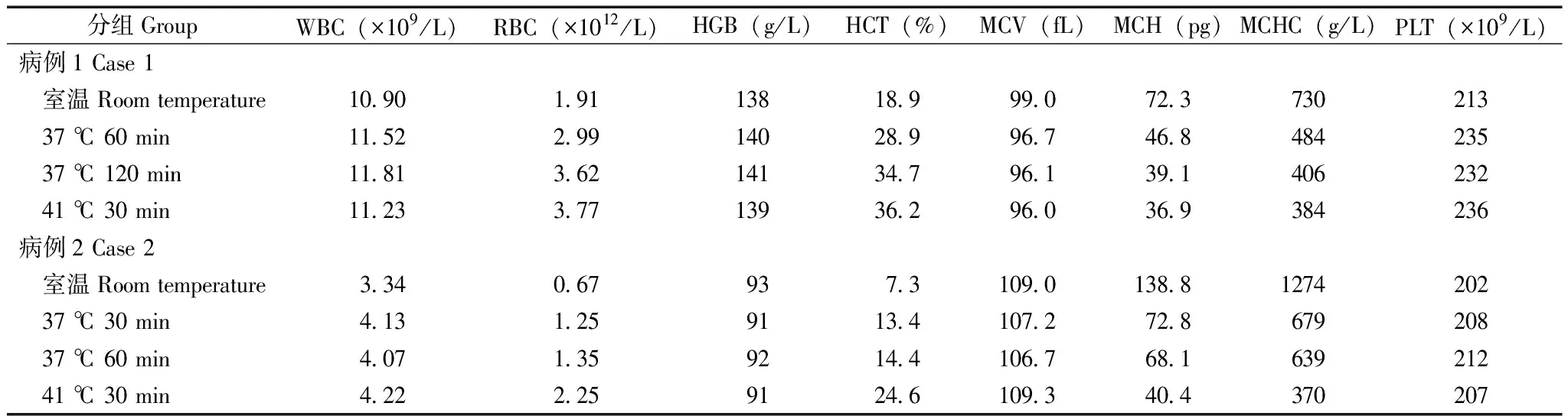
表1 不同温育条件下全血细胞计数部分项目的检测结果
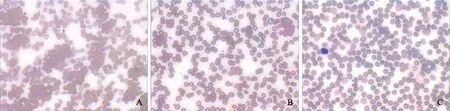
A.室温(×40);B.37 ℃温育120 min(×40;37 ℃玻片);C.41 ℃温育30 min(×40;41 ℃玻片)
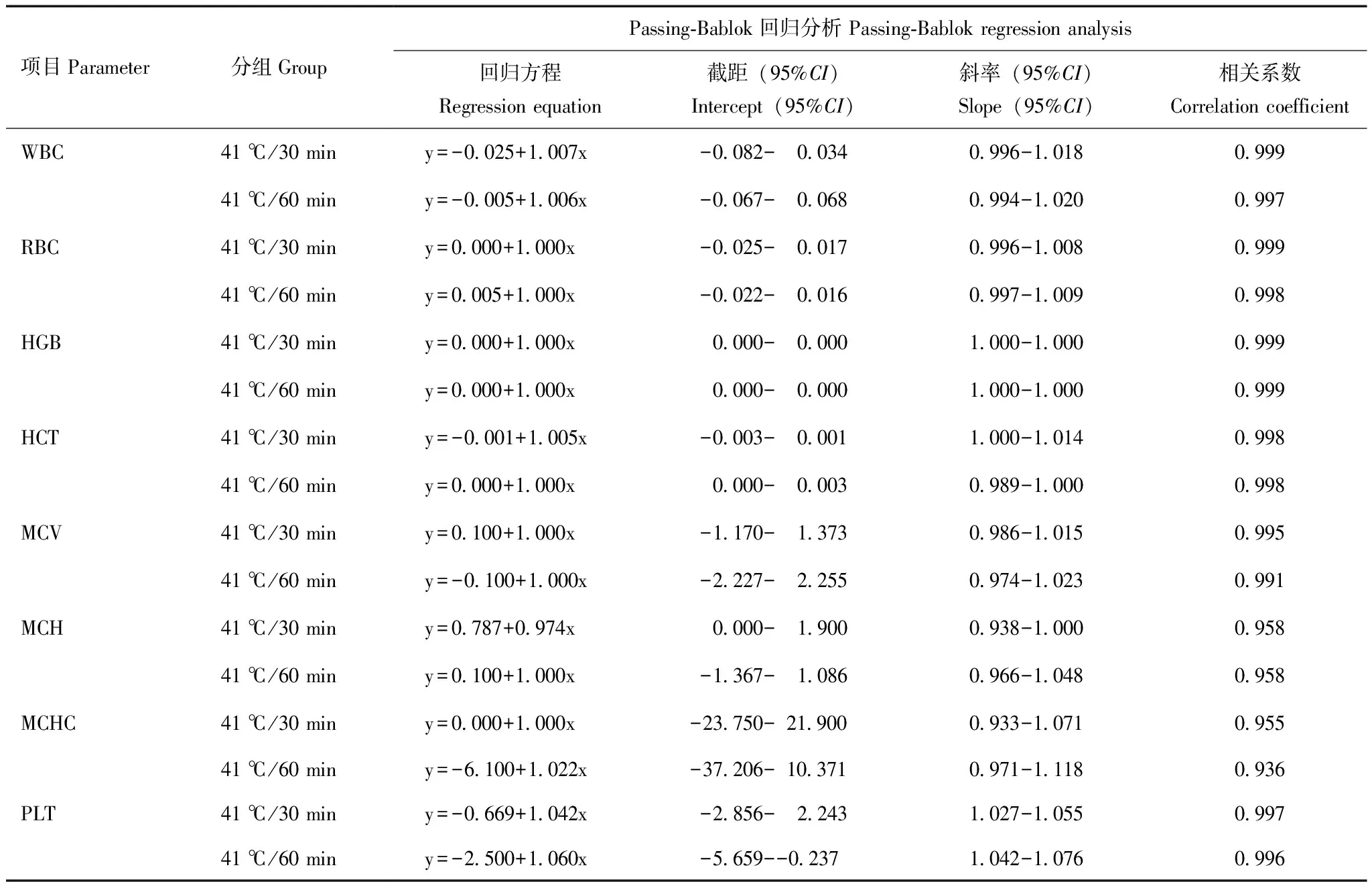
表2 74例血常规标本在41 ℃温育30、60 min后的检测结果分别与室温检测结果的Passing-Bablok回归分析Table 2 Passing-Bablok regression analysis of the test results of 74 complete blood count specimens incubated at 41 ℃ for 30 minutes or 60 minutes and at the room temperature,respectively
讨 论
CAs是常见的影响血常规检测结果准确性的干扰因素之一。Finland等[6]早在1945年就提出了在37 ℃温育作为一种消除细胞计数中CAs干扰的方法。虽然已经提出了其他方法,如血浆置换、预稀释以及标本与试剂双重温育等方法,但37 ℃温育仍是迄今为止应用最广泛的方法之一。然而在实际工作中遇到CAs效价较高的标本时,37 ℃加热法和预稀释法并不能完全消除CAs干扰,且标本稀释后可导致某些患者(如重度贫血)的RBC、HGB等检测结果的准确性下降[7]。标本与试剂双重温育法既要温育试剂,又要排去仪器内原有试剂,检测空白标本,增加检测成本,可行性较差[7]。血浆置换法虽然能对红细胞参数很好地纠正,但会引起白细胞与血小板丢失,且置换次数越多丢失现象越严重。对于含有高效价CAs的血常规标本,如何获得更加真实的检测结果仍是值得探究的问题。
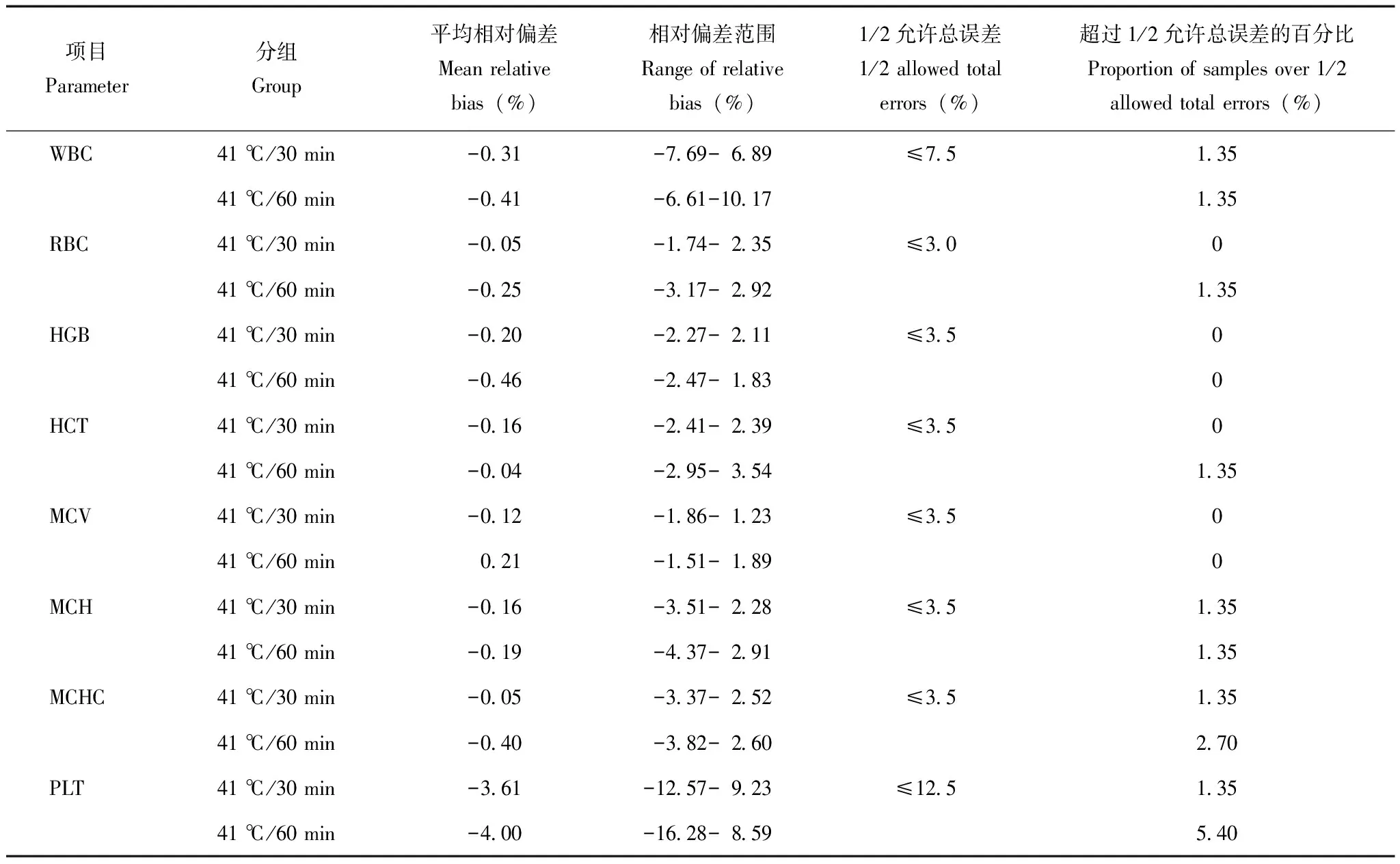
表3 41 ℃温育30、60 min与室温下血常规检测结果的可比性验证
为较好消除CAs尤其是高效价CAs对血常规检验的干扰,本研究通过对2例CAs效价>512的患者标本进行41 ℃温育30 min,并与37 ℃温育法的检测结果比较,显示41 ℃温育可以得到更真实的检测结果。与传统37 ℃水浴2 h相比,该法周转时间明显缩短,又可避免血浆置换这一繁琐而耗时的过程中可能会引入的一些不确定因素。最近有研究提示,对于含有CAs的标本,41 ℃预热1 min后利用网织红细胞通道可以获得比传统的37 ℃预热2 h更准确的红细胞参数,但MCHC除外[8- 9]。本研究结果进一步支持41 ℃温育用于快速纠正RBC及其参数的可行。同时,研究显示2例冷凝集标本在不同温度水浴后的WBC、PLT均较室温直接检测有一定程度的升高。研究表明CAs除直接对红细胞有作用外,也可影响中性粒细胞和血小板计数[2- 3],这可能是患者标本温育后WBC和PLT计数升高的原因。
温度作为血红蛋白和红细胞的一个重要变构因子,过高的温度可引起从血红蛋白的分子结构、功能以至红细胞的形态、结构、功能的显著改变[10- 11]。孙秋瑾等[12]报道43 ℃温育后会造成标本脂蛋白变性,呈现出絮状沉淀物,对红细胞多个参数构成干扰。为了进一步探寻41 ℃水浴法本身对血常规检测各个参数的影响,本研究收集74例无冷凝集素干扰的患者标本,分别在41 ℃水浴30、60 min后与室温检测结果进行比对。结果显示除PLT外,其余WBC、RBC、HCT、HGB、MCV、MCH和MCHC各参数的检测结果和室温检测结果之间无系统差异和比例差异。虽然PLT统计学上有一定的比例差异,但根据行业标准进一步进行结果可比性验证显示,包括PLT在内的各参数其偏移均在临床可接受范围内。因此,对于37 ℃水浴无法纠正的高效价CAs标本,41 ℃温育或许是一种较好的获取真实红细胞参数的替代方法。虽然这一方法仍需要在更大范围的样本选择中得到证实,如原始细胞、非典型淋巴细胞或其他异常细胞存在的标本,因为这些细胞固有的脆弱性,它们可能会因加热而被破坏。另外,在所有方法中都应考虑凝集不完全可逆的可能性。目前血细胞分析仪还不能提供可靠的参数来确认凝集的完全解决,在计数前利用预热玻片进行血涂片镜检可有助于发现残余凝集,以及排除其他MCHC升高的原因,例如球形红细胞增多症。
此外,本研究也提示了实体瘤与冷凝集之间的罕见关联。CAs通常与感染、药物反应、自身免疫性疾病和血液系统恶性肿瘤有关,在实体肿瘤中的报道非常罕见。众所周知,ABH血型抗原并非红细胞所特有,在正常上皮细胞中也表达,但在各种癌症细胞中显著减少。I抗原是ABH抗原的前体,并在癌细胞中积累,可能是由于转化不完全所致[13]。在癌症组织中ABH抗原决定簇的缺失和I抗原增加可能是实体瘤患者出现冷凝集素的重要原因[14]。虽然2例患者均有冷凝集素,但患者血清乳酸脱氢酶水平正常或仅有轻微升高,HGB和胆红素均在正常范围,缺乏溶血的实验室证据;此外,患者也没出现遇冷或受凉后手足发绀或有雷诺氏现象,因此,尚不符合自身免疫性溶血性贫血的诊断标准。研究显示患者体内是否发生补体介导的溶血与冷凝集素的效价和热幅均有一定关系[15]。此外,气温和季节也可能是影响患者发病的重要因素之一[16]。
综上,本研究报道了2例实体瘤患者出现的冷凝集现象,并提出了41 ℃温浴纠正高效价CAs样本血常规检测结果的可行性。CAs的存在通常是在实验室日常工作中随机发现的,对于红细胞参数尤其是MCHC异常升高,或RBC与HGB比例明显失调,应考虑冷凝集素的影响,并采取恰当的处理方式获得更真实的结果。
