信迪利单抗注射液治疗晚期实体肿瘤的临床观察Δ
2021-09-08权红良邓友星陈香存
权红良,邓友星,陈香存
(1.合肥京东方医院肿瘤科,安徽 合肥 230066; 2.安徽医科大学第一附属医院肿瘤放疗科,安徽 合肥 230000)
晚期实体肿瘤无法治愈,生存期较短,其治疗的主要目的是减轻患者痛苦,延长生命,提高生活质量。化疗药的不良反应较大,一旦一线化疗失败,进行二线化疗甚至多线化疗,不但有效率低,而且患者不易耐受;另外,部分患者因体力状况差或合并其他基础疾病,初始即无法接受化疗。虽然目前化疗在实体肿瘤治疗中仍占主导地位,但是随着医学的发展,分子靶向药物及免疫治疗具有低毒、高效且对患者一般情况要求低等特点,其地位逐步提升。临床实践中,靶向药物受难以筛选靶点及受益人群、易出现耐药等条件限制,获益有限,而近年来免疫治疗取得重大进展[1]。免疫治疗药物信迪利单抗注射液对肿瘤作用特异,针对性强,不良反应小,对于化疗失败或无法耐受化疗的晚期实体肿瘤患者不失为一种较好的治疗选择,本研究主要观察信迪利单抗注射液治疗该类患者的有效性和安全性。
1 资料与方法
1.1 资料来源
采用回顾性研究方法,收集2019 年12月至2021年1月合肥京东方医院肿瘤科收治的10例化疗失败或无法耐受化疗的晚期实体瘤患者,均经病理学或细胞学证实,单独使用信迪利单抗注射至少2个疗程,疗效评价为疾病得到控制;肺鳞癌患者3例,胸腺癌患者2例(其中1例为鳞癌,1例为低分化癌),食管鳞癌患者2例,胆管腺癌患者1例,胃腺癌患者1例,膀胱尿路上皮癌患者1例;年龄51~73岁,中位年龄68岁;均为局部晚期或远处转移患者;均为化疗失败或无法耐受化疗者;所有患者预计生存期≥3个月,见表1。
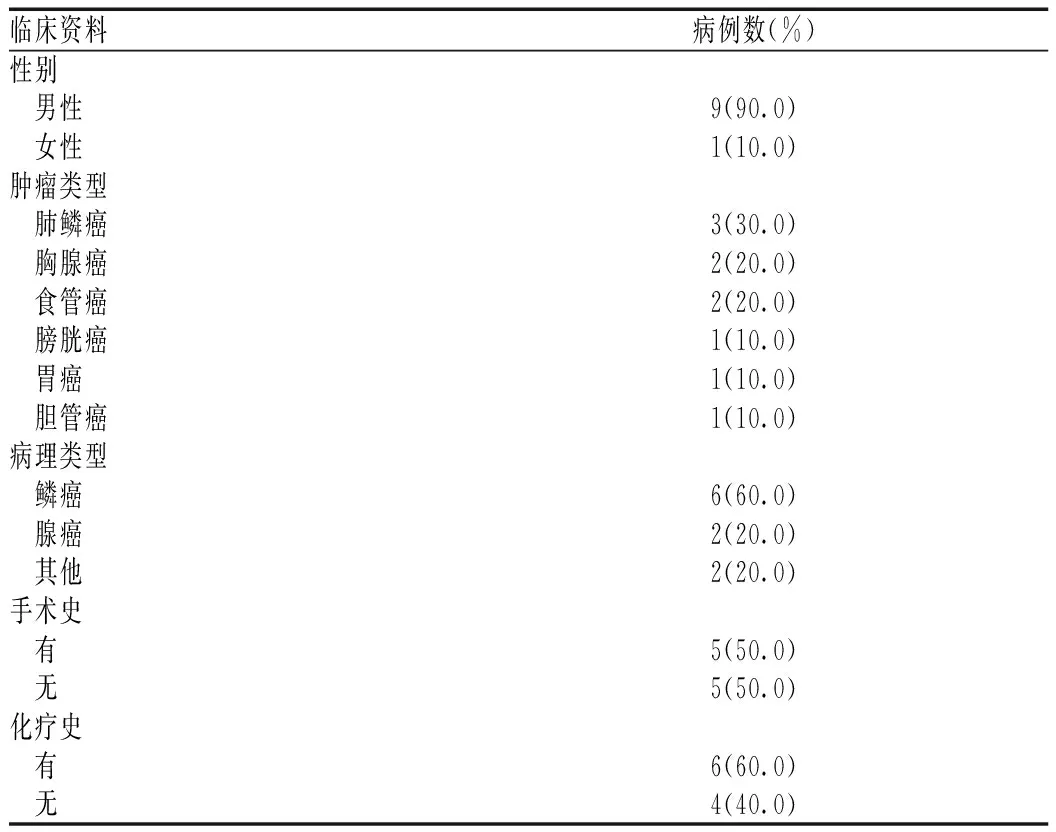
表1 10例晚期实体肿瘤患者的临床资料Tab 1 Clinical data of 10 patients with advanced solid tumors
1.2 方法
信迪利单抗注射液[规格:100 mg(10 ml)/瓶]剂量为200 mg,在30~60 min内静脉滴注,每3周给药1次,持续给药直至患者出现疾病进展、死亡或不可耐受的不良反应。
1.3 疗效评定标准及不良反应评价
疗效采用免疫治疗实体瘤疗效评价标准(immunotherapy respond evaluation criteria in solid tumors,iRECIST)[2],分为完全缓解(immune complete response,iCR)、部分缓解(immune partial response,iPR)、稳定(immune stable disease,iSD)和进展(immune progressive disease,iPD)。iCR:所有病灶消失;iPR:靶病灶缩小程度≥30%;iSD:未达到iPD,也未达到iPR;iPD:靶病灶增加程度≥20%,最小5 mm,或非靶病灶进展或出现新病灶。
采用常见不良事件评价标准(common terminology criteria for adverse events,CTCAE)5.0版记录不良反应并对其分级。第1次客观疗效评价在用药6周后,以每6周进行1次,或出现新的症状及原有症状加重时随时评价。
1.4 统计学方法

2 结果
2.1 疗效
随访截至2021年1月31日,随访时间为1.5~11.5个月,中位随访时间为4.8个月;共10例患者,其中iCR 0例,iPR 2例(占20.0%),iSD 5例(占50.0%),iPD 3例(占30.0%),ORR为20.0%(2/10),DCR为70.0%(7/10),中位PFS和中位OS尚未达到,随访截止时,最长PFS已达9个月(肺鳞癌患者);其中6例既往化疗失败患者的ORR达到16.7%(1/6),DCR为83.3%(5/6)。
2.2 不良反应
最常见的治疗相关不良反应为发热、甲状腺功能减退,治疗相关不良反应发生率为80%;不良反应以1—2级为主,≥3级不良反应发生率为10.0%,见表2。
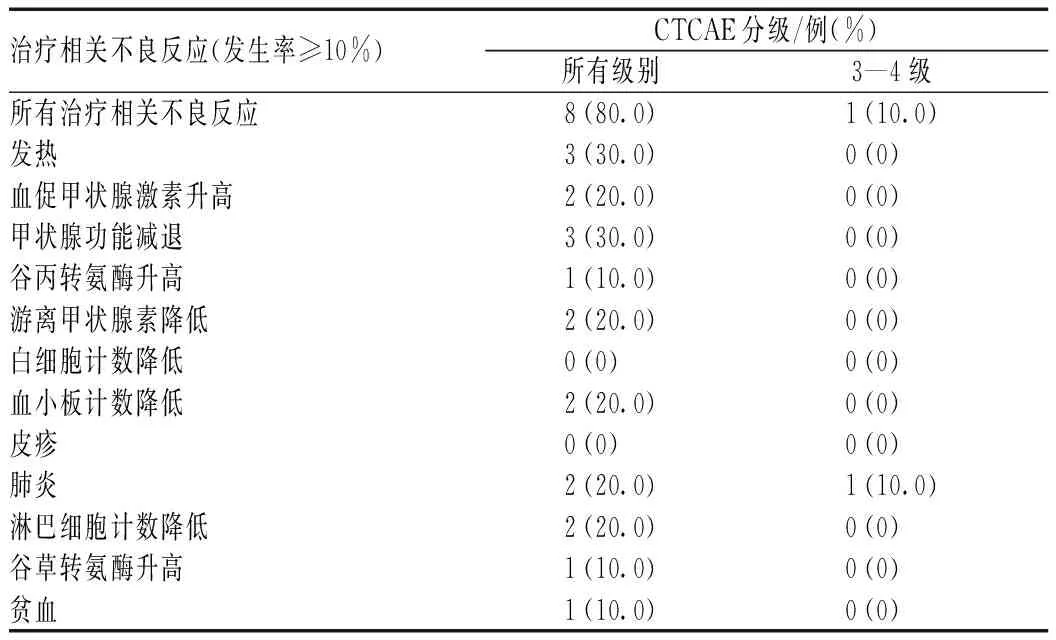
表2 10例晚期实体肿瘤患者的不良反应发生情况[例(%)]Tab 2 Adverse drug reactions in 10 patients with advanced solid tumor [cases (%)]
2.3 典型病历及靶病灶的磁共振成像(magnetic resonance imaging,MRI)变化
某51岁男性患者,于2019年9月10行“胸骨正中劈开纵膈肿瘤切除术+左肺部分切除术+左无名静脉成型术”,术后病理诊断为(纵膈肿瘤)胸腺鳞状细胞癌,伴囊性变,浸润肺组织,肺吻合线切缘未见恶性肿瘤累及。免疫组化结果:P63(+),CD5/6(+),PAX-8(-),MUC1(部分+),CD5(极少+),CD117(+),TDT(-),CD1α(-),CK19(+),CK14(局灶+)。淋巴结(纵膈淋巴结)5枚(0/5)未见癌转移。鳞状细胞癌(左无名静脉癌栓)。
术后行放射治疗11次时,出现左侧上下肢无力伴运动障碍,脑部MRI检查提示脑部有肿瘤转移,建议手术治疗,患者拒绝手术,于2019年12月3—30日行“脑部病灶联合全脑同步加量放疗”,总剂量:肿瘤靶区为5 000 cGy/20 Fx,计划靶区为3 600 cGy/20 Fx。2020年2月18日,行紫杉醇130 mg(第1日)+顺铂40 mg(第1—3日)化疗,化疗1个疗程。2020年3月12日,完善头颅MRI及胸部CT检查,结果提示胸腺癌术后前纵膈、右肺上叶前段胸膜下及心包左侧转移,颅内多发转移。患者于2020年3月20日至2021年1月28日接受16次信迪利单抗注射液200 mg免疫治疗,头颅病灶变化见图1。
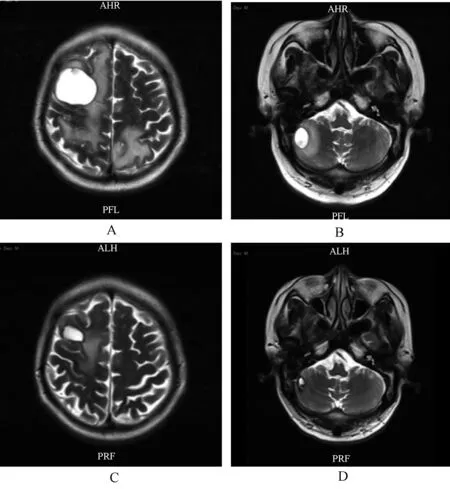
A.2020年3月13日右侧额叶病灶(3.8 cm×3 cm);B.2020年3月13日右侧小脑半球病灶(2.1 cm×1.4 cm);C.2021年1月27日右侧额叶病灶(2.0 cm×1.5 cm);D.2021年1月27日右侧小脑半球病灶(1.0 cm×0.5 cm)A.right frontal lobe lesion (3.8 cm×3 cm) on Mar. 13, 2020; B.right cerebellar hemisphere lesion (2.1 cm×1.4 cm) on Mar. 13, 2020; C.right frontal lobe lesion (2.0 cm×1.5 cm) on Jan. 27, 2021; D.right cerebellar hemisphere lesions on Jan. 27, 2021 (1.0 cm×0.5 cm)图1 典型病例靶病灶的MRI变化Fig 1 MRI changes of target lesions in typical cases
3 讨论
免疫检查点可以维持机体的正常免疫耐受。但是,在机体受到肿瘤侵袭时,免疫检查点途径的异常激活会抑制自身免疫,使机体抗肿瘤反应下调,最终导致肿瘤细胞的生长和逃逸[3-4]。因此,靶向免疫检查点的免疫疗法应运而生,并成为了近十年来炙手可热的肿瘤治疗方法。
做为免疫检查点抑制剂,信迪利单抗注射液是一种全人源化的单克隆抗体,其通过与免疫检查点程序性细胞死亡受体1(PD-1)结合,能够阻断PD-1与其配体PD-L1的相互作用,从而恢复机体正常的抗肿瘤免疫反应,达到控制与清除肿瘤的效果[5]。ORIENT-1研究结果显示,信迪利单抗注射液可明显提高复发或难治性霍奇金淋巴瘤患者的客观缓解率[6]。因此,信迪利单抗注射液于2018年12月24日正式获得国家批准,用于霍奇金淋巴瘤患者。目前,信迪利单抗注射液用于多种实体肿瘤治疗的Ⅰ期、Ⅱ期和Ⅲ期临床试验正在国内外开展中。
KEYNOTE-180研究结果表明,免疫治疗应用于食管癌三线单药治疗,所有患者的总ORR达到9.9%,其中65例鳞癌患者的ORR为14.3%[7]。KEYNOTE-059研究结果表明,免疫治疗用于晚期胃癌或胃食管交界癌患者,ORR达11.6%,DCR为27%[8]。KEYNOTE-061研究结果表明,免疫治疗对比化疗二线治疗晚期胃癌或胃食管结合部癌,虽然单纯免疫治疗并未改善患者的总生存期,但临床安全性更好[9]。CheckMate-017[10]、CheckMate-057[11]、KEYNOTE-010[12]及OAK[13]等多项研究结果均证实,与化疗比较,免疫治疗能显著延长总生存期。基于以上免疫检查点抑制剂的良好疾病控制率、生存获益及临床安全性,本研究纳入10例不同晚期实体瘤患者,均为化疗失败或无法耐受化疗一线使用信迪利单抗注射液进行免疫治疗,ORR达20.0%,DCR达到70.0%,其中6例既往化疗失败患者的ORR达到16.7%(1/6),DCR为83.3%(5/6)。ORIENT-1试验[6]不仅取得了很高的ORR,并且长期随访结果表明,治疗缓解率可以转化为长期的生存获益。本研究结果中,中位PFS、OS虽均未达到,且样本量不大,但初步显示出良好的疾病缓解率及控制率,有生存获益趋势。因此,对于化疗失败或无法耐受化疗的实体瘤患者,使用信迪利单抗注射液进行免疫治疗不失为一个较好的选择,有待扩大样本量进行深入研究。
信迪利单抗注射液的不良反应包括肺炎、腹泻、结肠炎、肝炎、肾炎、内分泌疾病、皮肤不良反应、输注反应和其他免疫相关不良反应[14]。本研究中出现的最常见的治疗相关不良反应是发热、甲状腺功能减退,多为Ⅰ—Ⅱ级,未出现因严重不良反应而终止治疗者,治疗期间无患者死亡,与ORIENT-1试验[6]报告的不良反应类似。基于本研究结果,信迪利单抗注射液的安全性较高。但是需注意,2021年Huanhuan等[15]报告1例肺癌患者,接受第3周期的信迪利单抗治疗后的第6日出现症状并诊断为免疫性心肌炎,该罕见而致命的严重不良反应与大多数免疫检查点抑制剂类似,需要临床医师警惕并及时发现、处理。
随着免疫检查点抑制剂在我国正式获批和临床应用的实际开展,对于有效生物标志物的需求也与日俱增。既往研究结果表明,PD-L1的表达可做为预测抗PD-1/PD-L1免疫治疗反应的生物标志物,然而,PD-L1表达阴性的肿瘤患者也能从PD-1/PD-L1免疫治疗中获益[10,16-17]。因此,PD-L1表达作为免疫治疗疗效标志物还有待进一步研究。由于回顾性研究的局限,本研究中10例患者治疗前均未进行PD-L1表达的检测。
典型病例为1例胸腺癌患者,经多疗程信迪利单抗注射液免疫治疗后,取得了较好的疗效,可能与免疫治疗靶点PD-1/PD-L1在胸腺肿瘤中的表达水平较高有关。由于PD-1/PD-L1在胸腺肿瘤中研究较少,故还需要更多、更深入的研究来证实。
综上所述,信迪利单抗注射液在化疗失败或无法耐受化疗晚期实体瘤患者的治疗中展现出了较好的临床应用前景。
