海洛因成瘾的遗传学研究进展
2021-09-08郭慧明王昆华
郭慧明,王昆华
(1.昆明医科大学国家卫健委毒品依赖和戒治重点实验室,中国云南 昆明 650500;2.昆明医科大学第一附属医院妇科,中国云南 昆明 650032)
毒品成瘾已成为世界各国共同面对的重大公共卫生难题,其不仅对人体的正常生理机能及免疫功能造成严重破坏,损害身心健康,而且会引发一系列的社会问题。世界卫生组织发布的《2019年世界毒品报告》显示,阿片类药物尤其是海洛因仍然是目前危害最大的成瘾性毒品,2017年因吸毒死亡的585 000人中,2/3是由于吸食阿片类药物。阿片类药物成瘾机制尚不清楚,但普遍认为其由人口、遗传、社会心理和结构/环境等因素共同决定[1],其中遗传因素是决定药物成瘾易感性的重要原因之一,尤其是在海洛因成瘾方面[2]。因此,本文就海洛因成瘾的遗传学最新研究进展进行综述,以期为海洛因成瘾的机制研究、新的海洛因成瘾生物标志物和治疗靶点的发现提供新的思路和理论参考。
1 遗传因素与海洛因成瘾
遗传因素是海洛因成瘾的重要影响因素,海洛因成瘾的易感性有40%~60%与遗传因素有关[3~5]。通常,药物成瘾具有家族聚集性,且男性比女性更易成瘾[6]。此外,不同人种对毒品的依赖性也不同。大多数海洛因依赖者在第1次接触阿片类药物时不仅没有愉悦感还会有恶心、呕吐等不适,只有多次接触直至成瘾后,才会出现欣快感。个体从初次接触海洛因到海洛因成瘾的时程存在较大差异,并受到包括遗传背景在内的多重因素影响[7]。本实验室对云南省吸毒人群进行调查研究也发现,海洛因成瘾性不仅具有地域差异,还存在民族差异(数据尚未发表)。以上研究结论均提示,遗传因素在海洛因成瘾性及成瘾过程中发挥重要作用。
从20世纪90年代开始,人们就注意到遗传因素在海洛因成瘾中所占据的重要地位。研究者们通过双胞胎研究、家系研究以及全基因组关联研究(genome-wide association study,GWAS),逐渐明确了遗传因素在阿片类药物成瘾方面起到的重要作用。在双胞胎研究领域影响最深远的是Tsuang等[8]的研究,他们对1 874对同卵双生子和1 498对异卵双生子的药物滥用情况进行了调查,发现同卵双生子药物成瘾的一致性显著高于异卵双生子(82/331 vs.40/243,P<0.01),这从侧面证实,相较于环境因素,遗传因素对药物成瘾的影响似乎更为显著。一项对9个家系进行的回顾性研究得出结论,药物成瘾存在很强的家族效应[9]。Cadoret等[10]的一项收养研究表明,亲生父母的反社会人格障碍预示着被收养者的反社会人格障碍和药物滥用。需要指出的是,海洛因成瘾的遗传方式不符合孟德尔单基因遗传规律,因为在双生子成瘾者中,药物滥用次数、从药物滥用到成瘾的过程等表型均存在着高度的不一致性,这提示着多因子遗传方式的存在[11]。
2 海洛因成瘾相关的单核苷酸多态位点
单核苷酸多态性(single nucleotide polymorphism,SNP)广泛存在于人类基因组中,指在基因组水平上由单个核苷酸变异所引起的DNA序列多态性,是人类可遗传变异中最常见的一种。一项基于大样本并且带有全基因组数据的、关于阿片类药物依赖遗传性的研究证实,近一半阿片类药物(包括海洛因)依赖的易感性可归因于常见的SNP[12]。
2.1 多巴胺能系统相关基因
众所周知,多巴胺(dopamine,DA)是与药物成瘾关系最为密切的神经递质,其位于中脑边缘的奖赏通路,是各种成瘾药物作用的关键靶区。目前,多巴胺能系统相关基因的SNP与药物成瘾,尤其是海洛因成瘾的关系已受到广泛关注。多巴胺受体(dopamine receptor,DR)大致可分为两大类:1)D1样受体,包括DRD1和DRD5;2)D2样受体,包括DRD2、DRD3和DRD4。过去20年各种多巴胺受体SNP与海洛因成瘾的相关性陆续被报道,近期研究主要集中在DRD2的TaqIA多态性上。TaqIA是一种常见的SNP(rs1800497),位于与DRD2基因邻近的ANKK1基因[13]。TaqIA的多态性与海洛因成瘾的易感性相关,海洛因成瘾者往往呈现高TaqlAA1频率[14]。国内也有相关报道,TaqIA位点携带A1等位基因的中国汉族人群更易形成海洛因依赖[15]。A1等位基因可能是海洛因成瘾的危险因素,其病理学基础可能与慢性成瘾患者纹状体中DRD2密度降低相关。正电子发射断层成像(positron emission tomography,PET)研究显示,与健康对照组相比,海洛因依赖者的纹状体DRD2密度和突触前多巴胺释放显著减少[16~17],低水平的DRD2可以触发药物寻求行为,并导致阿片类奖励效应[18]。另有研究显示,A1等位基因携带者(A1+:A1/A1)纹状体中的DRD2密度较A2纯合子(A1-:A2/A2)携带者更低[19],即A1等位基因携带者对奖励的敏感性降低,他们会产生更强烈的冲动去寻求成瘾性药物,从而刺激多巴胺系统,导致携带A1等位基因的个体明显增加了阿片类药物依赖的风险[20~21]。近期研究发现,当接触到与海洛因相关的线索时,携带A1等位基因的海洛因依赖者(A1+)和没有携带A1等位基因的成瘾者(A1-)的大脑反应不同,A1+成瘾者在前额叶、中脑边缘系统和视觉空间注意相关区域表现出了更高的药物线索诱导的脑反应[22]。一项关于中国汉族DRD2与海洛因成瘾相关性的研究揭示了与成瘾相关的新的DRD2多态位点,该研究认为:与健康对照组相比,海洛因成瘾者的rs6275 AA基因型频率较低,而rs1125394的C等位基因频率较高;单倍型分析显示,DRD2基因的T-G-A(第1区)单倍型对海洛因成瘾具有保护作用[23]。
DCC(deleted in colorectal cancer)是一种单程跨膜蛋白,属于免疫球蛋白超家族,最初被鉴定为肿瘤预后标志物,随后的研究发现其在中脑边缘的多巴胺神经元中表达,并作为netrin-1的受体,通过促进轴突的引导和迁移,控制内侧前额叶皮层的神经支配[24]。在青少年时期,内侧前额叶皮层中多巴胺连接的改善持续进行[25],若DCC表达异常将严重影响多巴胺回路的结构和功能的成熟,进而影响成瘾的易感性;成年后,DCC的异常表达同样对药物成瘾造成影响,研究表明,DCC表达不足的成年小鼠对药物奖赏效应的敏感性显著降低[26]。有学者对DCC的SNP与其表达以及海洛因成瘾易感性的相关关系进行了探索,发现位于DCC 3′非翻译区(3′-untranslated region,3′-UTR)区域的SNPs rs12607853、rs2292043及rs16956878与DDC的表达相关,并与海洛因成瘾有很强的关联性[27],其中rs12607853位点可与hsa-miR-422a靶向结合,在海洛因成瘾过程中调控DCC的功能,这为新的阿片类成瘾生物标志物或治疗靶点的开发提供了参考[28]。
2.2 阿片受体相关基因
阿片受体(opioid receptor,OPR)相关基因包括OPRM1(opioid receptor mu 1)、OPRK1(opioid receptor kappa 1)、OPRD1(opioid receptor delta 1)和POMC(proopiomelanocortin),它们均是海洛因成瘾的候选基因[29]。μ型阿片受体基因OPRM1的SNP A118G与滥用海洛因有关,在受试的118例欧洲高加索人群中,约90%的118G等位基因携带者是海洛因使用者[30]。在中国汉族人群中,OPRM1外显子1(118A>G)SNP改变了μ型受体与阿片类物质的相互作用,内含子2(IVS2+31G>A)SNP与海洛因成瘾者的海洛因摄入剂量相关,同时携带118A>G和IVS2+3lG>A的AG单倍体成瘾者的海洛因摄入量明显高于其他成瘾者[31]。在澳大利亚人群中,δ型阿片受体基因OPRD1的位点rs2236857和rs581111的GA单倍型提示更高的海洛因成瘾风险[32]。Huang等[29]在801例中国汉族海洛因成瘾者和530例对照中分析了阿片相关基因的10个多态性位点,发现OPRD1的rs2234918 C等位基因在海洛因成瘾组中高表达,逻辑回归分析进一步证实了这一发现:C等位基因携带者的海洛因成瘾风险是T/T纯合子的1.42倍。此外,在海洛因成瘾者中,OPRD1 rs2236857的T/T纯合子比C等位基因携带者具有更严重的应激反应,该结果表明,OPRD1基因不仅在海洛因成瘾的发病机理中起作用,而且还影响我国汉族人群海洛因成瘾者对生活压力的反应,具有风险基因型的患者可能需要其他社会及心理干预措施以预防复发。
美沙酮维持治疗受阿片受体相关基因多态性影响,Fang等[33]对台湾省344例接受美沙酮维持治疗患者的OPRD1基因编码区多态位点进行了检测,发现rs204047位点的多态性与美沙酮剂量相关,rs204047和rs797397位点的多态性与患者对美沙酮的反应相关,提示OPRD1基因的变异直接影响美沙酮维持治疗的效果。
强啡肽原(prodynorphin,PDYN)是强啡肽(dynorphin,DYN)相关肽的前体,其编码基因定位于20号染色体短臂(20p13)[34~35],经翻译加工后表达DYNs。DYNs与κ阿片受体(κ-opioidreceptor,KOP;由OPRK1编码)有高度亲和性[36],其与KOP结合后可抑制多巴胺的释放,控制情绪、动机和刺激-反应(习惯)形成的脑回路,并参与药物寻求行为[37],在药物成瘾中起关键作用。PDYN的表达及其功能变化受SNP影响,研究发现,在伊朗人群中PDNY rs910080 T>C变异体显著增加了海洛因依赖的风险,但rs2281285 A>G和68 bp VNTR变异与海洛因依赖无关[38]。在高加索人群中,PDYN 68 bp重复基因型[根据重复数分类为:短-短(SS)、长-长(LL)和短-长(SL)]与海洛因成瘾者首次使用海洛因的年龄相关,与SS、SL基因型相比,LL基因型成瘾者首次使用海洛因的年龄更大[39]。在中国汉族人群中,海洛因成瘾风险与PDYN 68 bp VNTR的H等位基因显著相关,与LL基因型患者相比,HH基因型患者表现出更多的戒断病例,基因-基因相互作用分析表明PDYN rs3830064、68 bp VNTR 与 OPRK1 rs16918842、rs3802279之间存在强相互作用,提示PDYN的多态性在海洛因成瘾中具有重要作用[40]。
2.3 5-羟色胺系统相关基因
5-羟色胺(5-hydroxytryptamine,5-HT)是另一种与药物成瘾相关的重要神经递质,通过调节奖励途径中的多巴胺释放参与海洛因依赖。研究发现,5-HT和多巴胺与海洛因成瘾以及复吸密切相关,长期吸食海洛因患者的大脑中5-HT代谢物水平显著下降,而5-HT系统功能障碍将导致毒品成瘾者冲动、抑郁、行为抑制障碍等吸毒相关症状[41]。5-HT系统的功能及基因表达水平与5-HT系统相关基因的多态性有关,既往已有大量报道证实了5-HT系统相关基因多态性与海洛因成瘾易感性以及复吸时间间隔的相关性,近年来又有一些新的多态位点被鉴定出来。一项关于5-羟色胺转运蛋白(5-hydroxytryptamine transporter,5-HTT)编码基因两个常见多态位点[连接启动子区的5-httlpr和内含子2(STin2)]与海洛因成瘾相关性的荟萃分析发现,5-httlpr的S等位基因与海洛因成瘾相关,且这种相关性在白色人种中更为显著,存在种族差异,而STin2的多态性并不改变海洛因成瘾的易感性[42]。
5-HT受体负责调节5-HT的合成和释放,其基因多态性同样与海洛因成瘾易感性相关。既往研究表明,5-羟色胺受体1B(5-HT receptor subtype 1B,HTR1B)rs1156881多态位点和欧美人群海洛因成瘾有极强的关联性,G1180A的G等位基因则是海洛因成瘾的保护因子[43~44]。在中国汉族人群中,G861C位点是与海洛因成瘾显著相关的多态位点,其中G等位基因是可能的风险因素[45]。新近的研究对其他5-HT受体多态性与海洛因成瘾的关系进行了补充,Yin等[46]通过对中国汉族人群中HTR3B的7个SNPs与海洛因依赖的潜在关联进行检测发现,rs1176746和rs1185027不同基因型在海洛因依赖者与健康对照者之间的分布存在显著性差异,rs1176746 GG基因型和rs1185027 AA基因型携带者更易海洛因成瘾,而rs1176746 GA基因型和rs1185027 AT基因型是海洛因成瘾的保护因素。
2.4 酶相关基因
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种重要的功能性氨基酸,广泛存在于脑灰质,作为机体最重要的抑制性神经递质,参与多种代谢活动,机体缺乏GABA时,会产生焦虑、不安、疲倦、忧虑等不良情绪。谷氨酸脱氢酶(glutamate dehydrogenase,GAD)是参与合成GABA的限速酶,由67 kD和65 kD两种大小的亚型组成,这两种亚型分别由GAD1和GAD2编码,并在大多数脑区共同表达。Shi等[47]通过对801例海洛因成瘾者的GAD多态位点进行检测发现,GAD1基因的多态性与海洛因成瘾尤其是海洛因成瘾后记忆损害相关,并与美沙酮维持治疗的日剂量相关,而在大脑分布较多的GAD2基因的多态性却与海洛因成瘾无关,具体原因有待进一步研究。
乙酰胆碱(acetylcholine,ACh)是能被乙酰胆碱酯酶(acetylcholinesterase,AChE)水解的胆碱能神经递质,是中枢和周围神经系统中必不可少的神经递质和神经调节剂,对包括成瘾在内的许多神经元功能具有调节作用。在巴基斯坦人群中,海洛因成瘾者血浆中AChE的活性显著高于对照组,AChE的rs17228602位点的基因多态性与该人群海洛因成瘾显著相关[48]。
丁基胆碱酯酶(butylcholinesterase,BChE)由肝脏合成,分布于血浆、皮肤细胞、平滑肌、大脑、肾脏和心脏[49],可对可卡因进行代谢解毒,也负责海洛因的部分代谢[50]。Munir等[51]对巴基斯坦海洛因成瘾者的BChE活性以及BChE基因SNPs rs3495和rs1803274与成瘾易感性的相关关系进行了研究,发现海洛因成瘾者的BChE活性显著高于对照组,但未检测到上述SNPs与成瘾易感性相关。
当细胞暴露于美沙酮、吗啡等阿片类药物后,多种抗氧化酶基因的表达水平下调[52~53],提示氧化应激反应在药物成瘾中发挥重要作用。超氧化物歧化酶-2(superoxide dismutase 2,SOD2)是一种四聚体线粒体基质酶,是机体主要的抗氧化酶之一,Boroumand等[54]对伊朗人群中442例海洛因成瘾者和799例健康对照者进行了SOD2基因多态性与海洛因成瘾相关关系的研究,发现SOD2 rs2758339的AC和CC基因型以及rs5746136的AA基因型与海洛因成瘾风险呈负相关,但SOD2的多态性并不影响其表达水平。与此相反,SOD1启动子区域Ins/Del的多态性却只与SOD1的表达水平有关,与海洛因成瘾无关[55]。过氧化氢酶(catalase,CAT)同样在机体氧化还原以及细胞解毒过程中发挥重要作用,研究者们对CAT的两个多态位点A-21T和C-262T进行了检测,发现CAT A-21T多态性的T等位基因与海洛因成瘾风险呈正相关,而TC单倍型基因携带者的CAT表达水平显著升高[56]。并非所有接触过海洛因的人都依赖海洛因,钙依赖性/钙调蛋白依赖性蛋白激酶Ⅱα(calcium-dependent/calmodulin-dependent protein kinaseⅡα,CamKⅡα)是一种参与长时程增强和突触可塑性的关键酶,近期研究发现,位于CamKⅡα基因组区域的遗传变异可能与偶尔使用海洛因到正常使用的过渡时间有关[57]。
2.5 压力相关基因
目前,越来越多的研究证实压力和海洛因成瘾之间有强而有力的相关关系[58~59],压力使人更容易依赖海洛因,且更易出现戒断后复吸[60],而个体对压力的反应存在较高的差异性,受遗传和环境因素影响,其中遗传因素主要取决于压力相关基因的SNP。促肾上腺皮质激素释放因子系统是下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA axis)的重要组成部分,与压力及应激密切相关,包括促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)、促肾上腺皮质激素受体(CRH receptor,CRHR)和促肾上腺皮质激素结合蛋白(CRH-binding protein,CRHBP)[61]。研究发现,CRHBP rs1875999位点的多态性与非裔美国人海洛因成瘾有关[62],而其rs3792738位点的多态性可通过影响生活压力预测海洛因的复发风险[63]。另有研究报道,CRHBP下游的SNP rs1500以及 SNP rs10482672(NR3C1)和 rs4234955(NPY1R/NPY5R)的相互作用有助于成瘾者长期保持海洛因戒断的能力[64]。
2.6 DNA修复相关基因
长期吸食海洛因将产生活性氧,下调DNA修复通路相关基因,导致神经元DNA损伤。另一方面,DNA修复通路相关基因在大脑中的异常表达以及基因的多态性将可能影响相关蛋白质的生物活性,在海洛因成瘾中发挥重要作用。研究者们首先对核苷酸切除修复(nucleotide excision repair,NER)涉及的基因XRCC4、Ku80和 DNA-PKcs的多态性与海洛因成瘾的相关性进行了探索,发现XRCC4基因两种常见的多态性位点(rs6869366和rs28360071)与海洛因成瘾易感性相关[65]。人类着色性干皮病C组(xeroderma pigmentosum complementation group C,XPC)基因也是在大脑中表达的NER通路上的关键基因,针对伊朗442例海洛因成瘾者和795例对照进行的研究发现,XPC“Ala+Gln”单倍型与海洛因成瘾有显著的相关性,而且Ala499Val(rs2228000)多态性可能与首次接触海洛因的年龄有关[66]。
3 讨论与展望
遗传因素作为影响海洛因成瘾的重要因素,其相关研究有近30年的历史,研究方法包括家系研究、双生子研究和寄养子研究,但早期研究多为现象研究,缺乏机制探讨,且进展较慢,随着分子遗传学的发展,基因多态性与成瘾易感性的研究逐渐受到更多学者的重视。学者们结合海洛因成瘾的病理和生理学机制研究成果,对可能与成瘾相关的基因进行多态位点检测,获得了大量热门的候选基因(表1)。
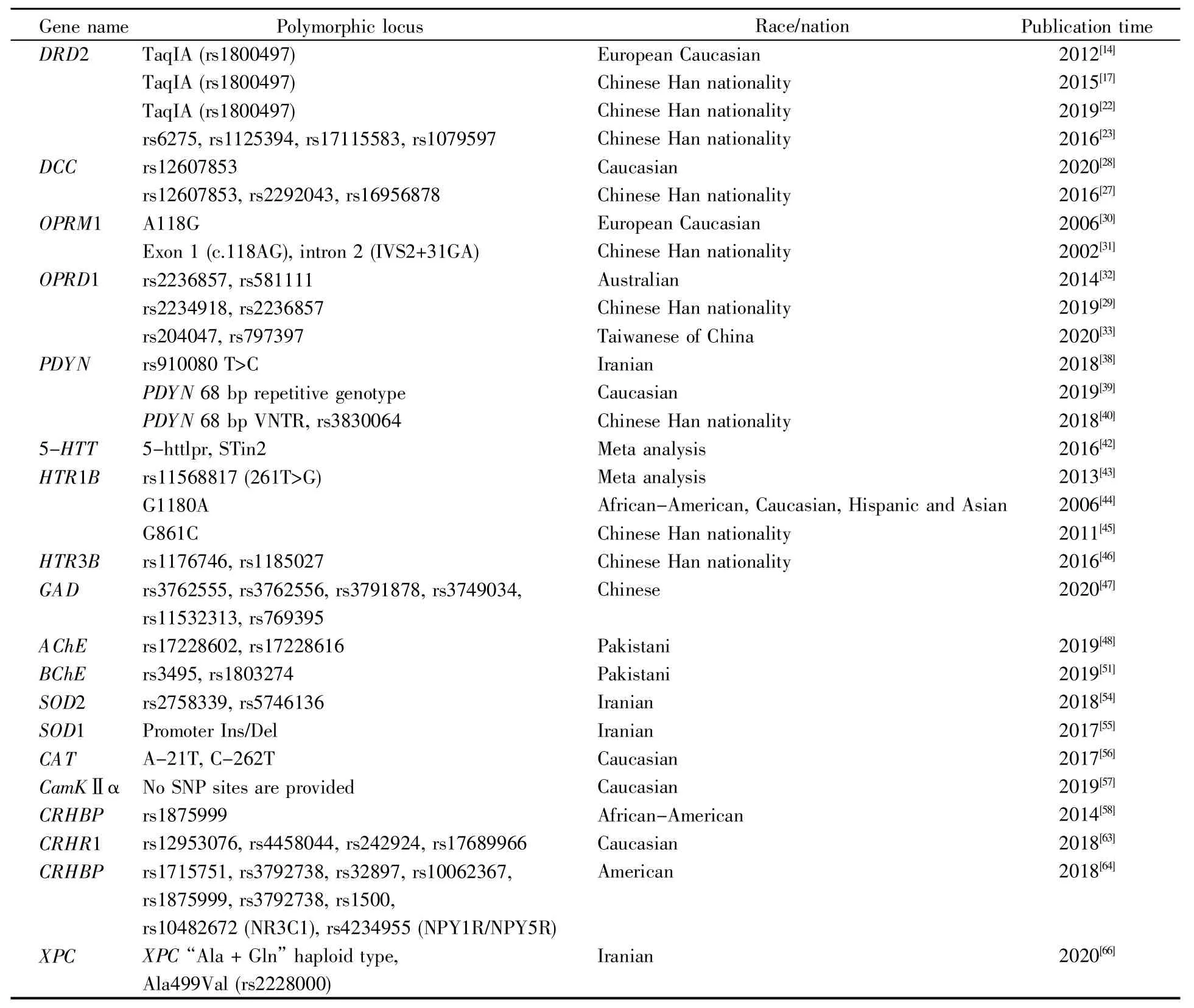
表1 海洛因成瘾易感性相关的候选基因及多态位点Table 1 Candidate genes and polymorphic loci related to heroin addiction susceptibility
奖赏效应被认为是海洛因成瘾的重要机制之一,于是学者们首先将研究重点放在与奖赏回路相关的多巴胺受体上,并成功在多个人种中发现:多巴胺受体基因的多态性可通过多种途径影响个体对海洛因的易感性。此外,海洛因是阿片类物质,在中枢神经系统内有相应的阿片受体以及内源性配体,故阿片系统相关基因也成为该研究领域的热门候选基因,近20年来不断有阿片系统相关的新的基因和多态位点在不同人种中被鉴定出与海洛因成瘾易感性相关。随着研究的深入,候选基因不再局限于与人类精神活动相关的基因,还涉及与机体代谢相关的基因、编码海洛因代谢酶的相关基因、参与氧化还原的相关基因、机体心理压力相关的基因以及DNA修复相关的基因。总之,随着GWAS等研究技术的兴起,越来越多的与海洛因成瘾易感性相关的基因及其多态位点被发掘,这为我们综合分析海洛因依赖相关基因各多态性位点提供了可能。如果能够对主要相关基因的多态性位点进行连锁分析,将有可能寻找到能早期预测个体成瘾危险度的生物标志物,甚至发现治疗靶点,从而制定个体化的防治方案。
然而,通过综述不难发现,SNP在不同族群中的一致性较差,在不同种族相同多态性位点研究中,人们得出的结论常不尽相同,究其原因可能是,海洛因成瘾不仅受遗传因素影响,还受到环境、心理社会等多种因素调节,是一个复杂的受多因素调控的慢性脑病。未来的研究,若能立足于环境-基因交互作用模式,扩大样本量,在不同社会、族群中对主要相关基因的多态性位点进行连锁分析,将有可能寻找到能早期预测个体成瘾危险度的生物标志物,甚至发现治疗靶点,从而制定个体化的防治方案。
表观遗传学是目前研究的热点,越来越多的研究发现,蛋白质修饰、DNA甲基化、非编码RNA修饰及染色质重塑等表观遗传变化在人类疾病的发生发展中起重要作用。表观遗传学的研究有望为海洛因成瘾的分子调控机制探索提供新视角,并为海洛因成瘾的治疗提供新方向和新思路。遗憾的是,在药物成瘾的遗传学研究中,关于表观遗传因素对海洛因成瘾易感性影响的研究较少。是某些关键基因的突变,引起蛋白质表型的不同,进而导致个体成瘾易感性出现差异?还是长期滥用海洛因,导致表观遗传的改变,进而出现各种生理病理的异常?有待进一步研究,这也为我们的后续研究留下了很大的空间。