消化道营养物质吸收代谢昼夜节律性调控机制的研究进展
2021-09-08习瓒娜裴江兰甄永康王梦芝
习瓒娜,裴江兰,甄永康,王梦芝
(扬州大学动物科学与技术学院,中国江苏 扬州 225009)
昼夜节律存在于生物体内多种生理生化过程中,调节机体环境与生理过程之间的相互作用,使生物体能更好地适应外界环境的节律改变[1]。研究表明,昼夜节律能够调控生物体对营养物质的吸收代谢,并影响各种营养物质的功能[2~3]。例如:大鼠的体内实验显示,葡萄糖摄取具有明显的24 h节律[4];小鼠肠道中肽转运蛋白1(peptide transporter 1,PEPT1)的表达具有节律性[5];芳香烃受体核转位蛋白样1(brain and muscle ARNT-like 1,Bmal1)基因被证明可以调节肠道脂质吸收的节律[6]。昼夜节律调节多种胃肠功能,包括细胞增殖、免疫稳态、肠道通透性及微生物的平衡和代谢[7~12]。昼夜节律的破坏会造成多种生理功能的失调,对生物体的健康产生极其严重的影响。比如:Bmal1突变的小鼠和Clock(circadian locomotor output cycles kaput)突变的小鼠的胃肠都表现出细胞增殖的紊乱[8~9];Per1(Period1)和 Per2(Period2)基因敲除小鼠的肠道微生物的节律消失,昼夜节律被打乱,导致肠道菌群失调[10~12]。此外,昼夜节律紊乱会增加消化系统疾病的易感性,如肠道炎症、十二指肠溃疡、肠应激疾病和胃肠癌症[13~14]。相关研究报道,结肠癌组织中存在Clock基因的突变[15];在小鼠中,昼夜节律紊乱损害肠道屏障的完整性[16];敲除Clock或Cry(cryptochrome)基因的小鼠比野生小鼠产生更多的促炎细胞因子[17];与白班工人相比,夜班工人感染胃炎和消化性溃疡的风险较高[18]。因此,昼夜节律在胃肠中发挥重要作用,进一步研究生物钟与消化道营养物质吸收代谢之间的关系,对调控机体健康有一定的参考意义。
1 消化道昼夜节律系统及其对消化循环的影响
沿胃肠道布的营养传感器可释放大量影响胃肠功能、营养稳态和能量平衡的信号肽[19]。Furuya和Yugari首先在1974年证明了肠道吸收在大鼠中表现出昼夜节律[20~21]。与早餐后的消化率相比,晚餐后的消化率和肠吸收率要低[22]。研究表明,消化道存在生物钟基因,这些生物钟基因参与胃肠功能和活动,如胃排空、结肠蠕动、胃液分泌和酶的活动[7,23]。Bmal1通过调节应激反应,促进肠上皮24 h节律的产生[8]。敲除Per1或Per2会改变结肠的运动节律,同时敲除Per1和Per2可使小鼠结肠活动的昼夜节律消失[24]。有研究发现,啮齿动物的生物钟基因在胰腺中也以昼夜节律的方式表达。针对缺乏生物钟基因Bmal1的小鼠胰腺进行的研究发现,实验小鼠存在严重的葡萄糖不耐受和胰岛素分泌缺陷[25~26]。目前,胰酶淀粉酶和胰蛋白酶分泌的昼夜节律变化在人类受试者中已被报道[27]。此外,胰岛素分泌率也被证明有昼夜节律性,其中血浆胰岛素水平在清晨增加,下午达到峰值,晚上下降[28]。由此可见,消化道的生物钟基因以昼夜节律的方式表达,它们可能是胃肠活动的重要调控因子。
2 昼夜节律与消化道营养物质吸收代谢
昼夜节律系统在营养吸收方面起着重要作用,正常的生物钟系统有利于营养物质的吸收利用。肠道生物钟的破坏会影响营养物质的吸收与节律性,Pan等[29]研究发现,在小鼠小肠中,转运营养物质水解产物的转运蛋白的mRNA表达具有昼夜节律,而这些营养转运蛋白的昼夜节律在Clock突变小鼠中消失,并且Clock突变小鼠吸收营养物质的量也发生了改变,这说明生物钟调控着肠道内多种营养物质的转运。
2.1 葡萄糖吸收代谢的节律性和调节机制
碳水化合物主要由单糖(葡萄糖、果糖和半乳糖)、二糖(乳糖和蔗糖)和多糖(淀粉和纤维素)组成。多糖通过小肠刷状缘水解酶的作用分解为单糖,肠腔中的单糖被肠上皮细胞吸收,这些单糖通过肠上皮细胞基底外侧的转运蛋白从浆膜侧输出到肠上皮细胞外,进入血液循环[30]。钠葡萄糖协同转运蛋白1(sodium/glucose cotransporter 1,SGLT1)、葡萄糖转运蛋白2(glucose transporter 2,GLUT2)和GLUT5是存在于啮齿动物小肠中的主要己糖转运蛋白,它们协同促进肠道中葡萄糖的吸收[31]。
大鼠体内实验显示,无论是在实验前1 h禁食还是按照预定的喂养方案喂食,葡萄糖摄取都表现出明显的24 h节律[4],这表明在正常喂养条件下,葡萄糖摄取的昼夜节律与进食模式无关,可能由视交叉上核(suprachiasmatic nucleus,SCN)中的昼夜节律系统调节。有研究发现,Sglt1的mRNA表达具有明显的昼夜节律[32~33]。此外,Glut2和Glut5的表达也具有节律性[34~35]。染色质免疫沉淀(chromatin immunoprecipitation,ChIP)实验发现,Bmal1与己糖转运蛋白编码基因的启动子结合[35]。以上信息提示,Bmal1可能直接调节基因Sglt1、Glut2和Glut5的表达,己糖转运蛋白的调控直接受时钟基因的控制。
O′brien等[19]在研究鼠胃肠道糖传感器相关基因和蛋白质的表达水平时发现,甜味受体(Tas1r2,Tas1r3,Gnat3,Gnat1)、糖转运蛋白(Sglt1,Glut2,Glut5)和特定糖传感器(Slc5a4a,Slc5a4b)基因的表达水平分别在舌头、近端与远端小肠中最高,生物钟基因(Cry2/Bmal1)在所有研究区域均可检测到活动,尽管SGLT3蛋白的表达未检测到节律性,但是Slc5a4a和Slc5a4b基因的表达分别在小肠和胃中显示出明显的昼夜节律性,同时,Tas1r2、Tas1r3和Gnat1在近端小肠中也表现出明显的表达节律。这说明,胃肠道糖传感器基因可能受生物钟基因调控,生物钟基因与营养素相互作用。
2.2 脂质吸收代谢的节律性和调节机制
生物钟在调节肠细胞的脂质吸收中也起重要作用,越来越多的研究表明,昼夜节律紊乱会增加脂质积累的风险,导致脂质吸收受损[36~37]。脂肪从肠腔摄取到肠细胞的主要步骤是胆汁乳化、脂肪酶水解和转运体摄取[38~44]。脂肪酸通过脂肪酸结合蛋白在细胞内转运,在内质网中,脂肪酸用于合成三酰基甘油、磷脂和胆固醇酯,这些脂质被包装成称为乳糜微粒的脂蛋白[45~46]。乳糜微粒是非常大的富含三酰基甘油的球形颗粒,含有磷脂和胆固醇,这些颗粒的表面覆盖有磷脂单层、游离胆固醇和几种载脂蛋白。乳糜微粒组装需要两种蛋白质:载脂蛋白B(apolipoprotein B,ApoB)和微粒体甘油三酯转移蛋白(microsomal triglyceride transfer protein,MTP)。
有研究表明,脂质的吸收在24 h内差异显著,Clock的过表达会显著降低Mtp的表达[29,47]。CLOCK:BMAL1异二聚体有节奏地激活小异二聚体伴侣(small heterodimer partner,SHP),从而抑制Mtp的表达[47]。相关研究报道,小鼠在夜间吸收的甘油三酯和胆固醇含量明显高于白天,并且甘油三酯和胆固醇的吸收与ApoB和MTP的表达表现出相关的昼夜波动[48];小鼠小肠中有昼夜节律因子Noc(nocturnin)的表达,与Noc+/+小鼠相比,Noc-/-小鼠吸收更少的甘油三酯和胆固醇[49~50];Noc的转录起始位点上游具有E-box,而CLOCK:BMAL1异二聚体可与这些序列直接结合[51]。这些研究表明Clock参与脂质转运的日常调控。
此外,Pan等[29]在正常昼夜循环和自由获取食物的条件下,还研究了其他参与脂质合成和吸收的基因的表达,发现二脂酰基甘油酰基转移酶2(diacylglycerol acyltransferase 2,Dgat2)、脂肪酸结合蛋白(fatty acid-binding protein,Fabp)、硬脂酰辅酶A去饱和酶1(stearyl coenzyme A dehydrogenase 1,Scd1)和肪酸合成酶(fatty acid synthase,Fas)的mRNA呈现日变化。本实验室前期研究发现,生物钟基因参与瘤胃上皮挥发性脂肪酸(volatile fatty acid,VFA)代谢的调控,Clock、Bmal1、Per2 和Per3与单羧酸转运蛋白1/4(monocarboxylate transporter 1/4,Mct1/4)存在显著的相关性[52]。综上可知,昼夜节律参与调节脂质合成和吸收。
2.3 蛋白质吸收代谢的节律性和调节机制
生物钟基因已被证明可以调节肠道肽转运蛋白的节律[53]。蛋白质在消化道中被消化成氨基酸、二肽和三肽,其中,二肽和三肽由PEPT1转运。PEPT1是质子依赖的肽共转运蛋白,能够将H+和肽转运到肠上皮细胞中,肽的转运与H+浓度相关,而与细胞内肽的浓度无关。为了能够有效进行肽的转运,细胞内的H+浓度被Na+/H+转运蛋白3(Na+/H+exchanger 3,NHE3)维持在较低水平。该转运蛋白将H+泵入肠细胞,并交换出Na+,使细胞内Na+浓度保持较低水平,同时K+-ATP酶泵出Na+,输入K+。机体通过这些转运蛋白的共同作用促进肠上皮细胞对肽的摄取。所有的肽在肠上皮细胞的细胞质中被水解为氨基酸,并通过氨基酸转运蛋白跨过基底外侧转移到血液循环中[54~55]。
大鼠结肠中Nhe3的表达具有昼夜节律性[54]。研究报道,Cry1和Cry2敲除小鼠与Clock突变小鼠中Nhe3的mRNA表达均降低[54];Nhe3的启动子含有一个E-box序列,该序列可被CLOCK:BMAL1异二聚体反式激活,提示Nhe3的这种有节奏的表达可能是由结肠生物钟驱动的[5,54]。
PEPT1的表达在24 h内也会发生节律性变化。Pan等[5]检测了自由进食糖基肌氨酸并保持12 h︰12 h光暗周期的大鼠小肠中PEPT1的每日节律,发现PEPT1的蛋白质水平和mRNA水平在20:00时最高,在08:00时最低。但是,Saito等[55]发现,决定Pept1表达的转录因子SP1和CDX2在24 h内没有表达变化;此外,调节Pept1的另一种转录因子过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)的缺乏虽然会降低Pept1的基础表达水平,但对其每日表达没有显著影响[56],这表明它们可能不参与Pept1的昼夜节律调节。Okamura等[56]发现,Dbp(D site of albumin promoter binding protein)的mRNA水平的日常节律与Pept1的mRNA的节律相似。此外,该研究团队确定了Pept1远端启动子区域中的DBP结合位点,并得出结论:DBP可能有助于Pept1表达的节律性变化。另外有研究发现,小鼠胃蛋白酶原的分泌在24 h内呈周期性变化,在休息期间达到高峰[57]。同样,胰液的分泌在大鼠和猪中都有昼夜节律性[58~59]。
2.4 离子吸收代谢的节律性和调节机制
结肠介导的电解质稳态受昼夜节律调节[60]。结肠的主要功能是吸收水和电解质,Na+和Cl-的吸收主要反映了两种转运体的活性,一种是Na+/H+交换器(NHE),另一种是Cl-/HCO3-交换剂(anion exchanger protein,AE)。研究表明,Nhe3和Ae1的表达具有昼夜节律,此外,参与NaCl吸收的其他关键转运蛋白和通道蛋白也受生物钟基因的调控,如大鼠结肠黏膜钠钾ATP酶蛋白A1(Atp1a1)、
上皮钠离子通道蛋白γ(epithelial sodium channel gamma,γEnac)、下调式腺瘤载体(downregulated in adenoma,Dra)的mRNA表达均表现出昼夜节律变化[61]。研究报道,血浆醛固酮和γEnac转录本之间的峰值水平具有相关性[61],这表明醛固酮可能在γEnac的调节中发挥作用。此外,参与NaCl吸收的转运蛋白的表达可能直接受昼夜节律的控制,有研究发现,CLOCK:BMAL1异二聚体调控Nhe3启动子区域内的E-box[54];小鼠中Cry1和Cry2的双重敲除或Clock的突变均会使Nhe3的mRNA表达降低[54]。总而言之,生物钟参与肠道NaCl吸收,对肠道运输具有重要作用。
3 小结与展望
营养素的吸收代谢与昼夜节律联系密切,昼夜节律可调控消化道多种营养素的吸收及其相关转运蛋白的表达(图1)。从目前研究结果来看,生物钟与消化道营养代谢的互作调控机制没有形成网络联系,主要体现在以下几个方面:1)影响机体生物钟节律的营养水平、营养代谢产物及参与营养吸收代谢的酶还需进行探索;2)节律基因调控营养物质吸收代谢相关因子的位点鉴定尚不能确定;3)生物钟基因在转录、翻译等不同水平上对消化道的调控机制还不清楚;4)不同动物上的研究尚不系统。因此,未来应从以上几个方向着手进行深入研究,以了解更多营养物质吸收代谢过程中昼夜节律调节的分子机制。
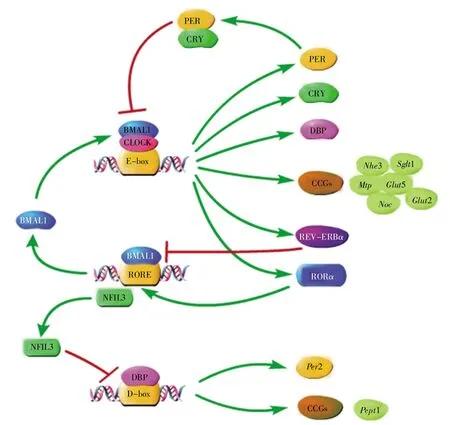
图1 调节营养物质代谢的生物钟机制CLOCK:BMAL1异二聚体与启动子中的E-box元件结合激活Per和Cry基因的转录。PER蛋白和CRY蛋白形成复合物并抑制CLOCK:BMAL1异二聚体的活性,从而抑制其自身表达。CLOCK:BMAL1异二聚体也激活核受体REV-ERBα(reverse erythroblastosis virus α)和视黄素受体相关的孤儿受体 α (retinoid-related orphan nuclear receptor α,RORα)的转录,这些转录因子竞争性地结合Bmal1和核因子白细胞介素3(nuclear factor interleukin 3,Nfil3)启动子中的RORE反应元件(RORE激活BMAL1和NFIL3的表达,而REV-ERBα抑制BMAL1和NFIL3的表达)。NFIL3和DBP共同调节D-box启动元件(NFIL3负向调节,DBP正向调节),这两种因子协同D-box调控Per2基因的表达,也调节时钟控制基因(clock-controlled genes,CCGs),使CCGs的表达具有昼夜节律。此外,CLOCK:BMAL1异二聚体还调节参与营养物质代谢的CCGs的昼夜节律表达。例如:BMAL1与己糖转运蛋白编码基因Sglt1、Glut2和Glut5的启动子结合,参与糖代谢;CLOCK:BMAL1异二聚体有节奏地激活SHP,从而使SHP抑制Mtp的表达,参与脂代谢;CLOCK:BMAL1异二聚体与Noc转录起始位点上游的E-box结合,参与脂代谢;CLOCK:BMAL1异二聚体反式激活Nhe3启动子中的E-box序列,调节机体蛋白质代谢。Fig.1 The biological clock in nutrient metabolism regulationCLOCK:BMAL1 heterodimer combines with the E-box element in the promoter to activate the transcription of Per and Cry genes.PER and CRY proteins form complexes and inhibit the activity of the CLOCK:BMAL1 heterodimer,thus inhibiting its own expression.CLOCK:BMAL1 heterodimer also activate transcription of the reverse erythroblastosis virus α (REV-ERBα)and retinoid-related orphan nuclear receptor α (RORα),which competitively bind the RORE response elements in the promoters of Bmal1 and nuclear factor interleukin 3(Nfil3).RORE activates the expression of BMAL1 and NFIL3,while REV-ERBα inhibits their expression.NFIL3 and DBP adjust the D-box element(NFIL3 negative adjustment,DBP positive adjustment).These two factors cooperate with D-box to regulate the expression of Per2 gene,and also regulate clock-controlled genes(CCGs),so that CCGs have the circadian rhythm of expression.Furthermore,CLOCK:BMAL1 heterodimer also regulates the expression of circadian rhythm of CCGs involved in nutrient metabolism.Here are some examples:BMAL1 binds to the promoters of Sglt1,Glut2,and Glut5,participating in glucose metabolism;CLOCK:BMAL1 heterodimer activates SHP rhythmically,making SHP inhibit Mtp expression and participating in lipid metabolism;the heterodimer binds to the upstream E-box of Noc transcription start site,participating in lipid metabolism;the heterodimer transactivates the E-box sequence in the Nhe3 promoter,regulating protein metabolism.