组蛋白H3K27me3介导JAK2/STAT3信号通路对足细胞损伤的调控机制*
2021-09-08袁树珍隋晓露顾凤娟张艾莎许云鹏谢婷妃曾启城邹杰锋陈继红
袁树珍 隋晓露 顾凤娟 张艾莎 许云鹏 谢婷妃 曾启城 邹杰锋 陈继红
广东医科大学深圳宝安临床医学院,广东省深圳市 518100
足细胞损伤是肾小球疾病发生发展的重要机制。表观遗传修饰参与足细胞损伤的过程,组蛋白甲基化水平变化导致炎性反应基因转录过程及多个相关信号通路活化异常,破坏足细胞正常结构及其功能,导致足细胞凋亡[1]。组蛋白甲基化转移酶同源序列增强子2(Enhancer of zeste homolog 2,EZH2)催化组蛋白H3K27发生三甲基化,EPZ-6438是EZH2的抑制剂,降低组蛋白H3K27me3水平,抑制炎性基因和超氧化物歧化酶表达,减轻炎性反应和延缓肾小球疾病的进展[2]。JAK2/STAT3信号通路是细胞内参与凋亡及炎症信号转导的重要通路,能被多种代谢产物激活,引起炎症因子表达增多,促进足细胞凋亡,在多种肾脏疾病中发挥重要作用[3]。JAK2/STAT3信号通路活化可促进EZH2的表达,并且STAT3与EZH2的启动子区相互结合,参与肿瘤细胞增殖等生理过程。本研究选用小鼠肾足细胞MPC5,给予EPZ-6438干预处理,观察足细胞组蛋白H3K27me3及JAK2/STAT3信号通路水平变化,探讨组蛋白H3K27me3介导JAK2/STAT3信号通路对足细胞损伤的调控机制。
1 材料与方法
1.1 细胞与试剂 小鼠肾足细胞MPC5,购自深圳市拓普生物科技公司。DMEM培养基,EZH2抑制剂(EPZ-6438),RNA反转录试剂盒(购自ThermoFisher公司),BCA蛋白浓度测定试剂盒,RIPA裂解液。
1.2 细胞培养及分组 小鼠肾足细胞MPC5用10%胎牛血清(FBS)、1%青链霉素混合液DMEM培养基培养,放置37℃、5%CO2培养箱,当足细胞密度达到90%以上时收集细胞。PBS润洗,加入1ml 0.25%胰酶消化处理,按1/3比例传代,传2个10cm2平皿放置37℃、5%CO2培养箱过夜。随机分对照组及EZH2-组。EZH2-组给予EPZ-6438 10μm 培养48h。对照组给予等量PBS培养48h。
1.3 Western Blot法检测足细胞组蛋白H3K27me3 收集细胞,加RIPA裂解液裂解30min,离心取上清液。BCA蛋白浓度测定试剂盒检测总蛋白量,调整蛋白浓度为6μg/μl,上样电泳,电压80V跑胶25min,160V跑胶50min。取出蛋白凝胶进行转膜(200mA,2h)。脱脂牛奶封闭后加入H3K27me3抗体(1∶1 000)4℃孵育过夜,TBST缓冲液洗膜,采用Image J软件分析靶蛋白带的灰度水平。
1.4 qPCR 法检测足细胞JAK2、STAT3mRNA 收集细胞,用Buffer RZ提取足细胞总RNA,参照RNA反转录试剂盒(购自ThermoFisher公司)说明书合成cDNA。应用实时荧光定量PCR仪进行PCR扩增, 引物序列见表1,实时定量PCR反应条件为:95℃预变性15min,95℃变性10s、60℃退火延伸30s、72℃延伸30s共45个循环。以β-actin为内参照,采用2-ΔΔCT法进行定量分析,实验重复3次,取平均值。

表1 JAK2、STAT3的引物序列
1.5 Western Blot法检测足细胞p-JAK2、JAK2、p-STAT3、STAT3蛋白 收集细胞,加RIPA裂解液裂解30min,离心取上清液。BCA蛋白浓度测定试剂盒检测总蛋白量,调整蛋白浓度为6μg/μl,上样电泳,电压80V跑胶25min,160V跑胶50min。取出蛋白凝胶进行转膜(200mA,2h)。脱脂牛奶封闭后加入一抗(p-JAK2、JAK2、p-STAT3、STAT3、内参抗体,1∶1 000)4℃孵育过夜,TBST缓冲液洗膜。加入二抗(1∶10 000)室温2h后进行显色,采用Image J软件分析靶蛋白带的灰度水平。
1.6 ChIP-chip技术检测组蛋白H3K27me3靶基因及富集分析 (1)文库构建:收集两组处于对数生长期的细胞,使用免疫磁珠结合细胞完成分选,使用ChiTag促进H3K27me3抗体与目标蛋白结合。Trizol法提取两组DNA,使用Nanodrop检测DNA的纯度,使用Qubit对DNA进行定量。对目标DNA进行PCR扩增,修复DNA片段及添加测序接头后完成纯化,完成文库构建。(2)文库质检和测序:使用Agilent 2100 对文库的插入片段长度进行检测,排除接头二聚体污染,使用q-PCR 对测序文库浓度进行定量,保证样品纯度,文库质检合格后于Illumina平台测序获取靶基因。(3)组间差异富集峰统计:使用MACS/PePr软件进行组间富集峰Peak数目统计。(4)数据分析:利用MACS2软件对两组样品进行富集分析(阈值设定为P≤0.05),将富集峰与基因结构元件进行基因组位置比较,确定与富集峰有直接关系的基因集进行基因注释。(5)GO富集分析:将富集峰相关基因集通过向GO数据库各Term形成映射,完成Term定位,应用超几何检验得到在生物过程、细胞组成和分子功能方面富集的GO项目上Peak重叠基因的条目和分布情况。(6)KEGG富集分析:将富集峰相关基因集通过KEGG数据库,应用超几何检验得到在差异表达基因中显著性富集的信号通路,并确定信号通路中呈现显著性富集的基因靶点。

2 结果
2.1 足细胞组蛋白H3K27me3水平 EZH2-组足细胞组蛋白H3K27me3蛋白表达水平为0.85±0.12,对照组为1.25±0.08,EZH2-组显著低于对照组,差异有统计学意义(P=0.007<0.05)。见图1。
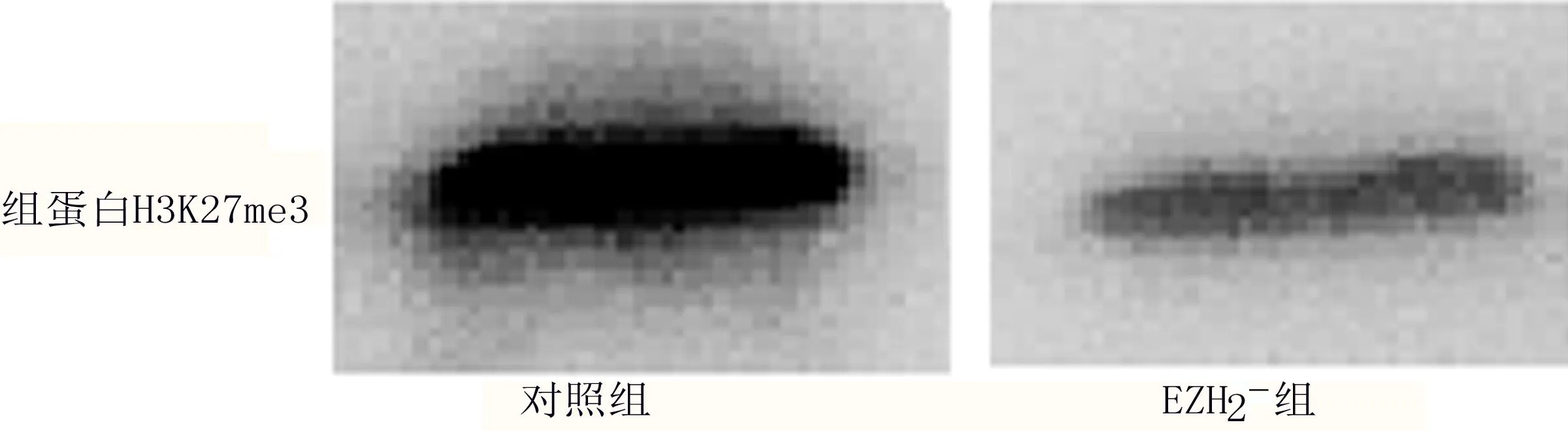
图1 组蛋白H3K27me3蛋白表达Western Blot电泳图
2.2 JAK2/STAT3信号通路目标基因mRNA水平 与对照组相比,EZH2-组足细胞JAK2、STAT3mRNA表达显著增加,差异有统计学意义(P<0.05)。见表2。

表2 两组足细胞JAK2、STAT3 mRNA水平
2.3 JAK2/STAT3信号通路目标蛋白水平 与对照组相比,EZH2-组足细胞JAK2、p-STAT3、STAT3蛋白表达显著增加,差异有统计学意义(P<0.05)。见表3,图2。

表3 两组足细胞p-JAK2、JAK2、p-STAT3、STAT3蛋白水平

图2 JAK2/STAT3信号通路目标蛋白表达Western Blot电泳图
2.4 组间差异富集峰统计 组间差异富集峰Peak数目统计发现EZH2-组有6 919条富集峰,对照组有3 273条富集峰,两组各列举前15条。见表4。

表4 两组间差异富集峰(Peak)统计
2.5 组蛋白H3K27me3调控靶基因GO富集分析 靶基因功能主要集中在生物过程、细胞组成、分子功能方面(P≤0.05)。见表5,图3。其中涉及生物过程中Pigu基因呈现显著性富集,其参与JAK/STAT信号通路调控。见表6。

表6 JAK/STAT信号通路靶基因GO富集分析
2.6 组蛋白H3K27me3调控靶基因KEGG富集分析 靶基因参与调控信号通路主要集中在细胞溶质 DNA 感应途径、Rap1信号通路、Toll 样受体信号通路、HIF-1 信号通路和 JAK/STAT 信号通路。见表7,图4。其中靶基因IL12rb1、IL5ra呈现显著性富集,其参与JAK/STAT 信号通路调控。见表8。

表8 JAK/STAT信号通路靶基因KEGG功能富集分析
3 讨论
足细胞损伤是肾小球疾病发生进行性肾小球硬化和肾纤维化的重要因素,其发病机制包括[4-5]:(1)血流动力学变化使血管紧张素Ⅱ(AngⅡ)水平增加改变足细胞蛋白表达及分布直接损伤足细胞;(2)RAS系统激活可通过促进钙离子内流和活性氧生成导致足细胞损伤;(3)氧化应激反应通过扰乱内质网稳态,激活足细胞内质网应激系统导致足细胞损伤;(4)表观遗传修饰调控基因转录过程导致炎性反应基因及多个相关信号通路活化促进足细胞凋亡等。其中,表观遗传修饰在足细胞损伤机制具有重要作用。
表观遗传修饰是指非基因序列改变所致基因表达水平的变化,包括DNA甲基化、组蛋白甲基化、非编码RNA等。组蛋白甲基化是发生在N端H3和H4氨基酸残基上的甲基化,由组蛋白甲基转移酶催化完成,维持染色质结构和调控基因转录,在足细胞损伤中发挥着重要作用。EZH2是EZH基因编码的组蛋白赖氨酸甲基化转移酶,是多梳抑制复合体2(PRC2)的一个催化亚基,聚集至启动子区域,催化组蛋白 H3K27发生三甲基化抑制靶基因转录及调控下游炎症反应信号通路活化过程[6]。EZH2活性减弱使组蛋白H3K27me3水平下降,对microRNA抑制作用减弱,由microRNA调控的抗氧化剂抑制剂硫氧还蛋白互作蛋白(TxnIP)表达增加,机体产生氧化应激损伤足细胞,提示组蛋白H3K27me3修饰水平变化参与足细胞损伤过程[7]。
足细胞损伤与多条信号通路异常活化相关,如p38MAPK信号通路、TGF-β/Smad信号通路、 NLRP3炎症小体信号通路[8],其中JAK2/STAT3信号通路在足细胞分化、凋亡过程中起重要作用。JAK2是非受体型胞浆酪氨酸蛋白激酶,通过与受体偶联介导细胞因子相关信号的传递。STAT3是DNA结合蛋白,与磷酸化酪氨酸的肽段结合被磷酸化形成二聚体,进入胞核内与靶基因启动子序列的特定位点结合,激活基因转录[9]。体内p-STAT3过表达可上调EZH2活性显著增强组蛋白H3K27me3表达水平,抑制抑癌基因的表达,促进肿瘤浸润转移,提示组蛋白H3K27me3可能通过介导JAK2/STAT3信号通路参与细胞分化、凋亡过程。

图4 组蛋白H3K27me3调控靶基因KEGG分类
本研究结果显示:与对照组相比,EZH2-组足细胞H3K27me3蛋白表达显著下降(P<0.05);JAK2/STAT3信号通路目标基因JAK2、STAT3mRNA 表达显著增加(P<0.05);JAK2/STAT3信号通路目标蛋白JAK2、p-STAT3、STAT3蛋白表达显著增加(P<0.05);组蛋白 H3K27me3 调控靶基因 GO 富集分析发现靶基因功能主要集中在生物过程、细胞组成、分子功能方面,其中涉及生物过程中 Pigu 基因呈现显著性富集,其参与JAK/STAT信号通路调控;组蛋白H3K27me3 调控靶基因 KEGG 富集分析发现靶基因参与调控信号通路主要集中在细胞溶质 DNA 感应途径、Rap1 信号通路、Toll 样受体信号通路、HIF-1 信号通路和 JAK/STAT 信号通路,其中靶基因IL12rb1、IL5ra呈现显著性富集,其参与JAK/STAT 信号通路调控。组蛋白H3K27me3介导 JAK2/STAT3信号通路致足细胞损伤的可能机制如下:(1)p-STAT3属于核转录因子,介导细胞内基因表达过程。EZH2是PRC2中的一个催化亚基,聚集至启动子区域。在各种刺激因素下,足细胞内启动子区域EZH2的核定位能力减弱及其活性下降,细胞内组蛋白H3K27me3水平下降,使其染色体结构处于疏松状态,增强了p-STAT3与基因启动子的结合,对TGF-β基因等促纤维化关联基因转录抑制作用减弱[10], 与肾脏纤维化相关的炎症介质及细胞因子如血小板源生长因子(Platelet-derived growth factor)、IL-1β、IL-18等产生增多,导致足细胞损伤。(2)白细胞介素5受体(IL5ra)基因编码IL5受体的α链,该受体依赖肿瘤坏死因子(TNF-α)激活相关信号通路参与细胞凋亡过程[11]。炎症因子TNF-α与IL5受体结合激活JAK/STAT通路,执行细胞外基质重塑和细胞凋亡。(3) 磷脂酰肌醇多糖锚定生物合成类(Pigu)基因编码糖基磷脂酰肌醇转酰胺酶(GPI-T)复合物的第5亚基,GPI-T主要位于内质网并催化GPI锚定蛋白合成,GPI锚定蛋白是一类由蛋白质、脂质和糖链共价结合的复杂糖复合物,参与信号转导过程。Pigu基因过度表达能上调GPI锚定蛋白水平激活JAK/STAT通路,参与细胞增殖过程[12]。(4) Pigu、IL5ra、TGF等多个基因调控JAK2/STAT3信号通路活化过程[13]。代谢产物与酪氨酸激酶相关受体结合激活JAK2/STAT3信号通路,组蛋白H3K27me3水平下降对靶基因抑制作用减弱,Pigu 、IL5ra、TGF等多个基因转录活性增强促进JAK2酪氨酸磷酸化作用增强,JAK2激活后催化受体酪氨酸残基发生磷酸化修饰与周围的氨基酸序列形成停泊位点(docking site),募集更多含有SH2结构域的STAT3蛋白到这个停泊位点。STAT3蛋白发生磷酸化修饰水平明显增强进入细胞核内与促纤维化等基因结合,上调TGF-β1、α-SMA等蛋白的表达,造成细胞外基质堆积及足细胞损伤[14]。
本细胞实验给予组蛋白甲基化酶抑制剂干预,足细胞组蛋白 H3K27me3 表达下调,JAK2/STAT3信号通路表达增强。经组蛋白 H3K27me3靶基因富集分析提示组蛋白 H3K27me3通过调控靶基因Pigu、IL12rb1、IL5ra参与JAK2/STAT3信号通路活化,导致足细胞损伤。
