河南地区叶酸相关代谢酶基因多态性分析
2021-09-07张珂肖瑞霞修贺明
张珂,肖瑞霞,修贺明
(河南金泰生物技术股份有限公司,河南 郑州 450000)
叶酸参与体内多种生化反应,对维持染色体稳定起着重要作用[1]。叶酸本身无活性,需要5,10-亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)与甲硫氨酸合成酶还原酶(methionine synthase reductase,MTRR)的参与才能发挥活性并维持体内叶酸的正常代谢[2]。MTHFR和MTRR突变后酶活性降低,导致体内同型半胱氨酸水平升高及DNA低甲基化,从而引起多种疾病。叶酸缺乏是新生儿神经缺陷发生的主要病因,育龄妇女适当补充叶酸可有效预防新生儿出生缺陷的发生[3-5]。本研究对河南地区MTHFR和MTRR基因多态性进行分析,为个体化增补叶酸及降低疾病发生率提供遗传学依据。
1 对象与方法
1.1 研究对象根据知情同意的原则,对河南地区受检人群进行遗传检测,排除DNA抽提不符合要求者,共获取有效样本数量344例,其中男173例,女171例。
1.2 DNA采集与基因分型采集受检者的口腔黏膜上皮细胞,利用柱式抽提试剂盒进行DNA抽提,抽提试剂盒采购于上海生工。采用AGENA公司Mass ARRAY®DNA质谱阵列基因分析系统进行MTHFRC677T、A1298C和MTRRA66G基因多态性的检测。通过ASSAY DESIGN SUITE V2.0进行在线引物设计,引物信息见表1。聚合酶链反应(polymerase chain reaction,PCR)反应分为3步(多重PCR反应,SAP反应,iPLEX延伸反应)进行,检测试剂盒为Complete iPLEX®Gold Genotyping Reagent Set 10X96。多重PCR反应:95 °C预变性2 min,45个循环(95 °C 30 s,56 °C 30 s,72 °C 1 min),72 °C延伸5 min。SAP反应:37 °C 40 min,85 °C 5 min,4 °C 2 min。iPLEX反应:94 °C 30 s,40个循环(94 °C 5 s),5个循环(52 °C 5 s,80° C 5 s),72 °C 5 min。反应体系见表2。PCR反应结束后,利用分析软件确定各个样本的基因分型结果。

表1 引物序列信息
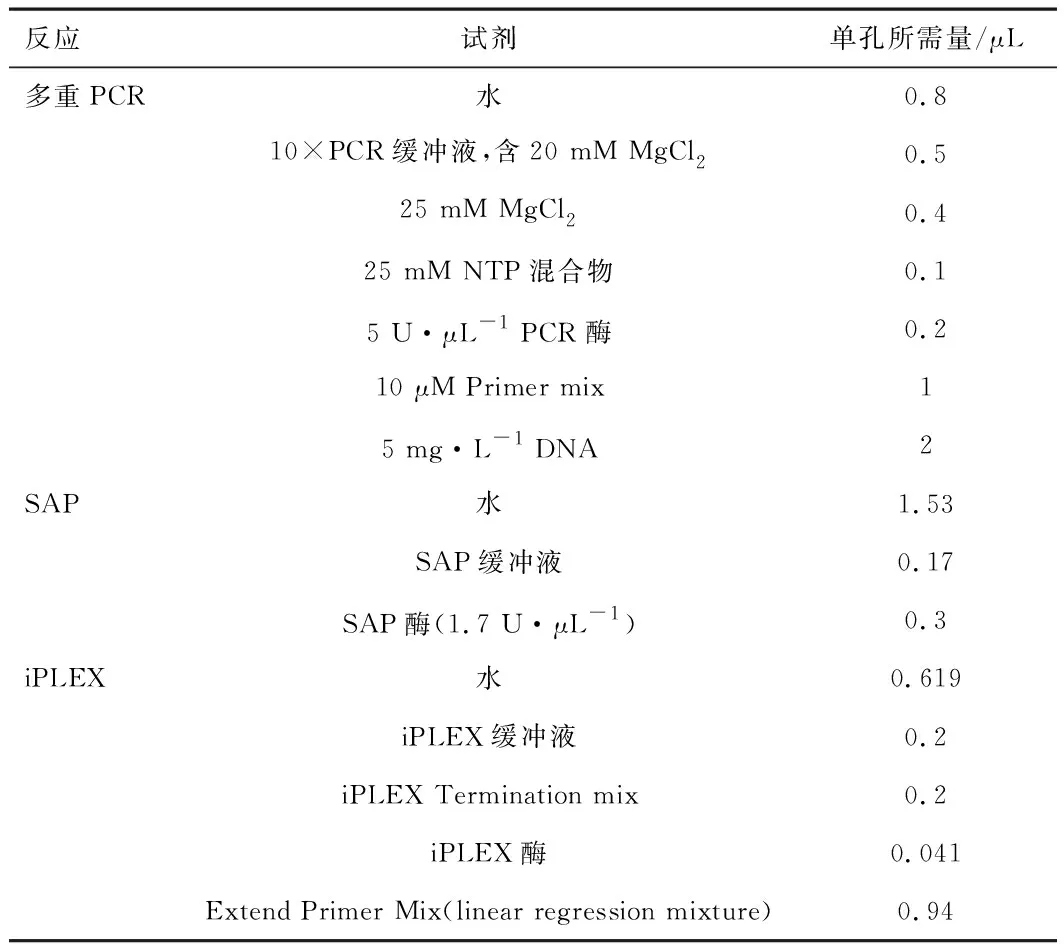
表2 PCR反应条件
1.3 统计学方法对基因分型频数进行Hardy-Weinberg遗传平衡检验,采用SPSS 20.0统计软件进行基因频数和等位基因频率的统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg遗传平衡分析本研究共有受检者344例,其中男173例,女171例。MTHFRC677T位点检出3种基因型:野生型CC、杂合突变型CT、纯合突变型TT;MTHFRA1298C位点检出3种基因型:野生型AA、杂合突变型AC、纯合突变型CC;MTRRA66G位点检出3种基因型:野生型AA、杂合突变型AG、纯合突变型GG。MTHFRC677T、A1298C和MTRRA66G基因位点基因型实际频数与理论频数吻合度良好,Hardy-Weinberg遗传平衡结果证明基因多态性分布符合遗传平衡法则(P>0.05),样本具有区域样本代表性。见表3。
2.2MTHFR和MTRR基因频数和等位基因频率MTHFRC677T基因位点野生型CC 85例(24.71%),杂合突变型CT 162例(47.09%),纯合突变型TT 97例(28.20%),C677T位点C等位基因频率为48.26%,T等位基因频率为51.74%。MTHFRA1298C基因位点野生型AA 242例(70.35%),杂合突变型AC 89例(25.87%),纯合突变型CC 13例(3.78%),A1298C位点A等位基因频率为83.28%,C等位基因频率为16.72%。MTRRA66G基因野生型AA 191例(55.52%),杂合突变型AG 131例(38.08%),纯合突变型GG 22例(6.40%),A66G位点A等位基因频率为74.56%,G等位基因频率为25.44%。男女受检者MTHFRC677T、A1298C和MTRRA66G的基因型频率分布比较,差异无统计学意义(P>0.05)。见表4。
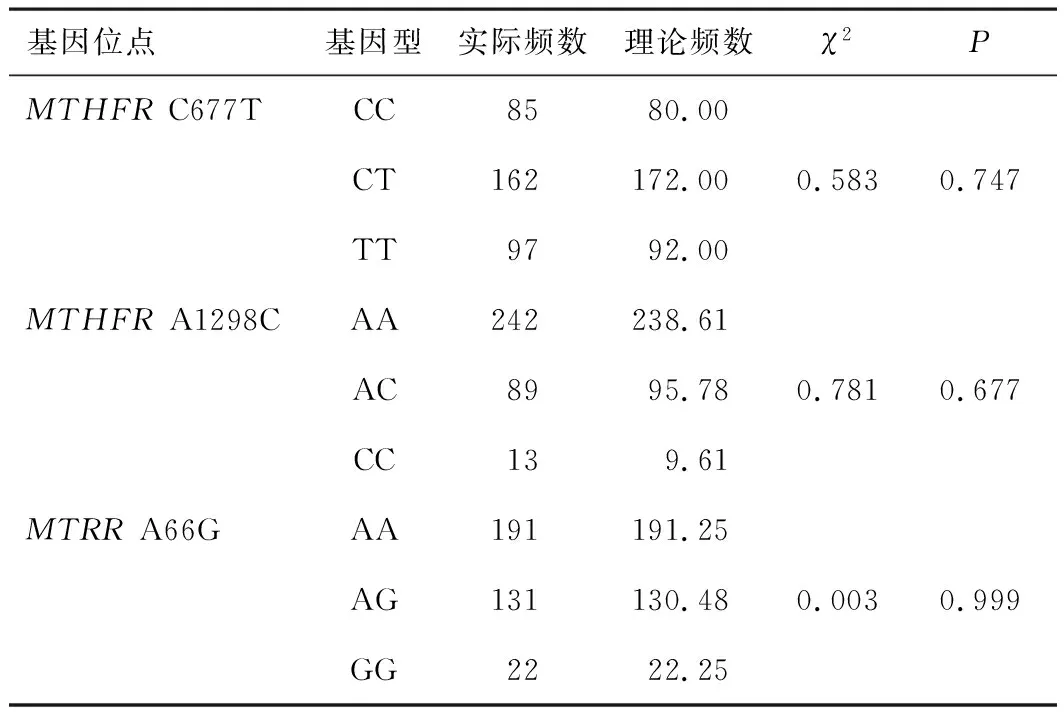
表3 河南地区叶酸代谢MTHFR及MTRR基因位点Hardy-Weinberg遗传平衡检验

表4 MTHFR C677T、A1298C和MTRR A66G位点基因型频率[n(%)]
2.3 河南地区女性MTHFR、MTRR等位基因频数和频率与其他地区的比较
2.3.1MTHFRC677T 河南地区女性MTHFRC677T等位基因和基因型频率分布情况与武汉[6]、琼海[7]比较,差异有统计学意义(χ2=23.136、129.891,P<0.001);其分布情况与尚志[8]、烟台[9]、太原[10]比较,差异无统计学意义(χ2=3.182、3.064、0.802,P=0.204、0.216、0.670)。见表5。
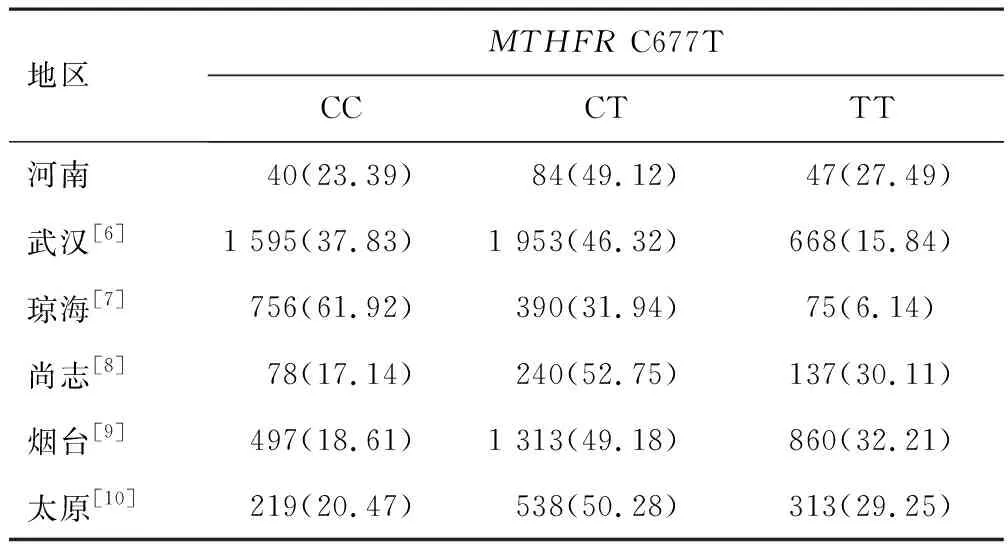
表5 不同地区女性MTHFR C677T基因型频数和频率比较[n(%)]
2.3.2MTHFRA1298C 河南地区女性MTHFRA1298C等位基因和基因型频率分布情况与琼海[7]比较,差异有统计学意义(χ2=11.854,P=0.003);其分布情况与武汉[6]、尚志[8]、烟台[9]、太原[10]比较,差异无统计学意义(χ2=0.970、1.500、2.393、2.379,P=0.616、0.472、0.302、0.304)。见表6。
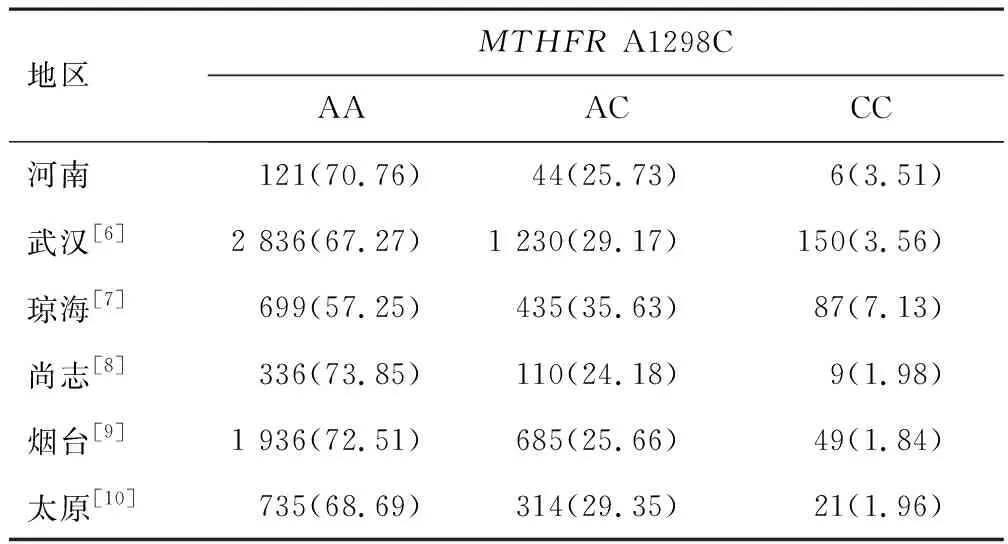
表6 不同地区女性MTHFR A1298C基因型频数和频率比较[n(%)]
2.3.3MTRRA66G 河南地区女性MTRRA66G等位基因和基因型频率分布情况与武汉[6]、琼海[7]、尚志[8]、烟台[9]、太原[10]比较,差异无统计学意义(χ2=0.083、0.705、0.339、5.412、1.665,P=0.959、0.703、0.844、0.067、0.435)。见表7。
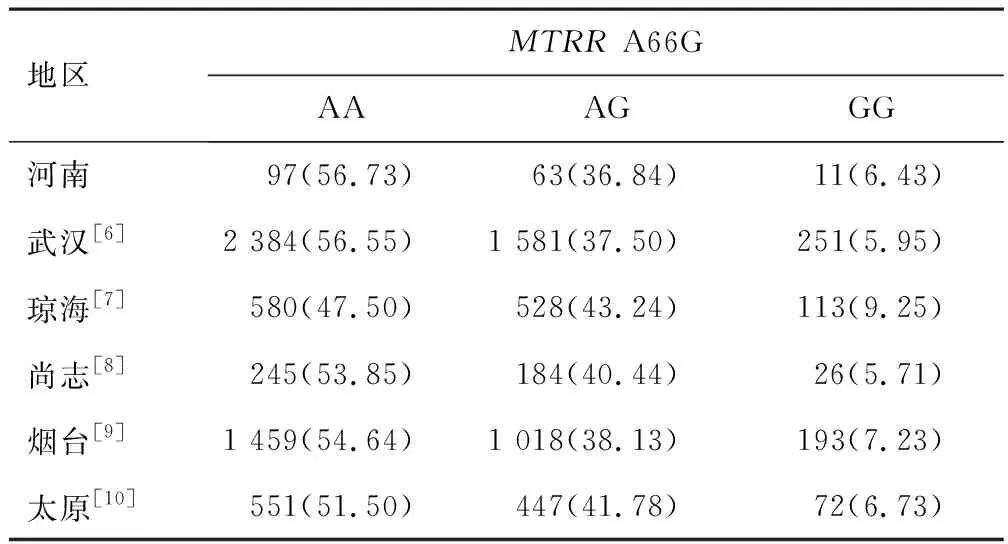
表7 不同地区女性MTRR A66G基因型频数和频率比较[n(%)]
3 讨论
MTHFR、MTRR是叶酸代谢过程中的关键酶。MTHFR基因在叶酸代谢通路中将5,10-亚甲基四氢叶酸转化为具有生物学功能的5-甲基四氢叶酸。MTRR能够通过还原型甲基化作用重新生成具有功能活性的甲硫氨酸合酶。两者使血液中的同型半胱氨酸保持在一个较低的水平。同型半胱氨酸的蓄积可增加各种心血管疾病的发生,损害和干扰心血管生长发育。近年研究也验证了高同型半胱氨酸血症与阿尔茨海默病相关[11-12]。在制定叶酸补充方案时,需要考虑遗传因素,做到个性化补充。
MTHFRC677T基因多态性突变位点位于MTHFR的第4外显子,该突变导致缬氨酸向222密码子丙氨酸转化,这是一种降低酶活性的常见多态性。MTHFR677 CT型酶活性可下降30%~40%,而纯合突变型TT个体酶活性下降60%~70%[13]。本研究结果显示,MTHFRC677T基因位点T等位基因频率为51.74%,CT、TT基因型频率为47.09%、28.20%。这与中国人群中约29%的MTHFR677TT基因型结果保持一致[14-15]。女性MTHFRC677T位点基因型与武汉[6]、琼海[7]不一致。这表明MTHFRC677T多态性分布具有明显的地域特征。
A1298C是MTHFR基因的另一个主要变异位点,其突变使氨基酸序列中的谷氨酸被丙氨酸代替,导致MTHFR酶活性降低。MTHFRC677T、A1298C两处的突变存在协同作用,双突变后酶活性仅为野生型的15%左右[6,16]。本研究结果显示,河南人群中1298AC基因型频率25.87%,纯合突变型CC 3.78%,1298CC基因型频率3.78%,C等位基因频率为16.72%。但研究发现单一MTHFRA1298C基因突变位点与新生儿神经管畸形、新生儿先天性心脏病、高同型半胱氨酸血症等发生并无明显相关性[17-19]。MTRRA66G突变可导致第22位的氨基酸发生变化,原有的异亮氨酸被甲硫氨酸取代,酶活性降低,增加神经管畸形等出生缺陷的发病风险。
本研究中,河南地区MTHFR和MTRR基因多态性分布不受性别影响,且多数人群存在叶酸代谢障碍、叶酸利用能力不足等情况。对于一般人群,补充叶酸的有效且安全剂量为每日0.4~1.0 mg[11,20-21]。建议无高危因素的育龄妇女每日增补叶酸0.4 mg或0.8 mg,直至妊娠满3个月。MTHFR677位点TT基因型妇女可根据个体情况酌情增加叶酸补充剂量或延长孕前增补时间。推荐合并高同型半胱氨酸血症的心血管疾病高危人群和高血压患者每日服用0.8 mg叶酸或联合服用维生素B12以达到最佳的降低同型半胱氨酸水平的效果。需注意长期大剂量补充叶酸(包括叶酸强化食物)有可能产生健康风险,如增加某些癌症(结直肠癌和前列腺癌等)风险,掩盖维生素B12缺乏的早期表现,加重神经系统退行性病变,与其他药物相互干扰影响锌吸收或降低叶酸吸收率,降低免疫力,增加妇女妊娠高血压和妊娠糖尿病的风险等[21-24]。
综上所述,针对叶酸代谢障碍、育龄妇女等特殊人群,开展基因检测了解相关基因的多态性并评估叶酸代谢能力对帮助临床医生制定个体化叶酸补充方案有重要意义。
