急性孤立性脑桥梗死早期神经功能恶化的影响因素
2021-09-07杨波高远王运超李玉生
杨波,高远,王运超,李玉生
(郑州大学第一附属医院 神经内科,河南 郑州 450052)
约80.0%的脑卒中为缺血性卒中,脑桥梗死约占缺血性卒中的7%,而单纯性脑桥梗死约占后循环梗死的15.0%,早期神经功能恶化(early neurological deterioration,END)在急性期脑桥梗死患者中较常见,发生率为10%~60%,疾病的进展直接影响预后[1]。上世纪70年代,Fisher等[2]对脑桥梗死进行了病理学研究,发现部分脑桥梗死是由基底动脉穿支动脉硬化引起的。1989年,Caplan[3]提出了穿支动脉粥样硬化疾病的定义[3]。Yamamoto等[4]研究发现,脑桥梗死卒中亚型中基底动脉分支病变(basilar artery branch disease,BABD)较易发生END。位于脑桥下部的缺血性病变与位于脑桥上部和中部的病变相比,有进行性加重的趋势[5-6]。但Nakase等[7]认为神经功能缺损情况与缺血性病变的位置无关。本研究通过收集急性孤立性脑桥梗死患者的临床资料,探讨预测END的因素。
1 资料和方法
1.1 研究对象回顾性收集2018年1月至2020年10月于郑州大学第一附属医院神经内科就诊的352例急性孤立性脑桥梗死患者的临床资料。本研究获得了郑州大学第一附属医院医学伦理委员会批准。患者家属均签署知情同意书。
1.2 选取标准(1)纳入标准:①发病48 h内入院,经头颅磁共振弥散加权成像(diffusion-weighted image,DWI)发现新发的脑桥梗死病灶;②年龄≥18岁;③完成头颅磁共振T1、T2、快速液体衰减反转恢复序列(fluid-attenuated inversion recover,FLAIR)、DWI等;④完成磁共振血管成像(magnetic resonance angiography,MRA)、计算机断层扫描血管造影(computer tomography angiography,CTA)或数字减影血管成像(digital subtracted angiography,DSA)等血管检查中的任意一项。(2)排除标准:①DWI上显示脑桥合并其他部位的新发梗死病灶;②DWI显示同时累及上、中、下部脑桥梗死;③脑桥肿瘤、炎症及脱髓鞘性病变;④其他疾病导致病情加重,如感染、低血压、过度脱水或严重的心、肺、肾等疾病;⑤发病后无法界定首次出现症状的时间或不配合的患者。
1.3 收集资料记录患者的临床资料,包括性别、年龄、既往史(糖尿病、高血压、脑梗死或短暂性脑缺血发作)、吸烟、饮酒,入院时血压、心电图、实验室检查、影像学检查等。由2名高年资神经内科医生使用美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)来独立评估患者入院时及入院后1周内每日的神经功能缺损严重程度。记录患者发病后是否合并END,从而将患者分为进展组(合并END)与非进展组(未合并END)。END的定义为入院后3 d内神经功能缺损进行性恶化,NIHSS评分较基线时增加≥1分或总得分≥2分。实验室检查包括空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(hemoglobin A1c,HbA1c)、尿酸(uric acid,UA)、同型半胱氨酸(homocysteine,Hcy)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、C反应蛋白(C reactive protein,CRP)、红细胞体积分布宽度(red blood cell volume distribution width,RDW)。
1.4 影像学检查本研究中患者均完成了3.0 T MRI,磁共振相关参数如下。DWI:重复时间6 000 ms,设定回波时间为最小值,矩阵值为160×160,b值为0和1 000 s·mm-2,层距为1.5 mm,层厚为5 mm,轴位共21层,视野为240 mm。使用重复时间比率8 400/155 ms、反转时间2 100 ms、矩阵256×256的快速自旋回波序列得到液体衰减反转恢复图像。MRA参数:反转角为20°,矩阵值为320×224,视野为220 mm。Willis环的3D时间飞跃法MRA序列的参数是回波时间25 ms和回波时间2 ms。基于形态学的病因分类方法将脑桥梗死分为3种亚型[8-9]:(1)大动脉闭塞性疾病(large artery occlusive,LAOD),即任何部位的脑桥梗死合并椎基底动脉狭窄≥50%;(2)BABD,即梗死灶到达脑桥的基底表面,并且不伴有大动脉狭窄(椎基底动脉狭窄<50%);(3)小动脉病(small artery disease,SAD),即脑桥梗死灶的直径<15 mm,病灶未及脑桥的基底表面,并且不伴有大动脉狭窄(椎基底动脉狭窄<50%)。按纵轴位上的部位将脑桥进行3等分[8]:(1)上部为形状相对较圆的导水管;(2)中部为具有方形的第四脑室和大的小脑中脚,三叉神经通过沟内穿出;(3)下部的形状类似于中部,面神经和听神经通过沟内穿出,而不是三叉神经。依据新发脑桥梗死在DWI上的影像学表现,分为上部、中部、下部3个部位。若两个相邻的部位同时受累,取主要受累部位。
1.5 统计学方法采用SPSS 23.0统计软件处理数据。计数资料以频数和率(%)表示,组间比较采用χ2检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;采用logistic回归分析急性孤立性脑桥梗死发生END的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 分组情况按是否发生END将352例急性孤立性脑桥梗死患者分为进展组(97例,27.6%)和非进展组(255例,72.4%)。进展组患者均复查头颅MRI未见出血转化。BABD占急性孤立性脑桥梗死的58.0%(204/352)。
2.2 临床资料进展组CRP和入院时收缩压高于非进展组(P<0.05);两组性别、年龄、高血压、糖尿病、冠心病、卒中史、吸烟、饮酒、高脂血症、RDW、D-二聚体、TG、TC、HDL、LDL、UA、HbA1c、Hcy、FBG、NIHSS评分、舒张压及治疗方法比较,差异无统计学意义(P>0.05)。见表1。
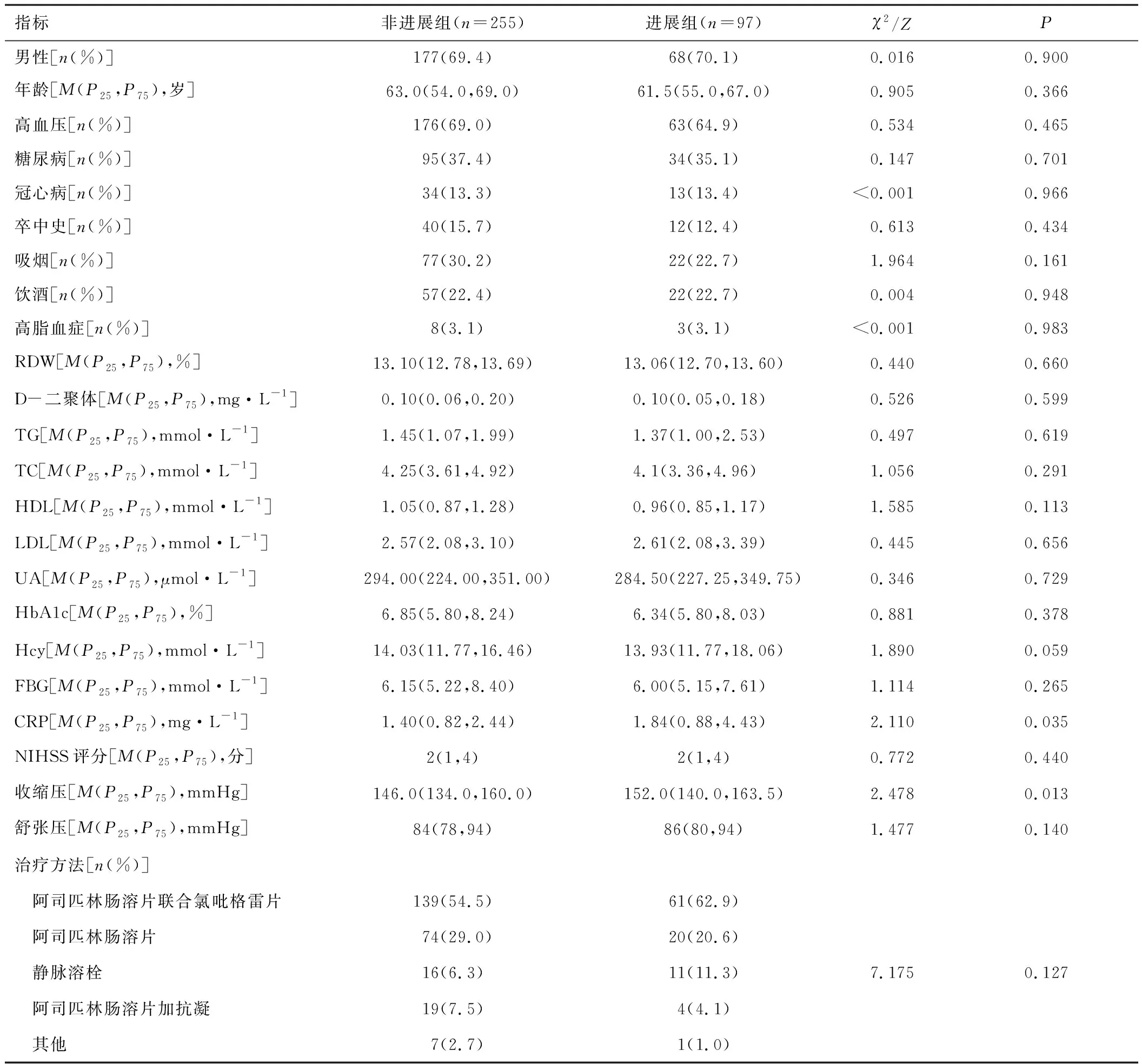
表1 进展组和非进展组临床资料比较
2.3 卒中亚型进展组与非进展组卒中亚型比较,差异有统计学意义(P<0.05);进展组LAOD、BABD占比高于非进展组(P<0.05)。见表2。
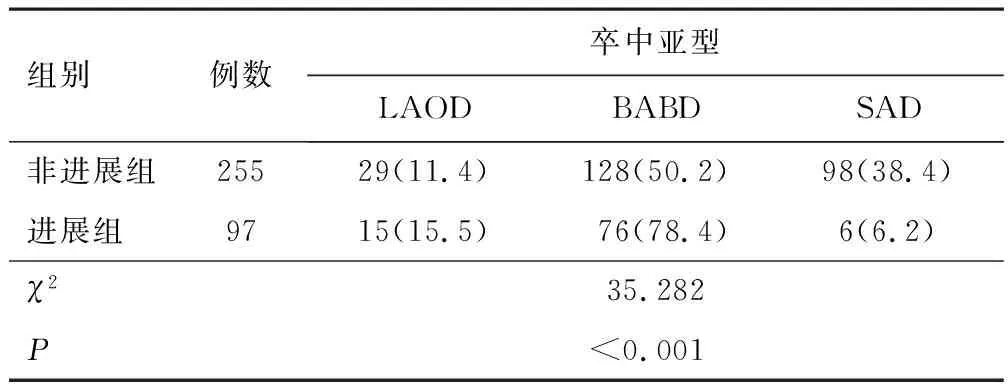
表2 进展组与非进展组卒中亚型比较[n(%)]
2.4 脑桥纵轴位上梗死部位进展组与非进展组梗死部位比较,差异有统计学意义(P<0.05)。见表3。
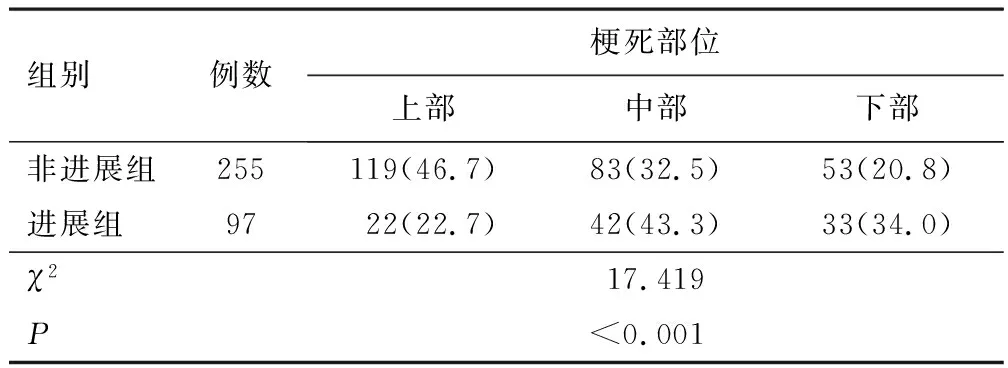
表3 进展组与非进展组脑桥梗死纵轴位上梗死部位比较[n(%)]
2.5 急性孤立性脑桥梗死发生END的影响因素将单因素分析中差异有统计学意义(P<0.05)的CRP、收缩压、卒中亚型(LAOD=1;BABD=2;SAD=3)、形态学部位(上部=1;中部=2;下部=3)纳入logistic回归分析方程,因变量为是否发生END(未发生END=0;发生END=1)。按照逐步前进法纳入自变量进行分析后结果显示,卒中亚型、形态学部位、收缩压均为急性孤立性脑桥梗死发生END的影响因素(P<0.05)。与SAD相比,LAOD和BABD发生END的风险更高,且BABD发生END的风险高于LAOD;与上部梗死相比,中下部梗死更容易发生END,且下部梗死发生END的风险高于中部;收缩压高的患者容易发生END。见表4。

表4 急性孤立性脑桥梗死发生END的多因素logistic回归分析
3 讨论
孤立性脑桥梗死表现为局灶性神经功能缺损,与脑桥上孤立的缺血性梗死灶密切相关,且不合并脑桥以外任何部位的梗死[8]。本研究共纳入352例患者,其中进展组患者占27.6%,与既往研究中END发生率为19%~50%一致[6,8,10]。
由于局部解剖及供血动脉的关系,孤立性脑桥梗死多发于脑桥基底部[11]。END多在发病后72 h内出现,且在急性孤立性脑桥梗死患者中较常见,主要的机制为严重的大动脉狭窄、原位血栓蔓延、侧支循环障碍、继发性水肿等[12]。END也可在发病72 h后至 1周内发生,多由系统性因素引起,主要机制为消化道出血、发热等[13]。
有研究表明CRP是急性缺血性卒中发生END的预测指标[14-15]。Li等[12]研究表明,CRP水平与卒中进展无关。本研究中单因素分析结果与既往研究结果[14-15]一致,但多因素回归分析并未显示CRP升高是急性孤立性脑桥梗死发生END的危险因素。原因可能为CRP受患者基础疾病和并发症的影响较大,并且特异性不高。
Yamamoto等[16]研究结果表明,收缩压升高是进展型大动脉粥样硬化性脑梗死患者的一项独立危险因素。Duan等[17]研究表明,血压水平的变异性与脑梗死急性期END的发生有关。本研究发现,两组患者入院时收缩压水平有差异,原因可能为进展组患者血管自动调节能力下降,收缩压过高易致脑血液灌注过多,从而加重脑水肿或者导致继发性颅内出血。排除静脉溶栓的影响,进展组和非进展组的治疗方案无明显差异。赵昊[13]研究发现,基底动脉狭窄或闭塞与脑桥梗死后进展性运动功能缺损的发生有显著相关性,很可能为预测进展性运动功能缺损的重要因素,但目前针对两者的关系仍存在很多争议。本研究结果显示,椎基底动脉狭窄或闭塞与急性孤立性脑桥梗死发生END有一定的关系。
BABD是急性孤立性脑桥梗死的最常见原因,约占40%[11]。在本研究中,BABD的占比为58.0%。Caplan[3]提出了穿支动脉粥样硬化疾病的病理机制如下:(1)穿支动脉起始部的微动脉硬化;(2)载体动脉的动脉粥样硬化软斑块蔓延至穿支动脉的开口处;(3)载体动脉的动脉硬化斑块导致穿支动脉开口处狭窄或闭塞。BABD是一种穿支动脉粥样硬化疾病。本研究发现,BABD是急性孤立性脑桥梗死发生END的独立预测因素,与既往其他研究结果[4,6]一致。目前认为BABD引发END的机制为:动脉粥样硬化病变的血栓增加,较大直径的穿支动脉开口处的动脉粥样硬化病变引起低灌注和相邻分支动脉同时受累[18]。
本研究发现下部脑桥梗死更易出现END。这与既往研究结果[5-6]一致。脑桥下部的锥体束分布相对紧凑,脑桥上部皮质脊髓束和皮质脑桥束分布相对较松散,其间还有大量的其他非锥体束穿行[5]。因此,下部脑桥梗死尤其是旁正中动脉供血区域梗死更易累及锥体束,继而导致END。磁共振弥散张量成像和扩散张量纤维束成像显示下部脑桥梗死的锥体束损伤更为严重[5]。需要大样本量的病例进一步研究梗死部位与END的关系。
本研究仍有很多不足:(1)本研究为中等样本量的单中心回顾性研究,有可能存在选择性偏倚,还需要大样本量的前瞻性研究以进一步证实研究结果;(2)主要利用MRA、CTA评估入组患者的脑血管情况,高分辨率磁共振和DSA这类更加精准的检查方式的使用相对较少,可能会错估血管情况。
综上所述,LAOD或BABD、脑桥中下部梗死、收缩压高为急性孤立性脑桥梗死发生END的预测因素。
