成人急性髓系白血病巩固化疗后骨髓抑制情况及其安全性分析
2021-09-07董光苹刘占云
董光苹,郝 杰,刘占云,胡 琦
(1.上海市北站医院血液科,上海 200070;2.上海市中医医院血液病科,上海 200071)
急性髓性白血病(acute myeloid leukemia,AML)是常见的恶性程度极高的血液肿瘤,在成人罹患的白血病中AML 约占80%[1,2]。目前成人AML的治疗主要采用联合序贯化疗,即获得初始诱导治疗缓解后开始进行缓解后的巩固治疗[3]。首次缓解后未接受进一步的巩固治疗,通常6~9 个月内疾病复发。因此,成人急性髓性白血病患者在初步诱导治疗缓解后进行有效的巩固治疗对延长生存期具有十分重要的意义[4]。对于AML 患者,一旦诱导化疗后患者骨髓达完全缓解(CR)、外周血象恢复,应尽快开始巩固治疗,早期巩固化疗时间在初发诱导治疗缓解后6 个月内[5-7]。巩固治疗其在发挥疗效的同时产生药物不良反应[8]。化疗所致的骨髓抑制及心肝肾功能损伤是最常见的药物不良反应。本研究选取56 例急性髓性白血病患者,分别给予IA 及中剂量阿糖胞苷方案进行巩固治疗,主要对成人急性白血病患者化疗后骨髓抑制期外周血象变化规律进行总结,以便于指导临床治疗。
1 资料与方法
1.1 一般资料 回顾性分析2019 年10 月-2020 年6月上海市北站医院收治的成人急性髓系白血病巩固治疗患者56 例,其中第1、4 次巩固治疗的患者采用IA 方案,第2、3、5、6 次巩固的患者采用中剂量Ara-c 方案巩固治疗。IA 巩固治疗组共26 例,男14 例,女12 例,年龄26~60 岁,平均年龄(46.65±9.79)岁;中剂量Ara-c 巩固治疗组共30 例,其中男19 例,女11 例,年龄18~60 岁,平均年龄(43.00±13.99)岁;两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准 纳入标准:①骨穿证实为急性髓系白血病;②年龄18~60 岁;③均为初治、原发患者诱导治疗缓解后;④其他脏器未出现严重器质性病变;⑤评估生存期>3 个月。排除标准:①存在化疗禁忌证、依从性差、严重精神疾患者;②心肝肾功能存在严重器质性病变者;③合并血液系统、免疫系统等严重病变者;④化疗前患者外周血常规WBC 低于正常值者;⑤生命质量评分不足60 分。
1.3 方法 两组患者巩固化疗过程中,辅以碱化、水化及止吐等治疗措施,在化疗后骨髓抑制期,必要时使用粒细胞集落刺激因子(G-CSF)增加粒细胞及抗生素预防或抗感染治疗;必要时予以输注单采血小板等血制品进行对症支持治疗,同时密切监测患者的外周血象、心肝肾功能及电解质等指标的变化。①IA 巩固治疗组:注射用盐酸伊达比星(Pharmacia Italia S.p.A,JX20000015,10 mg/支)10 mg/m2,化疗第1 天起连用2 d+Ara-c 100 mg/m2化疗第1 天起连用5 d。②中剂量Ara-c 巩固治疗组:注射用阿糖胞苷(Pharmacia Italia S.p.A,JX20040073,0.1 g/支)2.0 g/m2,化疗第1 天20∶00 起每12 h 1 次,连用6 次。
1.4 评价标准
1.4.1 外周血象变化 比较两组患者化疗后外周血象(白细胞、血小板)变化及骨髓抑制情况。化疗结束后予每日抽取肘静脉外周血,用血细胞分析仪进行外周血细胞分析,检测至WBC>1.0×109/L,中性粒细胞>0.5×109/L,PLT>20×109/L 时出院。
1.4.2 骨髓抑制情况 根据患者血红蛋白、白细胞及血小板计数将患者骨髓抑制分为0~Ⅳ度。
1.4.3 不良反应 记录两组感染、心肝肾功能损害及电解质紊乱等不良反应发生情况。
1.5 统计学处理 采用SPSS 21.0 统计软件进行数据分析,计量资料符合正态分布及方差齐时,采用()表示,行t检验;非正态分布的计量资料用[M(min,max)]表示,采用秩和检验;计数资料采用(%)表示,行χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组外周血象变化情况比较 d10~12 中剂量Ara-c 巩固治疗组外周血白细胞数量低于IA 巩固治疗组,d18~20 中剂量Ara-c 巩固治疗组外周血白细胞数量高于IA 巩固治疗组,差异均有统计学意义(P<0.05);d13~17、d21~出院两组外周血白细胞比较,差异无统计学意义(P>0.05);d11~12 中剂量Ara-c 巩固治疗组外周血血小板数量低于IA 巩固治疗组,d22~23 中剂量Ara-c 巩固治疗组外周血血小板数量高于IA 巩固治疗组,差异均有统计学意义(P<0.05);d13~21、d24~出院两组外周血血小板数量比较,差异无统计学意义(P>0.05),见表1。
表1 两组外周血象变化情况比较[,M(min,max)]
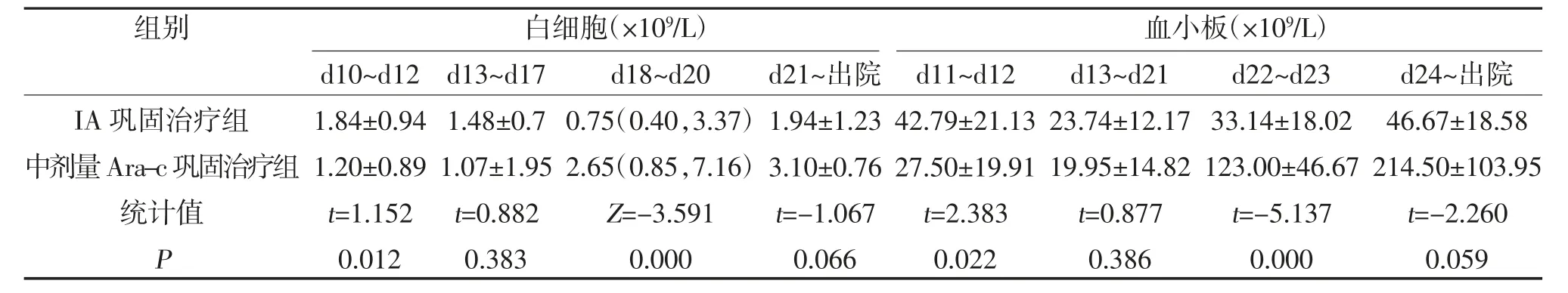
表1 两组外周血象变化情况比较[,M(min,max)]
2.2 两组骨髓抑制情况比较 两组骨髓抑制比例比较,差异无统计学意义(P>0.05),见表2。
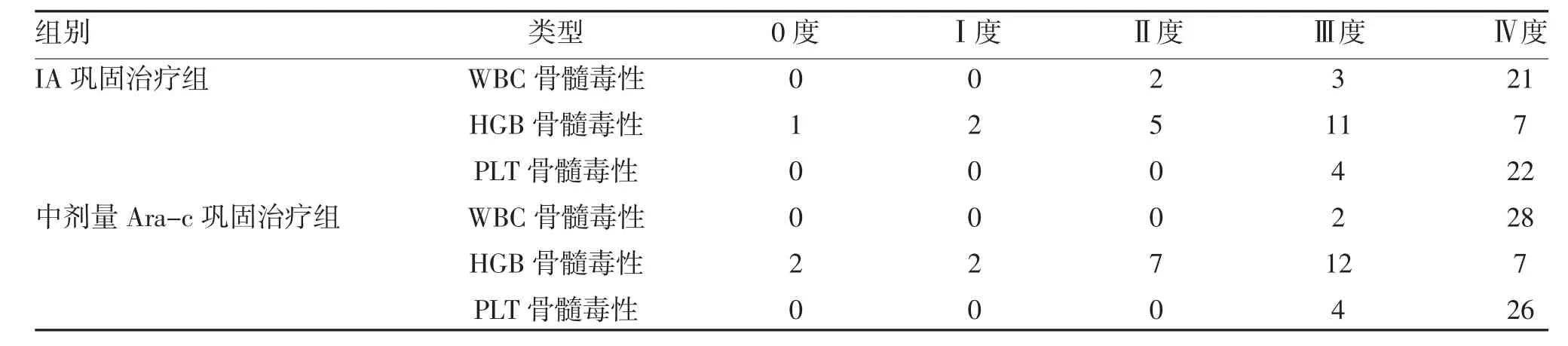
表2 两组骨髓抑制情况比较(n)
2.3 两组不良反应比较 两组感染、心肝肾功能损害、电解质紊乱发生率比较,差异无统计学意义(P>0.05),见表3。

表3 两组不良反应比较[n(%)]
3 讨论
目前成人AML 巩固治疗方案主要以蒽环类药物和阿糖胞苷为基础,常用的有伊达比星(IDA)联合Ara-C 组成的IA 及中剂量Ara-c 巩固方案。两种方案可交替使用原因与其疗效及其耐药性有关。阿糖胞苷主要作用于S 期,是嘧啶类抗代谢药物,既可以抑制细胞内DNA 多聚酶活性,阻止DNA 链的合成,又可被整合入DNA 链终止DNA 链的合成,从而产生抗白血病作用[9,10]。考虑单药阿糖胞苷治疗AML 发生耐药而出现复发[11]。肿瘤细胞的耐药性是因为P-糖蛋白过度表达形成ATP 依赖性膜泵样结构,可使药物从细胞内转运至细胞外所致。增加药物的脂溶性促使药物进入细胞内,提高细胞内药物浓度,从而克服肿瘤细胞的耐药性,拮抗P-糖蛋白介导的药物外排[11]。伊达比星是蒽环类药物之一,与DNA 以非可逆性的方式结合,抑制DNA的复制及合成[11],其脂溶性强,从而促进肿瘤细胞摄取。目前对于最佳缓解后巩固治疗方案的选择仍没有定论,患者诱导缓解治疗达到完全缓解后,应立即应用Ara-c 联合其他药物进行序贯化疗,提高持续缓解率及生存率,减少白血病细胞耐药性的产生。
化疗药物在发挥疗效的同时也产生一定的毒副作用,其导致骨髓抑制的机理是直接引起造血祖细胞的耗竭、诱导造血干细胞的衰老凋亡、破坏骨髓基质细胞等。文献报道[12],恶性肿瘤化疗后骨髓抑制发生率高达50%~91.3%。骨髓抑制期患者出现周围血细胞数量减少,以白细胞、血小板数量出现不同程度的下降为主要特征,重则引起血红蛋白含量降低,进而诱发感染、出血、贫血等并发症,甚者危及患者生命,严重影响患者生命质量。
本次研究显示,从两组患者的动态血液分析,外周血白细胞d1~9、血小板d1~10 两组数量无差异,表明此时两组患者骨髓对药物反应无明显差异;外周血白细胞d10~12、血小板d11~12 中剂量Ara-c 巩固治疗组外周血细胞数量低于IA 巩固治疗组,表明此时中剂量Ara-c 巩固治疗组骨髓抑制程度大于IA巩固治疗组,亦说明中剂量Ara-c 巩固治疗组骨髓抑制时间的发生早于IA 巩固治疗组;外周血白细胞d13~17、血小板d13~21 两组细胞数量基本一致(P>0.05),此时两组患者均为骨髓抑制期,且两组患者的骨髓抑制程度相当;外周血白细胞d18~20、血小板d22~23 中剂量Ara-c 巩固治疗组外周血白细胞数量高于IA 巩固治疗组,此时中剂量Ara-c 巩固治疗组骨髓逐步解除抑制,恢复造血能力,IA 巩固治疗组骨髓仍为抑制状态,亦表明中剂量Ara-c 巩固治疗组骨髓抑制解除时间的发生亦早于IA 巩固治疗组患者;外周血白细胞d21 至出院、血小板d24 至出院两组患者血细胞数量接近(P>0.05),此时两组患者骨髓解除抑制,恢复其造血功能。
综上所述,成人急性髓系白血病巩固化疗中,两种方案骨髓抑制程度及安全性方面无差异,但中剂量Ara-c 巩固治疗组患者化疗后白细胞、血小板下降及回升时间均早于IA 巩固治疗组患者,骨髓抑制期的支持治疗措施开始干预时间及结束时间中剂量Ara-c 组患者亦应早于IA 巩固治疗组患者。
