胃癌患者IL-1β、TNF-α、IL-8、TGF-β 水平变化及其与肿瘤标志物及胃肠激素水平的关系
2021-09-07郑荣武
郑荣武
(广丰区人民医院肿瘤科,江西 上饶 334600)
胃癌(gastric carcer)是世界范围内最常见的消化系统恶性肿瘤之一,全球每年胃癌新发病例占所有癌症新发病例的7.8%,死亡病例为占癌症相关死亡的9.7%,严重危害着人类的身心健康和生命安全[1]。研究显示[2],在胃癌的发生发展过程中,机体的免疫功能及免疫因子发挥着重要的作用。在众多的免疫因子中,筛选出对肿瘤患者治疗疗效、无进展生存期、总生存期等相关的因子是进一步开展肿瘤综合治疗和个体化治疗的基础。本研究主要观察胃癌患者血清白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-8(IL-8)、转化生长因子-β(TGF-β)水平变化及与肿瘤标志物和胃肠激素水平的关系,以期为临床提供诊断和治疗依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2019 年1 月-2020 年6 月广丰区人民医院接受治疗的胃癌患者80 例作为胃癌组,另选取同期在我院接受治疗的胃炎患者80 例作为胃炎组。胃癌组男45 例,女35 例,年龄52~79 岁,平均年龄(62.38±4.35)岁;胃炎组男40 例,女40例,年龄55~80 岁,平均年龄(62.40±4.69)岁。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核通过,所有患者均知情同意,并签署知情同意书。
1.2 纳入及排除标准 纳入标准:①符合胃癌及胃炎的临床诊断标准;②年龄≥50 岁;③无其他系统严重疾病者。排除标准:①临床资料不全者;②存在认知障碍者。
1.3 方法 抽取患者空腹静脉血10 ml,以2000 r/min速度离心20 min 分离血清待检,采用酶联免疫吸附法测定患者IL-1β、TNF-α、IL-8、TGF-β 水平变化。采用RIA、ELISA 以及免疫组化方法检测血清以及组织中肿瘤标志物CEA、CA19-9 和CA125的含量。采用ELISA 法定量检测胃肠激素PGⅠ、PGⅡ、G-17 水平变化。
1.4 评价指标 比较两组IL-1β、TNF-α、IL-8、TGFβ、CEA、CA19-9 和CA125、PGⅠ、PGⅡ、G-17 水平,分析胃癌患者IL-1β、TNF-α、IL-8、TGF-β 与肿瘤标志物和胃肠激素水平的相关性。
1.5 统计学方法 采用SPSS 11.5 统计软件进行数据分析,计数资料采用(n)表示,行χ2检验;计量资料采用()表示,行t检验;采用Pearson 相关性分析胃癌患者IL-1β、TNF-α、IL-8、TGF-β 与肿瘤标志物和胃肠激素水平的关系。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组IL-1β、TNF-α、IL-8、TGF-β 水平比较 胃癌组IL-1β、TNF-α、IL-8、TGF-β 水平均高于胃炎组,差异有统计学意义(P<0.05),见表1。
表1 两组IL-1β、TNF-α、IL-8、TGF-β 水平比较(,ng/L)

表1 两组IL-1β、TNF-α、IL-8、TGF-β 水平比较(,ng/L)
2.2 两组肿瘤标志物水平比较 胃癌组CEA、CA19-9 和CA125 肿瘤标志物水平高于胃炎组,差异有统计学意义(P<0.05),见表2。
表2 两组肿瘤标志物水平比较()

表2 两组肿瘤标志物水平比较()
2.3 两组胃肠激素水平比较 胃癌组PGⅠ、PGⅡ水平低于胃炎组,G-17 水平高于胃炎组,差异有统计学意义(P<0.05),见表3。
表3 两组胃肠激素水平比较()

表3 两组胃肠激素水平比较()
2.4 胃癌患者IL-1β、TNF-α、IL-8、TGF-β 与肿瘤标志物和胃肠激素的相关性 胃癌患者IL-1β、TNFα、IL-8、TGF-β 水平与CEA、CA19-9、CA125 和G-17 水平呈正相关,与PGⅠ、PGⅡ水平呈负相关(P<0.05),见表4。
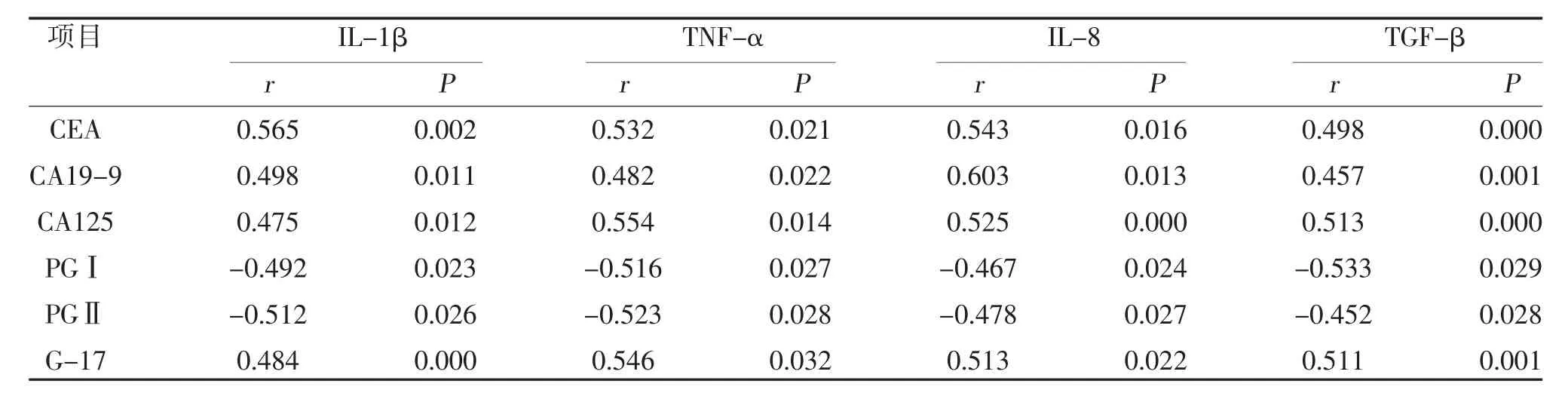
表4 胃癌患者IL-1β、TNF-α、IL-8、TGF-β 与肿瘤标志物和胃肠激素的相关性
3 讨论
胃癌位居我国恶性肿瘤发病率为第2 位,为36/10 万,死亡率位居第3 位,为26/10 万,发病人数及死亡人数均占全球胃癌发病总人数的50%左右,不同于日韩等国,我国胃癌具有发病率和病死率高、早期胃癌比例低(仅10%左右)、以进展期为主等特点[3]。随着肿瘤免疫学的发展,研究者逐渐认识到肿瘤的发生发展不仅与癌细胞内在遗传背景有关,而且与机体的免疫系统密不可分[4]。肿瘤微环境的免疫机制和机体整体免疫状态对肿瘤的影响贯穿于肿瘤的发生发展整个过程,对患者的预后产生重大影响。肿瘤微环境的免疫机制可以促进或抑制肿瘤细胞的生长、浸润、转移,机体正常的免疫系统可识别、清除原发肿瘤,抑制肿瘤细胞的侵袭转移。肿瘤宿主的免疫能力下降是肿瘤发生、增殖、发展的重要原因,且已有研究显示[5],机体免疫状态在肿瘤发生中起重要作用。
恶性肿瘤发生后,患者体内炎症因子变化波动明显,而慢性炎症持续存在会启动、维持并促进肿瘤细胞的生长。IL-1β 属于前炎症细胞因子,在人体免疫损伤、基因表现等机制中发挥重要调节作用,还可以抑制胃酸分泌以及促进血管生成的作用,该因子不仅在胃癌组织中高表达,而且还与胃癌的临床病理特征有显著相关性[6]。TNF-α 是单核巨噬细胞分泌的促炎因子,可以抑制胃酸分泌,具有的生物学功能较多,可以诱导细胞生长、增殖、分化,同时还可以诱导细胞凋亡或者抑制细胞凋亡进而促进肿瘤的发生发展。研究显示[7],低浓度TNF-α 可以促进肿瘤细胞增殖,而高浓度TNF-α 则可以造成肿瘤细胞死亡。IL-8 是单核巨噬细胞或者淋巴细胞产生的细胞因子,可吸附中性粒细胞,促进趋化、脱落并释放溶酶体,增强人体免疫反应。研究发现[8],TNF-α 与胃癌细胞黏附与迁移关系密切,通过抑制其表达能够降低胃癌细胞黏附侵犯能力。TGF-β 是肽类物质,可以控制增殖、分化和胚胎发育,其在肿瘤早期可以抑制肿瘤增长,进展期可以诱导体内反应,进而促进肿瘤细胞生长、侵犯和转移[9]。本研究结果显示,胃癌组IL-1β、TNF-α、IL-8、TGF-β 水平均高于胃炎组(P<0.05),说明炎症因子在胃癌患者中反应程度更为明显。
肿瘤标志物属于临床常用的监测恶性肿瘤发生发展的指标,是一类和肿瘤相关蛋白有关的可以表现异常增生细胞扩增、基因转录和蛋白翻译的异常表达蛋白,能够协助临床筛查与术后的随访[10]。CEA是人类胚胎抗原特异性决定簇肿瘤相关抗原,也是胃肠道肿瘤特异性的标志物,对于胃癌具有一定的诊断价值;CA19-9 是一种与胰腺癌、胆囊癌、结肠癌和胃癌相关的肿瘤标志物,又称胃肠癌相关抗原,与CEA的抗原决定簇性质相近[11];CA125 属于一种糖蛋白,来源于胚胎发育期体腔上皮,在正常卵巢组织中不存在,因此最常见于上皮性卵巢肿瘤(浆液性肿瘤)患者的血清中,其诊断的敏感性较高,但特异性较差。有研究发现[12],CA125 在胃癌患者中也呈高表达。一种肿瘤可能含有多种肿瘤标志物的过度表达,在不同肿瘤中肿瘤标志物的表达程度也不尽相同[13],因此对于某类肿瘤选择单一肿瘤标志物进行诊断和评定预后均不理想,可以采取某些特异性高或者敏感性高的肿瘤标志物进行联合检测,相互补充,减少漏诊和误诊。本研究结果发现,胃癌组CEA、CA19-9 和CA125 水平高于胃炎组(P<0.05),说明胃癌患者肿瘤标志物水平高于胃炎患者,检测CEA、CA19-9、CA125 水平对诊断胃癌具有重要意义。此外,本研究结果显示,胃癌组PGⅠ、PGⅡ水平低于胃炎组,G-17 水平高于胃炎组(P<0.05),说明胃癌患者体内激素水平变化较胃炎患者明显。胃蛋白酶属于胃窦和胃体腺体分泌的蛋白类辅助消化因子,研究发现[14],胃蛋白酶原合成后聚集在细胞顶部,在消化刺激因子的刺激下分泌释放,进入到胃腔后可以变为胃蛋白酶,其中PGⅠ主要是由胃体主细胞和黏液细胞分泌,当胃黏膜发生萎缩和肠上皮化生后表达下降;PGⅡ则是胃十二指肠后部幽门的腺体所分泌,一般在胃炎和(或)溃疡状况下分泌增多,当上皮出现病变后随着腺体萎缩改变和异型增生,患者腺体分泌功能降低,使得PGⅡ分泌减少,二者均可评估胃癌的发生发展。G-17 则是由胃窦细胞所分泌,一般情况下组胺、乙酰胆碱以及蛋白类分解产物氨基酸均会对该因子的分泌产生影响,特别是发生恶性肿瘤后,上皮内腺体细胞间质发生萎缩以及细胞信号的传递出现障碍,会反馈性地造成G-17分泌增加[15]。本研究通过相关性分析发现,胃癌患者IL-1β、TNF-α、IL-8、TGF-β 水平与CEA、CA19-9、CA125 和G-17 水平呈正相关,与PGⅠ、PGⅡ水平呈负相关(P<0.05),提示胃癌的发生发展与肿瘤标志物和胃肠激素水平相关。本研究尚存在一定不足,其属于回顾性分析,纳入患者数量有限,因此该结论还有待进一步开展多中心大样本量进行深入论证。
综上所述,胃癌患者血清IL-1β、TNF-α、IL-8、TGF-β 水平较高,且与肿瘤标志物和胃肠激素水平密切相关,可作为临床筛查的重要指标。
