少突胶质细胞条件性敲除FGF9基因小鼠模型的建立、鉴定及初步表型
2021-09-06李端刘亚坤段冰霞杜娟郭默然
李端,刘亚坤,段冰霞,杜娟,郭默然*
(1.河北医科大学第二医院,石家庄 050000;2.河北森朗生物科技有限公司,石家庄 050000)
成纤维细胞生长因子(fibroblast growth factor,FGF)是一个多基因家族,在促进胚胎发育、组织修复、神经保护、肿瘤发生与转移等多种生理或病理过程中发挥作用[1]。FGFs共有23个成员,分子量在17×103~34×103之间,都具有120个氨基酸构成的保守核心[2]。根据序列同源性和系统发育上的差异,将这些家族分为包括旁分泌(FGF 1-10、16-18、20、22)、内分泌(FGF 15/19、21、23)和胞分泌(FGF 11-14)3种类型[3]。
FGF9作为其家族成员之一,广泛存在于在中枢神经系统及外周神经系统中,对神经元和神经胶质细胞有保护、促生长和修复损伤等作用[4]。少突胶质细胞作为神经系统的重要部分,在保护神经元、协助信号传递中发挥重要作用,FGF9也被证实可以调节少突胶质细胞中髓鞘相关蛋白的表达[5-6]。但是少突胶质细胞敲除FGF9是否对小鼠有明显影响还未见相关报道。
条件性基因敲除动物模型,是研究基因在模型特定细胞或组织生理功能的有效方法。其中基于Cre/Loxp系统的条件性基因敲除小鼠因其良好的实验效果得到了许多研究者的青睐[7]。为此,本实验利用Cre/loxp系统构建少突胶质细胞(Olig1)特异性敲除FGF9基因的小鼠模型,初步观察其表型,为进一步探讨FGF9基因在神经系统发育中的作用及机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
FGF9flox/flox纯合子转基因小鼠由本课题组委托百奥赛图基因生物技术有限公司【SCXK(京)2020-0007】制备。Olig1-Cre转基因小鼠(B6;129S4-Olig1tm1(cre)Rth/J)购自Jackson实验室(Stock No:011105)。本实验中共用FGF9flox/flox/Olig1-Cre+以及同窝对照雄性小鼠各16只用于实验,8周龄SPF级小鼠,体重约为25 g。3对用于Western Blot检测,3对用于免疫化学染色,其余10对用于体重及生存期统计。小鼠于河北医科大学第二医院SPF级动物饲养间饲养【SYXK(冀)2016-003】,室内温度控制在20~25℃,湿度控制在40%~70%。小鼠笼盒每周进行1次消毒处理,垫料、饲料、饮水经过高温高压灭菌处理。繁殖采用雌雄比3∶1同笼方式进行,每胎平均6~10只小鼠,小鼠出生20~30 d后进行分笼,一直到8周性成熟,整个过程中密切观察小鼠的生长和繁殖情况。所有操作均符合河北医科大学第二医院实验伦理要求(审批号:2020-R155)。
1.1.2 主要试剂与仪器
dNTP,rTag酶(大连宝生物公司),PCR引物由上海生工合成。GoTaq® Master Mixes购自Promega(M7123)。总蛋白提取试剂盒(北京普利莱基因技术有限公司(P1250))。FGF9抗体(Abcam公司(EPR19937)),Olig1抗体(Millipore公司(MAB5540)),二抗(Rockland ImmunoResearch)。其他生化试剂购自Sigma。PCR扩增仪(德国Eppendorf公司),DYY-12电泳仪(北京 六一仪器厂),全自动凝胶成像系统(英国Syngene公司),石蜡切片机(德国Leica公司),Odyssey双色红外荧光成像系统(美国LI-COR公司),转棒仪(意大利Ugo Basile公司)。
1.2 方法
1.2.1 转基因小鼠的鉴定
Olig1-Cre转基因小鼠与C57BL/6野生型小鼠进行杂交繁殖。FGF9flox/flox转基因小鼠为纯合子小鼠,雌雄均取纯合子进行繁殖。碱性裂解法提取转基因小鼠尾尖组织的DNA,设计合成鉴定基因的引物,引物序列见表1。PCR反应体系(20μL):2×PCR Master Mix 10μL,正向、反向引物各0.5μL,DNA模板2μL,去离子水7μL。反应条件:94℃5 min;94℃30 s,55℃30 s,72℃30 s,40个循环;72℃7 min。取PCR反应终产物8μL在1.5%琼脂糖凝胶电泳,电压100 V,时间30 min,全自动凝胶图像系统分析成像并保存。

表1 FGF9及Olig1-Cre基因鉴定所需PCR引物Table 1 PCR primers for FGF9 and Olig1 gene genotyping
1.2.2 少突胶质细胞特异性敲除FGF9基因小鼠的繁殖与鉴定
取雌性FGF9flox/flox小鼠与雄性Olig1-Cre+转基因小鼠进行杂交繁殖,根据孟德尔遗传规律,其子代基因型分别为:FGF9flox/wt/Olig1-Cre+;FGF9flox/wt/Olig1-Cre-,比例各占1/2。取雌性FGF9flox/wt/Olig1-Cre+小鼠与雄性FGF9flox/flox小鼠进行交配,其子代为四种基因型:FGF9flox/flox/Olig1-Cre+;FGF9flox/flox/Olig1-Cre-;FGF9flox/wt/Olig1-Cre+;FGF9flox/wt/Olig1-Cre-。其中FGF9flox/flox/Olig1-Cre+全敲小鼠比例为1/4。按照1.2.1鉴定方法进行FGF9和Olig-Cre的鉴定。FGF9flox/flox/Olig1-Cre+小鼠作为敲除组,同窝其余3种基因型小鼠表型无明显差异,作为对照组。
1.2.3 Western Blot
从处死的小鼠中收集新鲜大脑皮层组织并转移至试管中。使用总蛋白质提取试剂盒提取蛋白质,通过SDS-PAGE胶分离,然后转移到PVDF膜上。将膜与一抗在4°C孵育12 h,洗涤3次,持续15 min,然后与二抗在37°C孵育1 h。在Odyssey红外成像系统(LI-COR,NE)上进行扫描分析以及定量。
1.2.4 免疫荧光
处死小鼠并用4%多聚甲醛灌注,取出小鼠大脑置于4%多聚甲醛中固定48 h。梯度乙醇脱水后,石蜡包埋切片,烤片脱蜡后用于免疫荧光染色。免疫荧光如文献所述进行了部分修改[8]。大脑切片在4℃下用一抗孵育过夜,然后在室温下用二抗和Hoechst染色孵育1 h。共聚焦荧光显微镜(Olympus FV1000)观察图像及分析。
1.2.5 抓力、转棒测试、体质量及生存期比较
选取同窝非条件敲除小鼠作为对照组,对照组和敲除组各3只小鼠,进行抓力、转棒测试,并进行足迹分析。同时统计对照组和敲除组各10只小鼠,测量8周龄的体重进行比较,之后比较对照组和敲除组的生存期。本项由2016年10月开始,到2020年1月观察小鼠生存期结束为止。
1.3 统计学分析
数据的统计处理采用GraphPad Prism5软件分析,Western Blot结果用Image-Pro plus 5.1分析。体重测量数据比较采用Stundent’st检验,生存期比较用Log-rank检验。P<0.05为差异具有统计学意义。
2 结果
2.1 FGF9条件性敲除模型的建立及验证
FGF9flox/flox基因小鼠是在FGF9第一个外显子两端插入了Loxp位点,比野生型多60 bp,与表达Cre的转基因小鼠交配,从而获得Cre重组酶切除FGF9的条件敲除小鼠(图1A)。对雄性FGF9flox/wt/Olig1-Cre+小鼠与雌性FGF9flox/flox小鼠杂交后代进行基因鉴定,结果如图1B所示,2号泳道内检测的结果为Olig1-Cre阳性小鼠,3号泳道检测结果为野生型小鼠。1号泳道内检测的结果为FGF9flox/floxOlig1-Cre+小鼠,即少突胶质细胞特异性敲除FGF9基因的小鼠模型,基因敲除(knockout,KO)也经过验证被敲除。其余3种基因型小鼠无明显差异,可作为对照小鼠。
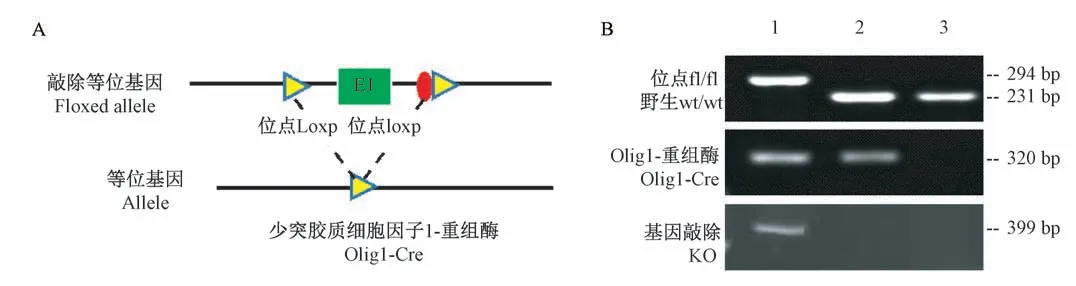
图1 PCR检测FGF9 CKO小鼠基因组DNANote.A.Schematic diagram of Cre/Loxp knockout principle.B.Electrophoresis band of PCR amplification of mouse tail tissue DNA.Figure 1 PCR analysis of genomic DNA in FGF9 conditional knockout mice
取对照组和敲除组小鼠进行蛋白表达检测以及免疫荧光观察,每组3只小鼠。Western Blot分析结果显示,与对照小鼠相比,FGF9条件性敲除小鼠大脑皮层中FGF9表达显著降低,降低了约60%的表达(Mean 0.356 SD 0.052 vs 0.143 SD 0.025,P=0.0419)(图2A)。对基因小鼠进行FGF9和Olig1双重免疫染色,敲除组小鼠大脑皮层中FGF9阳性细胞少于对照组小鼠,并且大部分Olig1阳性神经元不表达FGF9(图2B),部分呈现更细长的反应形态(箭头所指)。这些结果显示在蛋白水平上也证明模型建立成功。
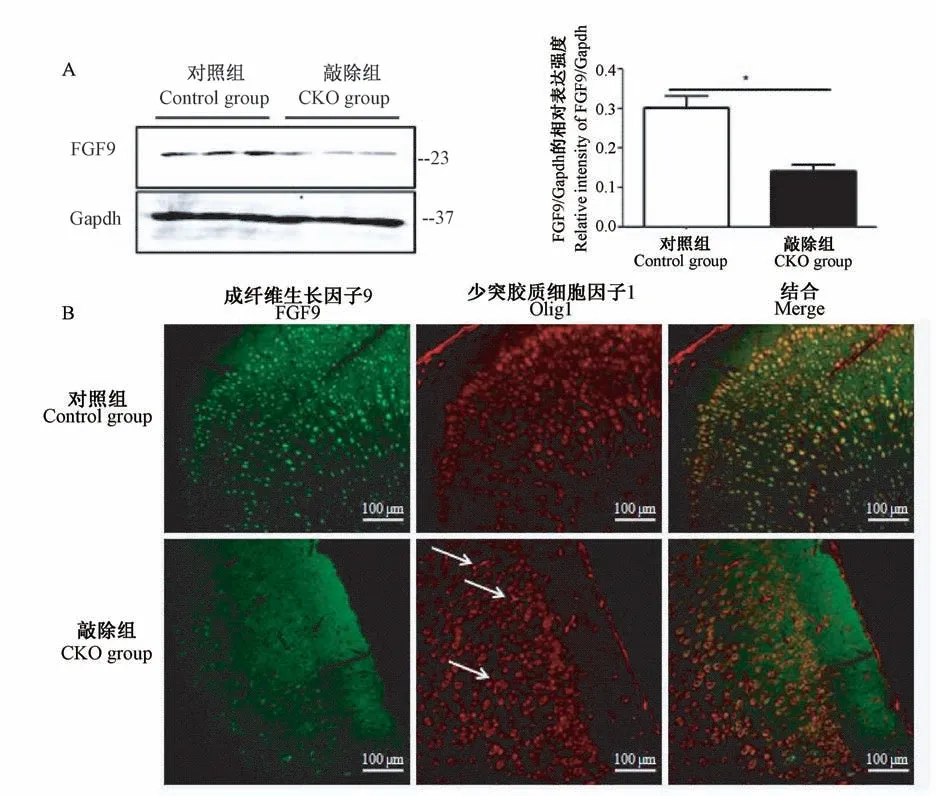
图2 蛋白电泳和共聚焦观察结果验证FGF9 CKO小鼠大脑皮层FGF9的表达Note.A.The expression of FGF9 protein levels in the cortex of the control and FGF9 CKO group.Compared with the control group,*P<0.05.B.Immunostaining for FGF9 and Olig1 in the cortex of the control and FGF9 CKO group.Figure 2 Western Blot and confocal results verify the expression of FGF9 in the cortex of FGF9 CKO mice
2.2 FGF9条件性敲除小鼠表型分析
2.2.1 遗传性状
使用雄性FGF9flox/wt/Olig1-Cre+小鼠与雌性FGF9flox/flox小鼠交配生产后,累计统计了82只出生小鼠,其中雄性43只,雌性39只,雌雄比为110.3%。其中FGF9flox/flox/Olig1-Cre+基因型小鼠19只;FGF9flox/flox/Olig1-Cre-基因型小鼠21只;FGF9flox/wt/Olig1-Cre+基 因 型 小 鼠 20只;FGF9flox/wt/Olig1-Cre-基因型小鼠23只,分离比例符合基本孟德尔遗传定律,这说明少突胶质细胞条件性敲除FGF9对小鼠的胚胎发育无明显影响。
2.2.2 生长发育和生存期
分为对照组和敲除组两组,每组雌雄各5只小鼠(8周性成熟),比较两组小鼠的行动情况,并未发现敲除小鼠出现少突胶质细胞异常可能引起的多发性硬化的表型,例如后肢无力、瘫痪或者平衡失调等,抓力、转棒测试以及足迹分析均未见敲除小鼠与对照组有任何异常(图3A~3C)。有趣的是,统计了10对对照组和敲除组小鼠体重,结果显示条件性敲除FGF9基因小鼠生长明显慢于对照组。FGF9敲除组平均体重比对照组减轻了26.1%(23.45 SD 4.86 vs 31.75 SD 4.43,P=0.004)(图3D),差异具有显著性差异(P<0.01)。比较两组生存期发现,敲除组与对照组生存期没有差异,均达到两年左右(图3E)。
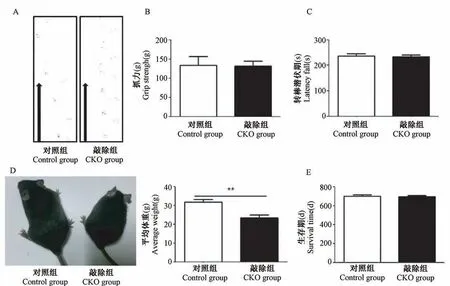
图3 FGF9敲除组与对照组表型、体重及生存期比较Note.A.Footprint analysis of CKOgroup and control group.The front paws were labeled with red ink,and the rear paws with blue ink.B.Grip strength test of CKOgroup and control group.C.Rotating rod test of CKO group and control group.D.Compared with the control group,***P<0.0001.E.The FGF9 CKO mice did not display overt abnormalities in survival.Figure 3 Phenotype observation of the control and FGF9 CKO group
3 讨论
成纤维生长因子家族作为重要的细胞间信号分子,参与了血管形成、胚胎发育、骨骼发育、损伤修复、细胞凋亡、肿瘤生长、性腺分化等多种生理或病理过程[9-10]。FGF9是中枢神经系统广泛表达的因子之一,并起胶质细胞激活因子的作用,以促进中枢神经系统中神经元的存活和胶质细胞的分化[11-12]。但是相对于其他家族成员,FGF9在中枢神经系统中研究较少,相关机制并不清楚。
FGF9(-/-)全敲小鼠由于肺发育不全出生时即死亡[13]。为了更好的研究FGF9在中枢神经系统中的功能和作用机制,本研究利用Cre/Loxp系统构建了少突胶质细胞条件性敲除FGF9基因小鼠。基因型鉴定是基因敲除小鼠繁育保种的重要环节[14],对构建成功小鼠提取DNA进行基因型鉴定loxp位点和Olig1-Cre,同时蛋白电泳验证大脑皮层FGF9蛋白的表达水平,共聚焦激光显微镜观察皮层中FGF9和Olig1蛋白的分布,多种方法都证实了少突胶质细胞条件性敲除FGF9基因小鼠构建成功。
少突胶质细胞是中枢神经系统髓鞘形成细胞,Olig1和Olig2在少突胶质细胞的发育、分化和髓鞘形成过程中发挥重要的作用。Olig1主要参与少突胶质细胞的成熟分化和髓鞘形成的终末期,而且部分功能可以被Olig2的功能所补偿。而Olig2主要少突胶质前体细胞的早期定向分化中在发挥作用。在构建的少突胶质细胞条件性敲除FGF9基因小鼠中,也没有观察到后肢无力、瘫痪或者平衡失调等多发性硬化等表型。
初步表型分析显示,敲除组小鼠胚胎发育无明显影响,出生数量符合孟德尔遗传定律。生存期也没有明显变化,但是生长速度慢于同窝对照小鼠,8周龄时体重显著低于对照组。这与之前的研究GABAergic神经元敲除FGF9小鼠有相似的结果,FGF9flox/floxVGAT-Cre+小鼠也显示出生长迟缓[5]。有研究报道神经系统发育过程中端脑腹侧的祖细胞(表达Olig1)可以产生GABA能神经元和少突胶质细胞[15]。条件性敲除FGF9基因与发育迟缓的关系,是否与GABA能神经元相关,以及是否还影响其他方面(如骨骼发育等),需要进一步研究。
综上所述,本研究成功构建了少突胶质细胞(Olig1)特异性敲除FGF9基因的小鼠模型,胚胎发育正常,生存期正常,但发育缓慢。这些表型提示,FGF9基因在少突胶质细胞中表达或许对调控小鼠发育有积极作用。在以后的研究中,将进一步分析其具体的作用机制。
