长链非编码RNA-LA16c-313D11.11与突变型p53在子宫内膜癌中的表达与临床意义
2021-09-06辛卫娟华克勤
丁 雪 辛卫娟 华克勤
子宫内膜癌(endometrial carcinoma ,EC)是发生在子宫内膜的一类上皮性恶性肿瘤,是女性生殖系统3大恶性肿瘤之一,分为Ⅰ型(雌激素依赖型)和Ⅱ型(非雌激素依赖型)[1]。研究[2-3]结果表明,EC的发生、发展不仅与雌、孕激素水平相关,还涉及多种分子通路机制。Salmena等[4]提出的竞争性内源核糖核酸(competing endogenous RNA,ceRNA)假说认为,多种核糖核酸(RNA)可通过共享一个或多个同源性的微核糖核酸反应元件(microRNA response element, MRE)竞争性结合微核糖核酸(microRNA,miRNA),从而实现相互调控。长链非编码RNA(long non-coding RNA,lncRNA)被证实可作为ceRNA参与调控多种癌症基因[5-7]。miRNA205既可靶向细胞凋亡通路,抑制细胞自噬[8],又可调节上皮-间充质转化促进癌细胞的增殖、侵袭[9],其高表达常与疾病预后不佳相关[10-11]。抑癌基因p53是miRNA205的直接靶点,miRNA205与p53结合后,可抑制该基因的作用,从而抑制癌细胞凋亡[12]。本课题组的前期研究[13]已成功鉴定出新的lncRNA,将其命名为lncRNA-LA16c-313D11.11。该lncRNA可作为ceRNA通过MRE与miRNA205结合,降低EC组织中miRNA205水平,维持细胞的生物学特性。因此,探索lncRNA-LA16c-313D11.11和p53与EC之间的联系,有助于为临床诊治EC夯实理论基础。
1 对象与方法
1.1 研究对象 收集复旦大学附属妇产科医院2013年9月—2016年9月收治的54例子宫内膜癌患者的临床资料。患者年龄范围为26~76岁,年龄为(56.00±10.66)岁。根据国际妇产科联盟(Federation International of Gynecology and Obstetrics, FIGO)2014年制订的标准对患者进行分期。根据分化程度、异型性和核分裂象确定子宫内膜样腺癌恶性程度的级别:G1为分化良好,属低度恶性;G2为中等分化,属中度恶性;G3为低分化,属高度恶性。纳入标准:为首次接受手术治疗的EC患者;患者手术前未接受放射治疗(简称放疗)或化学治疗(简称化疗)。排除标准:合并其他肿瘤,相关临床资料缺失。研究对象的临床资料均来源于医院组织库,本研究经医院伦理委员会审批通过(审批号:kyy2015-24),所有患者及其家属均签署知情同意书。
1.2p53阳性检测与判定方法 鼠抗人单克隆p53抗体(批号为Do-7,M7001) 与免疫组织化学试剂盒(LSAB试剂盒)均购自丹麦DAKO公司。经4%多聚甲醛溶液固定,石蜡包埋的EC组织标本经微波处理修复抗原后,应用浓度为1∶100p53抗体进行染色;突变型p53阳性组织细胞核为棕黄色着色。应用高倍荧光显微镜对染色的组织切片进行观察,每个标本随机选取10个高倍镜视野,计算其中的阳性细胞比例,≤10%为p53阴性,>10%为p53阳性。将切片编号后由两位病理科医师随机阅片、独立判读,意见不一致时,进行重新评判,以达成最终统一。
1.3 实时荧光定量PCR检测 应用TRIzol试剂 (美国赛默飞生物科技有限公司) 提取患者EC组织总RNA。采用标准琼脂糖凝胶电泳法检测RNA的完整性。应用Promega A3500反转录试剂盒 (美国普洛麦格生物技术有限公司)将总RNA反转录为cDNA。应用SYBR Premix Ex Taq试剂盒 (大连宝日医生物技术有限公司)检测lncRNA-LA16c-313D11.11水平。以GAPDH作为内源性对照。lncRNA-LA16c-313D11.11的正向序列为5’-TGA AGG AGG TTA TTG ACG CA-3’,反向序列为5’-GAG GGG AAA CAG TCC AGA GT-3’。GAPDH的正向序列为5’-AGA AGG CTG GGG CTC ATT TG -3’,GAPDH的反向序列为5’-AGG GGC CAT CCA CAG TCT TC-3’。采用实时荧光定量PCR仪(美国罗氏公司)进行检测。实验均重复3次。通过比较循环阈值 (CT值) 分析实时荧光定量PCR检测结果。采用2-ΔΔCt法计算相对表达量,以lncRNA-LA16c-313D11.11相对表达量的中位数(1.168)为标准区分低表达组(≤1.168)与高表达组(>1.168)。
1.4 统计学处理 应用SPSS 21.0 统计学软件。计数资料以频数(n)和百分率(%)表示,组间比较采用卡方检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料特征 纳入的患者中,年龄<55岁21例(38.89%),≥55岁33例(61.11%);未绝经14例(25.93%),已绝经40例(74.07%);FIGO分期Ⅰ期36例(66.67%),Ⅱ期7例(12.96%),Ⅲ或Ⅳ期11例(20.37%);子宫肌层浸润深度≥1/2 16例(29.63%),子宫肌层浸润深度<1/2 38例(70.37%);有脉管浸润12例(22.22%),无脉管浸润42例(77.78%);有淋巴结转移11例(20.37%),无淋巴结转移43例(79.63%);子宫内膜样腺癌41例 (75.93%);子宫内膜浆液性腺癌9例 (16.67%),透明细胞癌4例(7.40%)。子宫内膜样腺癌恶性病理学程度分级G1的患者为26例(63.42%),G2为8例(19.51%),G3为7例(17.07%)。
2.2 lncRNA-LA16c-313D11.11的表达与临床和病理学特征关系 lncRNA-LA16c-313D11.11高表达组和低表达组在各FIGO分期及有无淋巴结转移的患者中占比的差异均有统计学意义(P值均<0.05);而在不同年龄、绝经情况、组织病理学分型、子宫肌层浸润深度,以及有无脉管浸润的患者中占比的差异均无统计学意义(P值均>0.05)。见表1。
2.3 突变型p53的表达与临床和病理学特征关系 突变型p53阳性患者在子宫内膜样腺癌、浆液性腺癌和透明细胞癌患者及有无淋巴结转移的患者中占比的差异均有统计学意义(P值均<0.05);在不同年龄、绝经情况、FIGO分期、子宫肌层浸润深度及有无脉管浸润的患者中占比的差异均无统计学意义(P值均>0.05)。见表1。
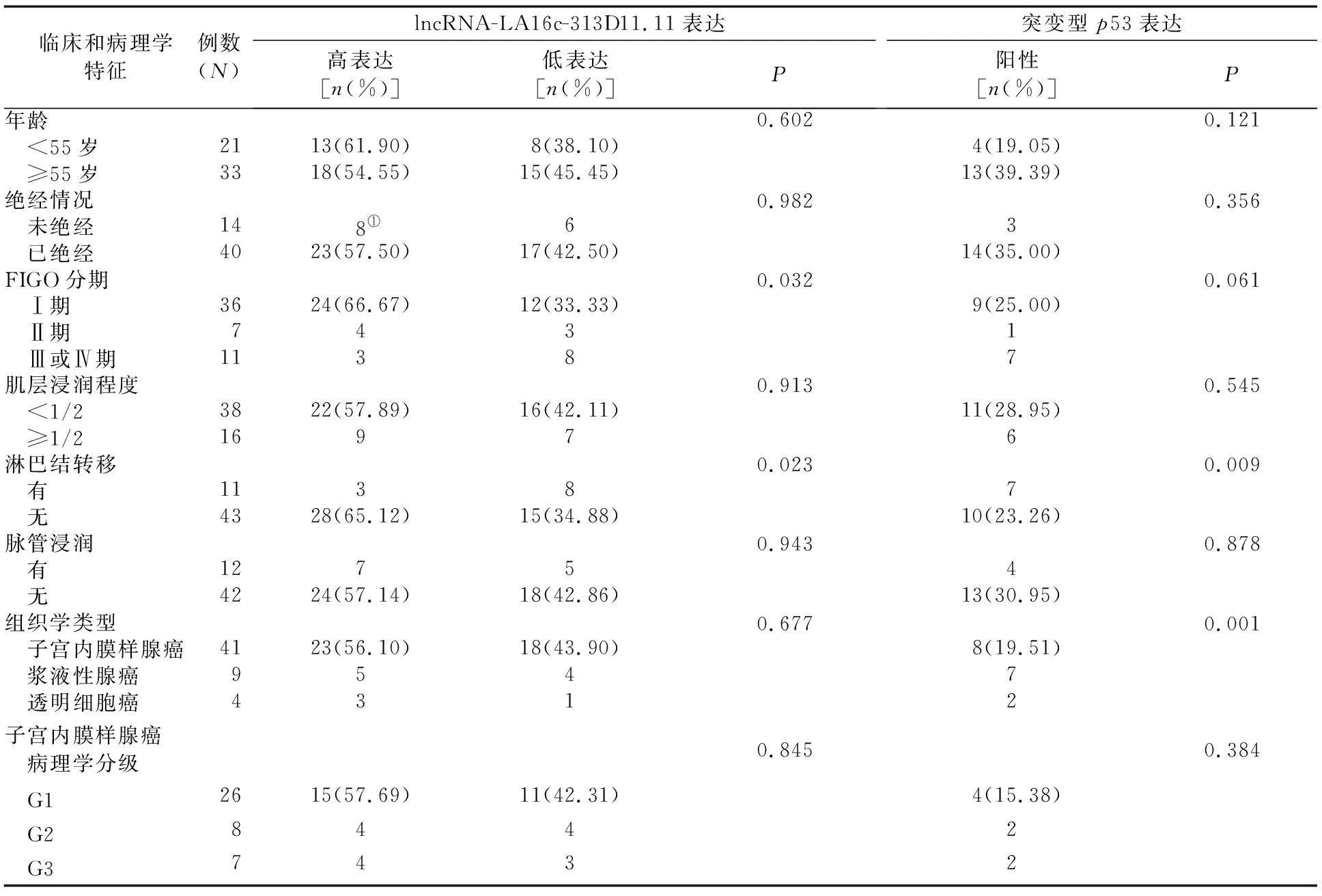
表1 lncRNA-LA16c-313D11.11和突变型p53的表达情况与临床和病理学特征的关系
2.4 lncRNA-LA16c-313D11.11与突变型p53表达的关系 lncRNA-LA16c-313D11.11高表达组突变型p53阳性患者的占比为6/17,低表达组突变型p53阳性患者的占比为11/17,差异有统计学意义(P<0.05)。
3 讨 论
EC是发生在子宫内膜上皮细胞的一组恶性肿瘤,其发病率随着人们生活和饮食习惯的改变而有所变化。在我国,EC是仅次于宫颈癌的第2高发妇科恶性肿瘤[14],其确切的疾病机制尚不清楚。EC Ⅰ 型的发生与长期无孕激素拮抗的雌激素刺激相关,可见于无排卵性疾病、绝经后单雌激素替代治疗等,常见病理学类型为低分化的内膜样腺癌、黏液样腺癌,肿瘤分化良好、恶性程度低,预后好。Ⅱ型的发生与雌激素水平无明确关系,被认为与p53等基因突变相关,通常肿瘤分化程度低、恶性程度高,预后差,多数患者以阴道异常出血、排液为主要临床表现。目前临床上采用手术病理学分期,并遵循FIGO 2014年的分期标准。由于EC临床表现明显,患者多可早期发现并及时诊治。分段诊断性刮宫是最为经济且有价值的诊断方法[15],可有效清除病灶,辅以放疗、化疗和药物治疗后患者总体预后较好。早期EC的5年总生存率高达98%[16],但部分患者确诊时已发生远处转移或初治后复发,故寻找EC的新型标志物将有助于提高对其诊治水平。
p53是一种位于人类染色体17q13.1上且被广泛研究的抑癌基因,分为野生型和突变型。野生型p53具有抑制细胞周期、促进凋亡、维持遗传稳定性和抑制血管形成等功能,发挥保护效应;突变型p53无上述功能,反而会促进肿瘤细胞增殖、恶化,其表达水平与EC恶性侵袭程度密切相关。正常组织p53的免疫组织化学染色通常为阴性,但由于突变型p53蛋白质的半衰期长、表达量高,故检测结果常为阳性[17-18]。本研究结果显示,突变型p53阳性患者在子宫内膜样腺癌、浆液性腺癌和透明细胞癌患者中的占比分别为19.51%、7/9和2/4,在无和有淋巴转移的患者中的占比分别为23.26%、63.64%;当突变型p53阳性患者比例的升高,发生淋巴结转移的EC患者的比例也随之升高;这与上述突变型p53引起EC患者不良结局的观点一致。此外,在EC分子分型的研究中发现,拷贝数高的EC发生p53、PIK3CA和PPP2R1A等基因突变的频率较高。癌症基因组图谱数据库显示,拷贝数高的EC形态包括浆液性腺癌(97.7%)、高级别子宫内膜样腺癌(19.6%)、低级别子宫内膜样腺癌(5.0%)和混合型EC(75.0%)等,患者多预后不良[19]。2017年,Hoang等[20]采用ProMisE模型分析了400例EC的分子亚型,其中包括黏液性癌、浆液性癌、透明细胞癌、去分化癌和癌肉瘤等,结果显示,浆液性EC中p53突变率高达96%,该类型预后较差,这与TCGA的分子分型结果基本一致。由此可见,EC分子分型诊断在指导个体化精准治疗方面有重要的价值。
lncRNA最初以印记H19基因进入研究人员的视野。其为长度超过200个核苷酸且不直接参与蛋白质编码的内源性RNA,但后续研究显示其具有强大的分子编码功能,如参与印记基因调控、染色质修饰、转录干扰等。相比miRNA,lncRNA的数量和种类所占比例更高,lncRNA已成为当前的研究热点[21]。越来越多的证据显示,lncRNA参与了多种恶性肿瘤的基因调控。例如,lncRNA DQ786243的高表达表明结肠直肠癌细胞的增殖和转移能力较强[22],lncRNA ATB过表达可促进上皮-间充质转化,可作为人前列腺癌不良预后的重要标志物[23],Linc00974可促进肝细胞癌的增殖和转移等[24]。本课题组前期研究[25]结果显示,lncRNA-LA16c-313D11.11可作为ceRNA结合并抑制miRNA-205。本研究结果发现,lncRNA-LA16c-313D11.11高表达的Ⅰ期、Ⅱ期、Ⅲ或Ⅳ期EC患者占比分别为66.67%、4/7和3/11;低表达的Ⅰ期、Ⅱ期、Ⅲ/Ⅳ期的患者占比分别为33.33%、3/7和8/11,差异有统计学意义。但子宫内膜癌lncRNA-LA16c-313D11.11表达情况与患者年龄、是否绝经、组织病理学分型、子宫肌层浸润程度、有无脉管浸润无显著相关性。同时,本研究结果显示,无淋巴结转移的患者的lncRNA-LA16c-313D11.11高表达和低表达占比分别为65.12%和34.88%;而有淋巴结转移的患者的lncRNA-LA16c-313D11.11高表达和低表达占比分别为3/11和8/11,且差异有统计学意义。 因此推测,lncRNA-LA16c-313D11.11高表达与患者子宫内膜癌分期早和无淋巴结转移相关。
miRNA-205可通过靶向p53抑制其功能阻止癌细胞凋亡,而lncRNA-LA16c-313D11.11可与miRNA-205结合抑制其作用,推测lncRNA-LA16c-313D11.11可能通过抑制miRNA-205表达影响p53的功能。本研究亦证实,lncRNA-LA16c-313D11.11与突变型p53表达相关,其相关机制有待进一步研究与阐明。
综上所述,lncRNA-LA16c-313D11.11的高表达与EC分期早、无淋巴结转移相关,且lncRNA-LA16c-313d11.11可能通过p53在EC的调控中发挥重要作用。
