玉米根系分泌碳、氮动态及与根系特征的关系
2021-09-05万一兵唐岚岚尚春辉袁嘉仪秦明广
万一兵,唐岚岚,展 茗,尚春辉,袁嘉仪,秦明广
(华中农业大学植物科学技术学院/农业农村部长江中游作物生理生态与耕作重点实验室,武汉430070)
0 引言
根际沉积是根系分泌物、粘液和脱落的根系表皮细胞进入土壤的过程。量化根系分泌物碳、氮对于研究土壤-植物-微生物的碳、氮循环具有重要意义。但根系分泌物释放到根系周围土壤中后,短期内能快速转化,野外条件下原位观测难度大,因此很难量化测定[1-2]。有研究表明一年生植物根含碳约为植物净固定碳的30%~60%,其中40%~90%因根际沉积和微生物呼吸损失[3]。有研究表明,禾谷类作物净固定碳的20%~30%转移到地下,其中一半用于根际沉积[4-6],玉米根际沉积对土壤有机碳的贡献率为4%~25%[7]。而根际沉积氮可以占到植物吸收氮的4%~71%[8],生长92天的玉米植物根际沉积氮可以占根全氮量的30%[9]。根际沉积的主要成分则是根系分泌物,Lynch等[10]认为一般情况下,植物光合产物的28%~59%转移到了地下,其中有4%~70%通过根系分泌物进入土壤。可见,根系沉积物是土壤中不稳定碳的主要来源,为微生物提供了大量可利用的碳源和氮源,显著影响了土壤中的微生物群落[11-13],在维持农田土壤碳平衡过程中发挥着重要的作用[14-16]。
根系分泌物的数量和成分受诸多因素影响,如植物种类、环境因素、根际微生物、营养胁迫等[17]。植物根系特征与根系分泌物密切相关,早期研究就观察到了根际沉积量与根生物量呈正相关关系[6]。还有研究表明根长和侧根发生能力都与根系分泌物的量呈正相关关系[18-20]。有学者指出,根的形态在不同的发育阶段和环境条件下变化很大,并导致根系分泌物的强度和量发生改变[21]。一些研究表明,根系形态、根系生物量与根系碳分泌强度之间存在正相关关系[2,22-23]。还有学者指出,根长和根系分枝强度与根系分泌物呈正相关[20,24-25]。Groleau-Renaud认为,增加根系分枝数可以增加根系分泌强度[26]。但有关作物根系形态和化学性质对根系分泌物的影响的研究仍然偏少,影响了作物与农田土壤碳、氮循环关系的深入认识。
玉米(Zea mays L.)已成为中国第一大粮食作物,在中国不同生态区种植制度构成中具有重要地位,玉米生长过程中通过根际沉积进入土壤的碳、氮量在认识土壤碳、氮转化中不容忽视。长江中游是中国典型的两熟制地区,玉米是该区的第三大粮食作物,常见的玉米种植模式有小麦-夏玉米、油菜-夏玉米、春玉米-晚稻、春玉米-蔬菜等[27]。而有关该区域玉米根际沉积碳、氮动态规律及其与玉米植株特征的关系研究尚未见报道。基于此,本研究通过盆栽试验,分析了玉米根系分泌碳、氮动态与根系形态、理化特征的关系,估算玉米根际沉积碳、氮数量,以期为认识根际沉积与植物特征的关系,探究玉米生产对农田碳、氮循环的影响提供参考依据。
1 材料与方法
1.1 试验地点与试验设计
盆栽试验于2019年4—8月在湖北省武汉市华中农业大学盆栽场(30°28′N,114°29′E)进行。供试土壤为黄棕壤,土壤总有机碳含量为11.42 g/kg,土壤全氮含量为1.01 g/kg,土壤总磷为0.41 g/kg,土壤总钾为7.14 g/kg,土壤pH 6.02。土壤风干粉碎过筛(4 mm),然后与沙按1:1比例混合,装入盆栽桶中(高50 cm,直径35 cm)。按每千克土壤分别施用N 0.19g、P2O50.15 g、K2O 0.19 g,其中氮肥按底肥:分蘖期追肥:穗肥=0.4:0.25:0.35分次施用,钾肥按底肥:穗肥=0.5:0.5分次施用,磷肥作底肥一次施用。供试玉米品种为‘迪卡653’,于4月8日播种,出苗后间苗,每桶留苗3株。玉米自3叶期开始每隔7天左右取样一次,每次取样5桶,用于根系形态指标测定及、根系分泌物分析及生物量测定,同时记载生育时期、测定叶面积。玉米于7月18日成熟。
1.2 测定项目与方法
1.2.1 根系分泌碳、氮收集及测定 参考Szoboszlay[28]的土培-水培结合取样法进行改进。盆栽植株取样时,小心用电锯划开盆栽桶壁,用水冲洗根部土壤,注意保证根部的完整性,快速带回室内,再用去离子水将根部冲洗干净,然后用吸水纸小心地擦干根部多余的水分。将洗净的根系浸入超纯水(灭菌)中,浸没2 h以收集根系分泌物。收集完毕后,取出样株,将浸提液通过0.45 μm孔径过滤器过滤,以除去溶液中存在的颗粒和大部分微生物生物质,然后快速冰冻备用。浸提滤液使用TOC/TN分析仪(Shimadzu TOC-Vcsh,TNM-1,Kyoto,Japan)测定滤液中的碳和氮含量。
1.2.2 根系指标及其他生长指标的测定 浸提结束后,将玉米样株分解为根、茎鞘、叶、穗等部分。用根系分析系统(RHIZO 2017,Epson EU-235)测定根长、根表面积、根体积,各指标与测定时根干重的比值分别为比根长、比根表面积、比根体积。用CI-203便携式激光叶面积分析仪测定叶面积。然后将将玉米样株各部分在110℃下杀青半小时,80℃下烘干至恒重,测定根系与地上部分生物量,计算根冠比。
玉米根系可溶性糖含量测定方法为蒽酮法[29]。根系碳、氮含量利用元素分析仪(Elementar Vario EL,Germany)进行测定。
1.2.3 根系碳、氮分泌强度及累积分泌量的计算 各采样时期玉米单株根系碳、氮分泌强度计算公式如(1)。

各采样时期比根碳、氮分泌强度计算公式如(2)。

2次相邻采样间隔内玉米单株累积根系碳、氮分泌量计算如(3)。

式中:EIplant为某次采样玉米单株根系碳或氮分泌强度[mg/(plant·h)];C为提取滤液中的碳或氮浓度(mg/L);V为提取滤液体积(L);t为浸提时间(h);EIroot为比根碳或氮分泌强度[mg/(g root·h)];Wroot为某次采样玉米单株根生物量(g/plant);Di、Di+1分别为为相邻前后2次取样距离出苗的天数(d)。
1.3 数据处理
利用SPSS 17.0统计分析软件进行根系碳、氮分泌强度与根系特征因子指标之间的相关性分析,并对存在显著相关性的两指标间建立曲线回归模型(P<0.01)。利用SigmaPlot 10.0分析软件构建Logistic模型摸拟根际沉积碳、氮累积动态。
2 结果与分析
2.1 玉米生育期内根系碳、氮分泌强度变化
由图1(a)可知,玉米比根碳分泌强度(EIroot-C)与比根氮分泌强度(EIroot-N)在生育期内呈现前期高后期减弱的趋势。EIroot-C在出苗后32~39天明显提高,并达到了峰值4.19 mg/(g root·h),其后开始迅速下降至平缓。EIroot-N峰值则出现在出苗后17天,为1.20mg/(g root·h)。整个生育期间,EIroot-C明显高于EIroot-N,玉米全生育期平均EIroot-C为2.21 mg/(g root·h),平均EIroot-N为0.26 mg/(g root·h),两者差异显著。

图1 玉米单株根系碳、氮分泌强度与比根分泌强度动态
由图1(b)可知,玉米单株碳分泌强度(EIplant-C)及玉米单株氮分泌强度(EIplant-N)整体上呈现出先升高后下降的趋势。EIplant-C在出苗后58天达到峰值16.02 mg/(plant·h),EIplant-N在出苗后44天达到峰值0.90 mg/(plant·h);全生育期内EIplant-C始终远高于EIplant-N,全生育期EIplant-C及EIplant-N平均分别为8.33 mg/(plant·h)和0.43 mg/(plant·h),两者差异显著。
由图2看出,玉米EIroot-C与EIroot-N呈显著的二次曲线关系(R²=0.816,P<0.01)。玉米EIroot-C随EIroot-N增强而增强,当EIroot-N达到0.8 mg/(g root·h)时,EIroot-C达到最大,其后EIroot-C随EIroot-N的增强而减弱。

图2 玉米比根碳、氮分泌强度的关系
2.2 玉米根系累积碳、氮分泌量
由图3a可知,玉米根系碳、氮累积分泌量在生育期内符合Logistic模型(P<0.01),根据该模型估算,玉米成熟时根系累计碳分泌量可达15.71 g/plant,根系累计氮分泌量可达0.75 g/plant。玉米根系累积碳分泌量明显多于累积氮分泌量。
从图3(b)中可以看出,玉米根系累计碳、氮分泌量占植物总生物量的比重随玉米的生长逐渐降低。玉米成熟时,根系累计碳分泌量可占总生物量的10.59%,根系累计氮分泌量占总生物量的0.51%。
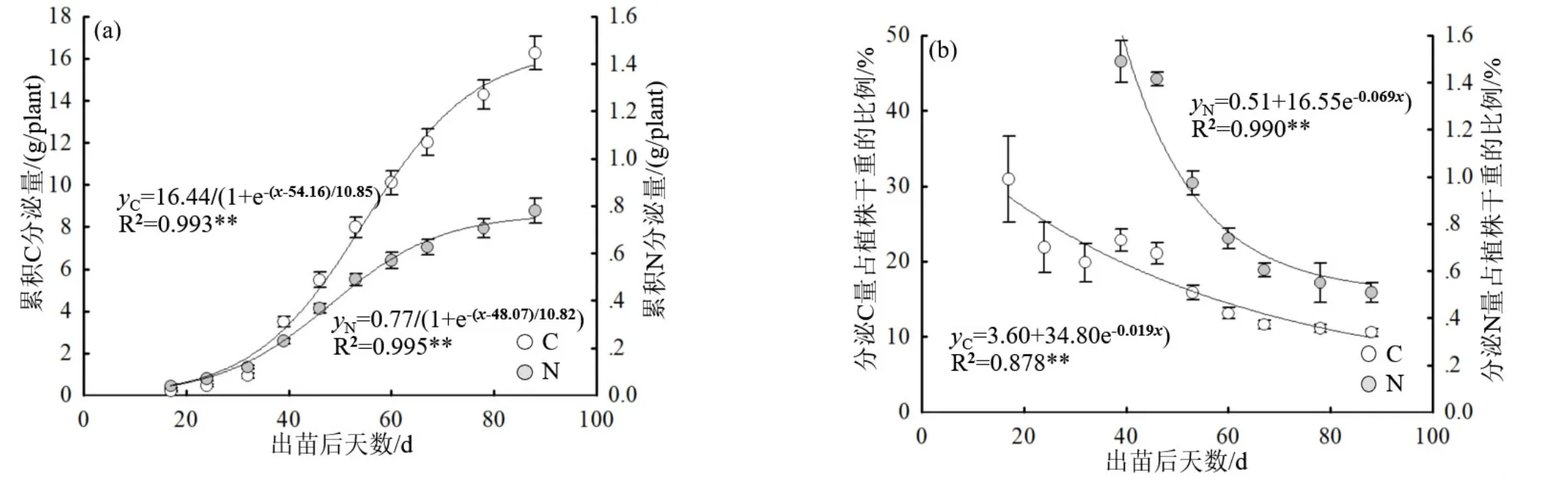
图3 玉米生育期内根系累积碳、氮分泌量(a)及其占植株干重的比例(b)的变化
2.3 玉米根系碳、氮分泌比强度与根系特征的关系
回归分析表明玉米EIroot-C、EIroot-N与比根长、比根表面积、比根体积、根系C/N比、根冠比等根系指标均有显著的相关性(图4a、b、c、e、f),而与根系可溶性糖含量关系不显著(图4d)。玉米EIroot-C与EIroot-N随比根长、比根表面积、比根体积的增加呈线性上升(P<0.05);而随根系碳氮比的提高呈显著线性下降(P<0.05)。玉米EIroot-C与根冠比呈显著的二次曲线关系(R²=0.742**),当根冠比约为0.34时,玉米EIroot-C达到最大值4.5 mg/(g root·h);而玉米EIroot-N与根冠比呈显著正线性相关关系(R²=0.467*)。EIroot-C达到最大值4.5 mg/(g root·h);而玉米EIroot-N与根冠比呈显著正线性相关关系(R²=0.467*)。
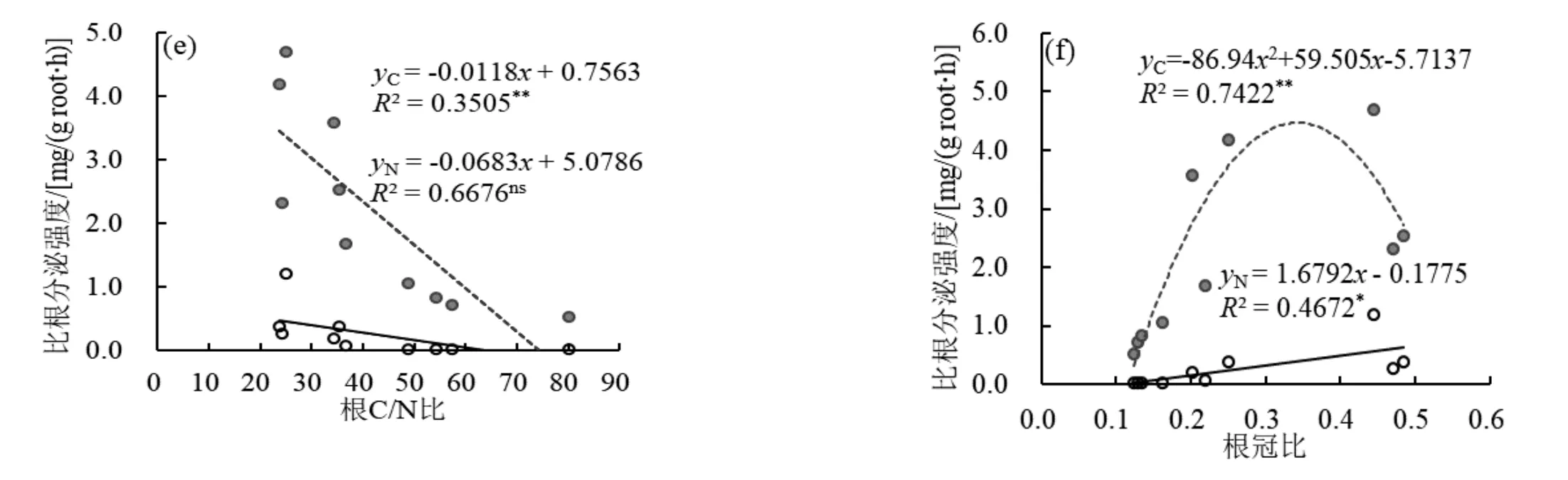
图4 玉米比根碳、氮分泌比强度与根系特征的关系
2.4 玉米根系碳、氮分泌强度与植株特征的关系
由图5可知,玉米EIplant-C与根长、根表面积、根体积、根干重、根冠比、叶面积之间均存在极显著相关性,符合二次曲线关系(P<0.01)。根据回归曲线估计,当玉米根长、根表面积、根体积、根干重、根冠比、叶面积分别达到25000cm/plant、3777cm²/plant、39.09cm³/plant、11.76 g/plant、0.24、2750 cm/plant时,EIplant-C 达到峰值。玉米EIplant-N仅与根冠比之间有极显著相关性(图5e),相关关系呈二次曲线(R²=0.688**),与其他植株特征之间均没有显著的相关性。当根冠比达到0.27时,玉米EIplant-N达到峰值0.90 mg/(plant·h)。


图5 玉米单株碳、氮分泌强度与植株特征的关系
3 讨论与结论
植物根际碳、氮沉积对土壤碳、氮循环有着重要的调控作用,与土壤微生物群落、植物根际养分循环等都有密不可分的关系[30]。本研究发现玉米根系碳、氮分泌强度随玉米的生长发育呈阶段性变化,呈现出先上升后下降的趋势,出苗后30天(5叶)~70天(吐丝期)为根系分泌活动最旺盛的时期。这与何敏毅等用13C脉冲标记法探究玉米根际沉积碳的结论相似[31]。但是玉米根系碳、氮分泌量占植株总生物量的比例随生育进程呈不断下降趋势。一些研究发现,随着玉米、小麦、大麦的生长,其分配到地下的碳占总光合碳的比例越来越小[31-33]。本研究表明盆栽条件下玉米成熟时根系累积分泌碳、氮量分别为15.71 g/plant、0.75 g/plant,分别可占植株总生物量的10.59%和0.51%。何敏毅等[31]使用13C脉冲标记法测定盆栽玉米整个生育期向土壤有机碳中输入的碳量为2.45 g/plant,这与本试验所得结果存在差异。主要原因可能在于试验方法的差异,何敏毅指出他们试验示踪期较长,使得更多的根际沉积物被分解,因此进入土壤中的碳量减少[31]。而本试验提取根系分泌物采用的是溶液提取,提取时间短,受微生物等影响小,加之根系取样过程中可能会出现损伤,其伤流液和内容物会导致结果偏高。也有学者指出,溶液培养法和脉冲标记法所测得的根系碳分泌量差异较大[34]。Jensen[35]使用分根氮标记技术在低氮条件下测定了大田豌豆(Pisum sarium L.)和春大麦(Hordeum sulgare L.)的根际沉积氮,成熟时豌豆根际氮沉积量为19 mg/plant(占植株总氮7%),大麦为17 mg/plant(占植株总氮20%)。显然,上述结果与本试验有着很大差异,推测差异主要来源是Jensen的试验是在低氮情况下进行的,豌豆和大麦成熟时根干重仅为0.9 g/plant和0.5 g/plant,而本试验中玉米成熟时根干重为19.04 g/plant。再者,不同的植株其根际沉积本身就有差异[36]。
有学者指出,根的形态在不同的发育阶段和环境条件下变化很大,并导致根系分泌物的强度和量发生改变[21]。还有报道称,双子叶植物的根际沉积碳高于单子叶植物可能是由于根系形态和根生物量存在差异[14],这表明根系形态和根生物量对根系分泌碳有一定影响。一些研究表明,根系形态、根系生物量与根系碳分泌强度之间存在正相关关系[6,22-23]。还有学者指出,根长和根系分枝强度与根系分泌物呈正相关[20,24-25]。Groleau-Renaud认为,增加根系分枝数可以增加根系分泌强度[26]。本研究发现,玉米根系碳分泌强度与根长、根表面积、根体积、根干重之间均存在极显著的二次曲线关系,而非简单的正相关关系。这个差异可能是试验方法和试验周期的不同造成的。除此之外,本研究还发现玉米根系碳分泌强度与根冠比、叶面积之间也存在极显著的二次曲线关系。另外,有学者指出,植物根际沉积氮与根系生物量呈正相关关系[8,24]。而本研究中玉米根系氮分泌强度却仅与根冠比之间存在极显著相关性。造成玉米根系碳、氮分泌差异的原因有待进一步研究。
本研究发现玉米比根碳、氮分泌强度(EIroot-C、EIroot-N)与比根长、比根表面积、比根体积均有显著的正相关性。Meier等发现成熟山毛榉根系分泌物中碳的释放量与比根长呈正相关[37]。一些学者指出,当根系更薄且根尖更多时,根系渗出率就会更高[19,38]。比根长可用于反映根的相对细度,较高的比根长意味着根系具有更薄的皮层[39]。在较细的根中,根结构和菌根共生的碳成本降低,因此有更多的碳可用于根分泌[38]。
根系分泌碳可能还与根系中可溶性糖含量有关,Karst等[40]发现杨树根系分泌碳的速率随细根糖浓度的增加而增加。Nigel等[41]认为根系分泌物的量与根中可溶性糖的浓度密切相关,他们推断,根系分泌物主要是可溶性糖。但是本研究中根系分泌物与根可溶性糖之间并无显著的相关性。因此笔者推测,玉米根系分泌物中主要成分有大量非糖化合物。这也可能与不同植物的根细胞膜通透性和根细胞质有关[42]。
根系分泌物的收集方法一直以来是限制根系分泌物相关研究的主要因素之一,目前根系分泌物收集方法主要有溶液培养收集法、基质培养收集法、土壤培养收集法、原位收集法。基于上述基本收集方法,许多研究者加以改进创造了许多更为实用的收集技术[43-46],但是各种方法仍有其一定的局限性。整体来看,根系分泌物收集技术仍然有很大的进步需求,尤其是在提取植物在自然状态下的根系分泌物方面,难以同时达到不伤根系、避免土壤和微生物的影响、定向收集根系分泌物等条件。本试验则是采用土培和水培结合的方式收集根系分泌物,该方法技术简单、易于操作;根系生长情况受土壤摩擦力影响,能从一定程度上反映植株根系自然状态下的生长状况。但是该方法仍有诸多需要改善的地方。最主要的是取样时难以确保植株根系的完整性,细根部分容易损失,且会对根系造成一定损伤,提取根系分泌物难免会收集到根系的伤流液和内容物。其次,受盆栽桶空间的影响,植株的根冠比与田间条件相比较低[8]。因此,笔者认为使用该方法时应尽量使用易于冲洗的基质培养植物,以减少根系的损伤和土壤带来的干扰,且该方法更适用于研究直根系或者生物量较小的植株。这套方法收集根系分泌物时间较短但量大,受微生物分解影响小,适合用于研究植株根系分泌物的成分。
本研究发现玉米根系特征和叶面积与根系分泌碳、氮量有显著的相关性。回归分析表明玉米EIroot-C、EIroot-N与比根长、比根表面积、比根体积、根系C/N比、根冠比等根系指标呈显著的线性相关;玉米EIplant-C与根长、根表面积、根体积、根干重、根冠比、叶面积之间呈极显著的二次曲线相关,而玉米EIplant-N与根冠比之间呈极显著二次曲线相关。可依据该数量关系利用根系特征估算玉米根系分泌碳、氮量,为评价玉米农田土壤碳、氮动态提供一定的参考。
