硫酸介质中甘氨酸复合缓蚀剂的研究
2021-09-03易家宝黄文恒彭亚梅
易家宝,邹 振,黄文恒,彭亚梅
(1 廉江市政业新材料有限公司,广东 湛江 524000;2 内江师范学院化学化工学院,四川 内江 641112)
氨基酸类缓蚀剂是一种可通过蛋白质水解得到,且具有生物可降解性的,对环境友好的绿色缓蚀剂。甘氨酸是氨基酸系列二十多个成员中结构最简单的一个[1],且分子中兼具碱性氨基和酸性羧基,在水中可电离,具有很强的亲水性,属于极性氨基酸,溶于极性溶剂,本文研究氨基酸类缓蚀剂及复配对碳钢在硫酸溶液中的缓蚀效果。
1 实 验
1.1 仪器与试剂
FA3204B电子天平,上海天美天平仪器有限公司;CHI660E电化学工作站,上海辰华仪器有限公司;铂电极,上海仪电科学仪器股份有限公司;Ag-AgCl电极,上海格湛仪器仪表有限公司;DF-1015集热式恒温加热磁力搅拌器,上海兴创科学仪器设备有限公司;碳钢电极。
10%H2SO4(AR);碘化钾(AR);甘氨酸(生物试剂);无水乙醇(AR)。
1.2 电化学测定方法
依次用280#、400#、600#、800#、1000#砂纸打磨碳钢电极,至表面成镜面后,用无水乙醇浸泡,蒸馏水水洗,滤纸吸干水分,作为工作电极备用。
本实验应用三电极体系测定电化学曲线。参比电极选用Ag-AgCl电极,辅助电极选用Pt电极,温度设置为恒温30 ℃。将准备好的工作电极置于待测溶液中,待电位基本稳定后,用电化学工作站CHI660E分别测试碳钢在不同体系下的电化学曲线。空白实验设置为10%硫酸溶液,通过电化学方法确定甘氨酸、甘氨酸与碘化钾对碳钢在硫酸溶液中最佳缓蚀浓度和缓蚀机理。
1.2.1 极化曲线法
用极化曲线法测定碳钢在10%H2SO4溶液中,不同浓度下甘氨酸及甘氨酸与碘化钾复配时的极化曲线。电位稳定时间为120 s,Open Circuit Potential-Time(开路电位)测试时间为400 s,扫描范围在(OPC-120 mV,OPC+120 mV)区间之内,扫描速率为1 mV/s。
得到极化曲线后采用三参数法进行非线性拟合[2],得到碳钢在硫酸介质中,不同体系时相对应的腐蚀电流,计算缓蚀效率。缓蚀效率的计算公式如下:
(1)
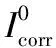
1.2.2 电化学阻抗法
电位稳定时间为120 s,Open Circuit Potential-Time(开路电位)测试时间为400 s,交流阻抗设置的测量频率为0.01~100000 Hz,振幅(A)为5 mV。
2 结果与讨论
2.1 甘氨酸在10%的硫酸介质中对碳钢缓蚀效率的影响
不同浓度下甘氨酸在10%H2SO4溶液中对碳钢的极化曲线见图1,采用三参数法进行非线性拟合得到的电化学参数见表1。
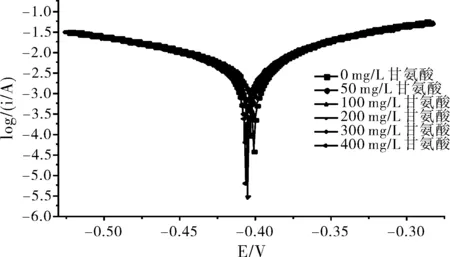
图1 10%H2SO4+不同浓度甘氨酸下的极化曲线Fig.1 Polarizationcurve in the 10% H2SO4+different concentrations of glycine
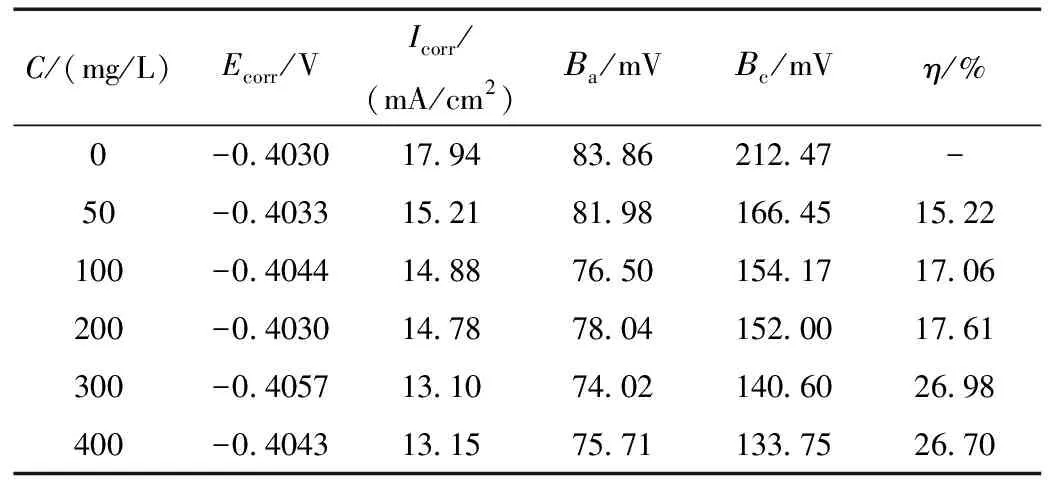
表1 10%H2SO4+不同浓度甘氨酸下的电化学参数Table 1 Electrochemicalparameters in the 10% H2SO4 + different concentrations of glycine
由图1和表1可以看出,与空白实验对比,加入甘氨酸后,随着甘氨酸浓度的增大,腐蚀电位基本稳定,但阴极和阳极的塔菲尔反应系数均在减小,腐蚀电流密度下降,说明加入甘氨酸后碳钢在10% H2SO4体系中的腐蚀减缓。
随着甘氨酸浓度增加到一定值时,腐蚀电流密度不再下降,缓蚀效率趋于平缓,说明甘氨酸对硫酸介质中的碳钢缓蚀效率是有上限的。当甘氨酸的浓度为300 mg/L时,缓蚀效率最大为26.98%,表明缓蚀效果并不十分理想。
2.2 甘氨酸复配的研究
2.2.1 甘氨酸复配对电化学阻抗的影响
碳钢在10% H2SO4+300 mg/L甘氨酸+不同浓度的KI复配溶液中的电化学交流阻抗图见图3。采用ZSimp Win软件等效电路图R(QR)进行阻抗数据分析,得到的电化学参数见表2。
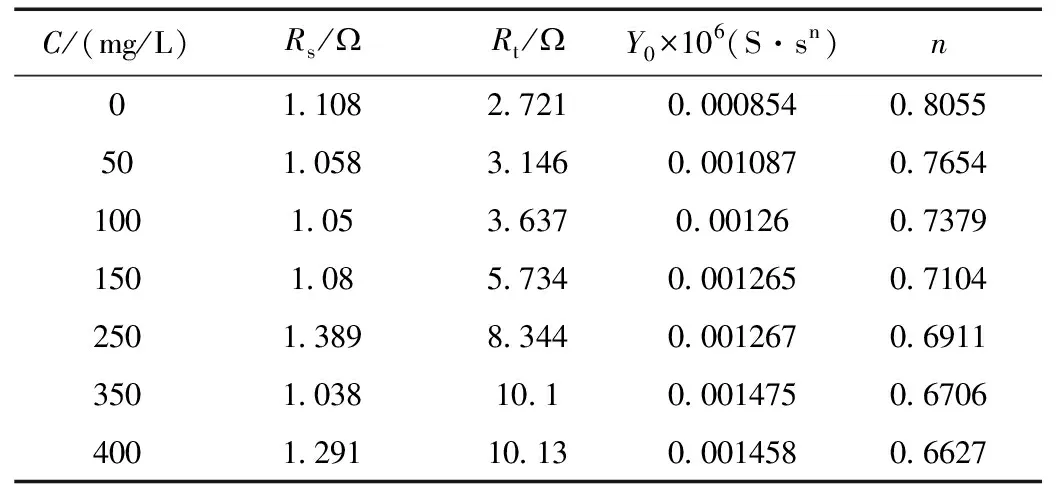
表2 300 mg/L甘氨酸+10% H2SO4+不同浓度的KI介质中的交流阻抗参数Table 2 Thecommunication impedance parameters in the 300 mg/L glycine +10% H2SO4 medium+different concentrations of KI
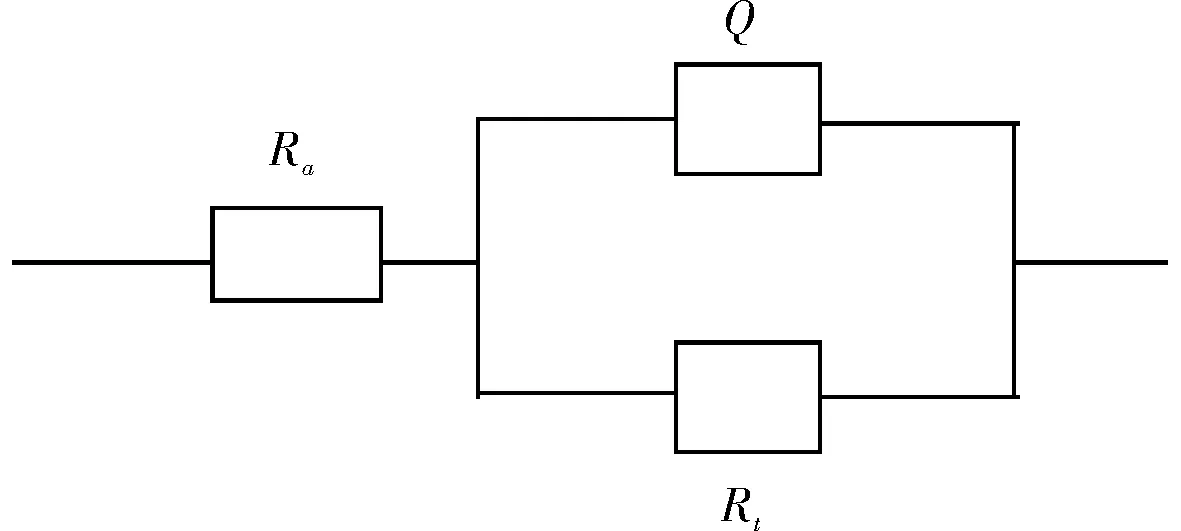
图2 等效电路图Fig.2 Equivalentcircuit diagram
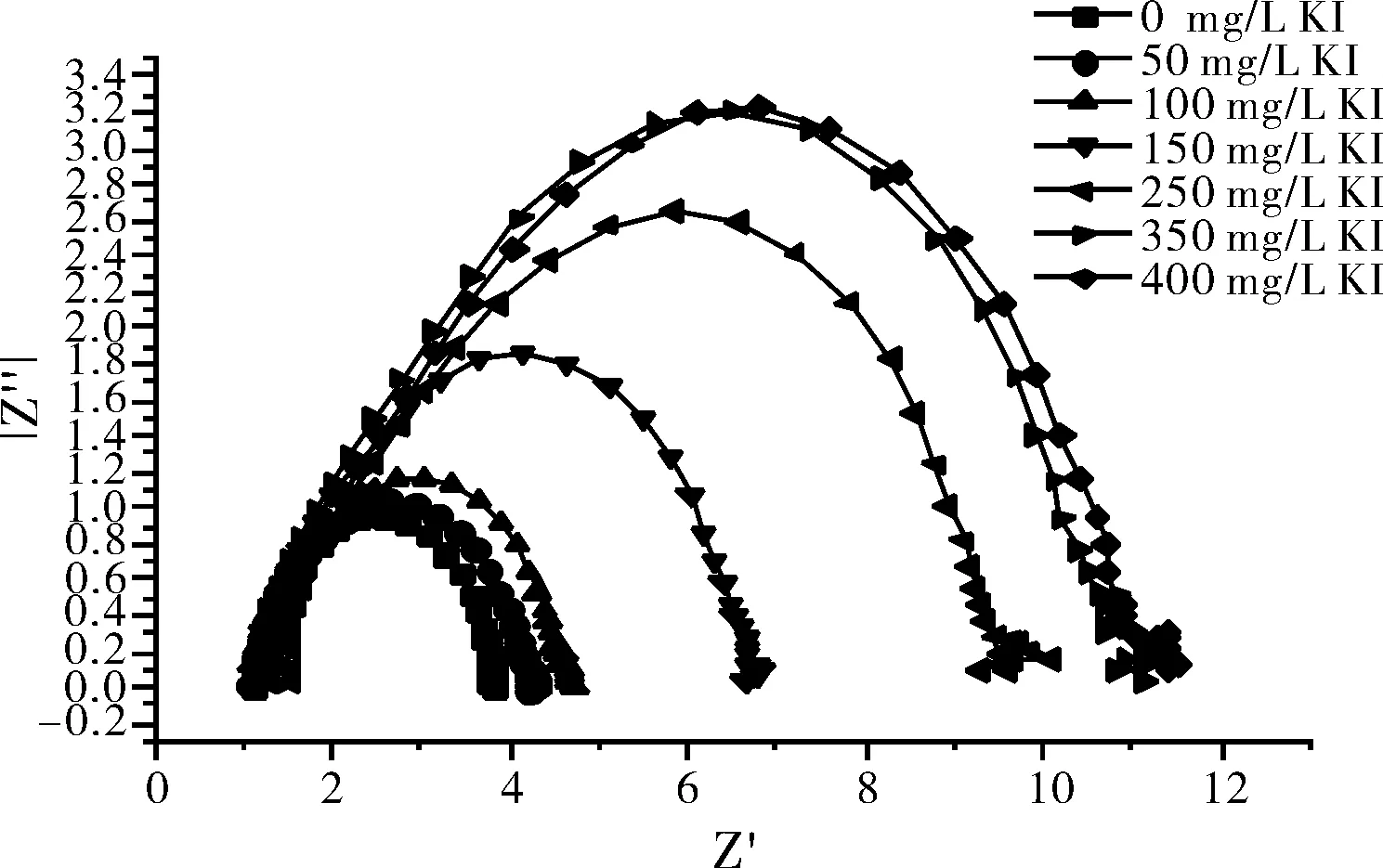
图3 300 mg/L甘氨酸+10% H2SO4+不同浓度的KI介质中的 交流阻抗曲线Fig.3 The A.C impedancecurve in the 300 mg/L glycine + 10% H2SO4 medium+different concentrations of KI
其中RS表示溶液电阻,Rt表示极化电阻,Q表示具有弥散效应的界面电容。
由图3和表2可以看出,随缓蚀剂浓度的增加,阻抗图高频区的容抗弧的半径增大,说明随缓蚀剂浓度的增加,金属腐蚀反应的电荷传递电阻Rt增加,金属发生阳极溶解的阻力增大,电极的耐腐蚀性能增强,缓蚀剂在电极表面上的吸附膜的致密度增加。CPE常数Y0增加,缓蚀剂分子在金属表面发生了吸附,而且缓蚀剂吸附层的界面电容随其覆盖度的增加而增加,而弥散系数n降低,是因为电极表面被缓蚀剂所覆盖,铁离子只能在局部区域穿过缓蚀剂层形成阳极电流,导致电流分布不均匀。
2.2.2 甘氨酸复配对极化曲线的影响
碳钢在10% H2SO4+300 mg/L甘氨酸+不同浓度的KI复配时的极化曲线见图4,采用三参数法进行非线性拟合得到电化学参数见表3,由表1和表3中缓蚀效率与浓度的关系作图如图5所示。
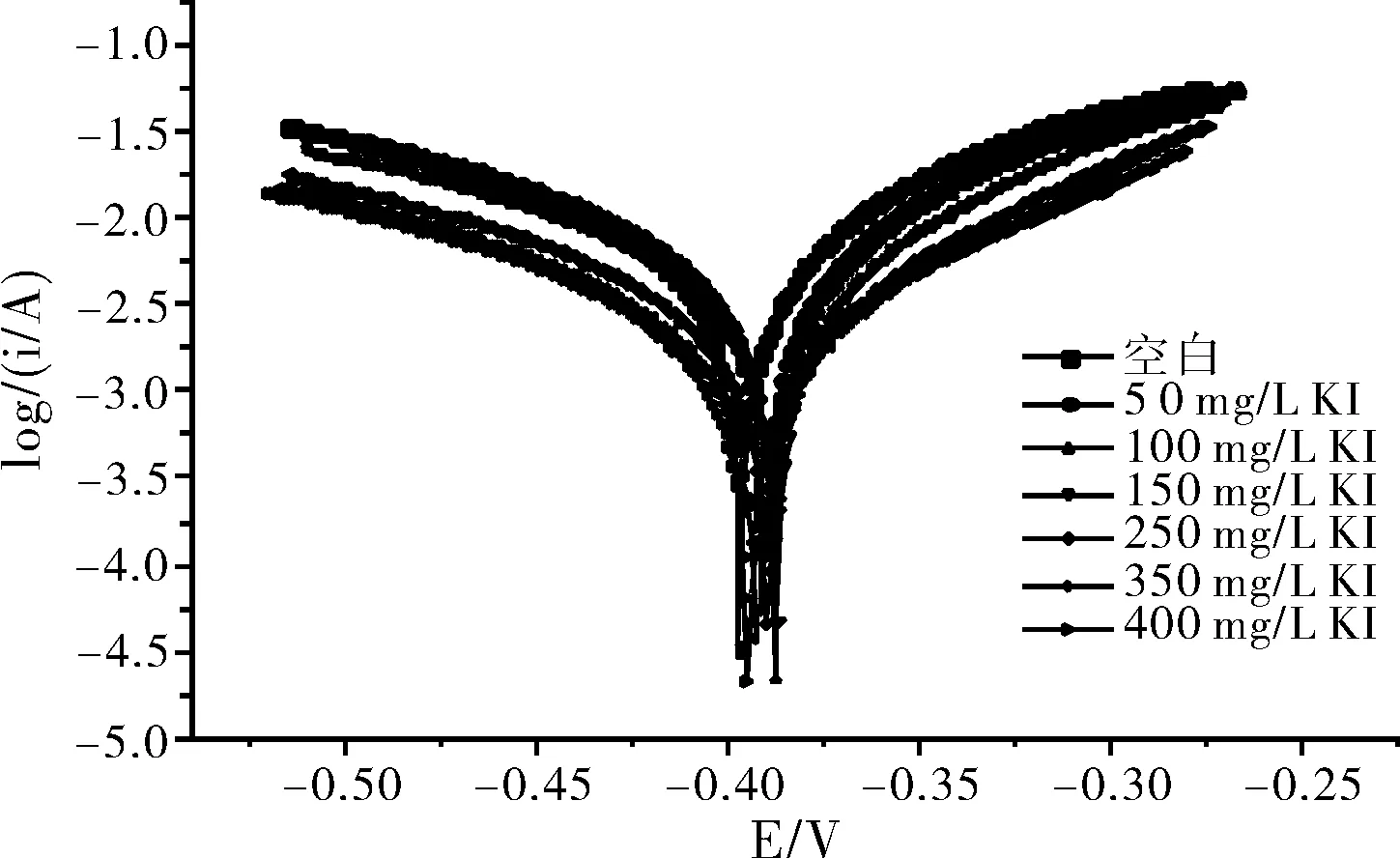
图4 300 mg/L甘氨酸+10% H2SO4+不同浓度的KI介质中的 极化曲线Fig.4 Thepolarization curve in the 300 mg/L glycine +10% H2SO4+different concentrations
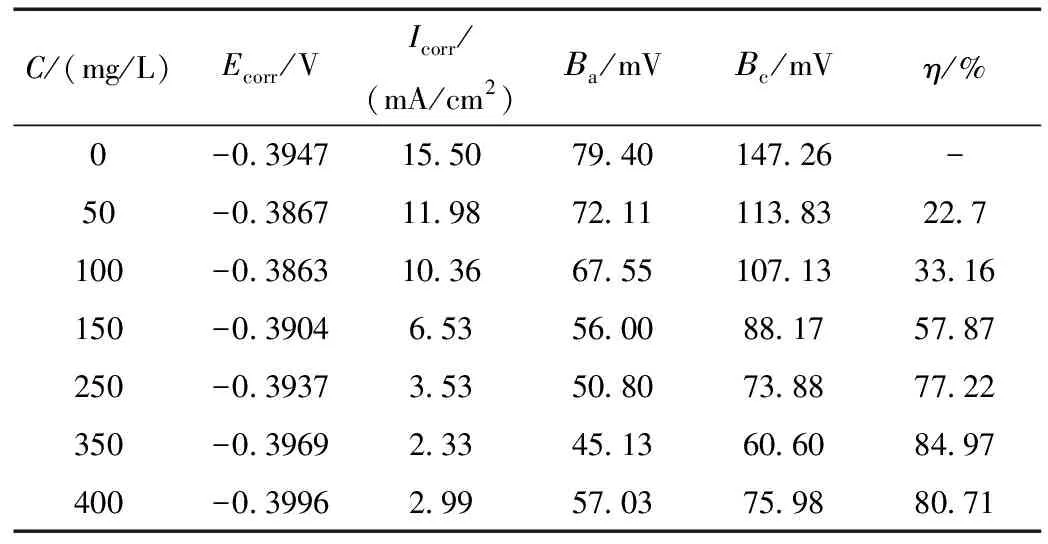
表3 300 mg/L甘氨酸+10% H2SO4+不同浓度的KI介质中的电化学参数Table 3 Theelectrochemical parameters in the 300 mg/L glycine +10% H2SO4+different concentrations
由图4和表3可以看出,相同浓度的甘氨酸与不同浓度的KI组成的复配缓蚀剂,使碳钢在10% H2SO4介质中的腐蚀电流逐渐减小,当碘化钾浓度为350 mg/L时,腐蚀电流最小,即缓蚀效率最大,为84.97%。之后再增大碘化钾浓度,腐蚀电流不在减小,缓蚀效率反而有轻微的下降的趋势。对比表3与表1的各项参数,可以发现表3中的缓蚀效率相比表1增加明显,这表明了甘氨酸与碘化钾之间存在协同效应[3]。
由图5可以看出,甘氨酸和甘氨酸+KI的复配溶液在10%的硫酸介质中均对碳钢表现出了缓蚀效果,且缓蚀效率随着缓蚀剂的浓度增大而逐渐增大。尤其是甘氨酸+KI复配时,缓蚀效果更好。当浓度增大到一定值时,缓蚀效率开始趋于平稳,不再增大,出现这种情况可能是因为缓蚀剂在碳钢表面达到了吸附平衡。
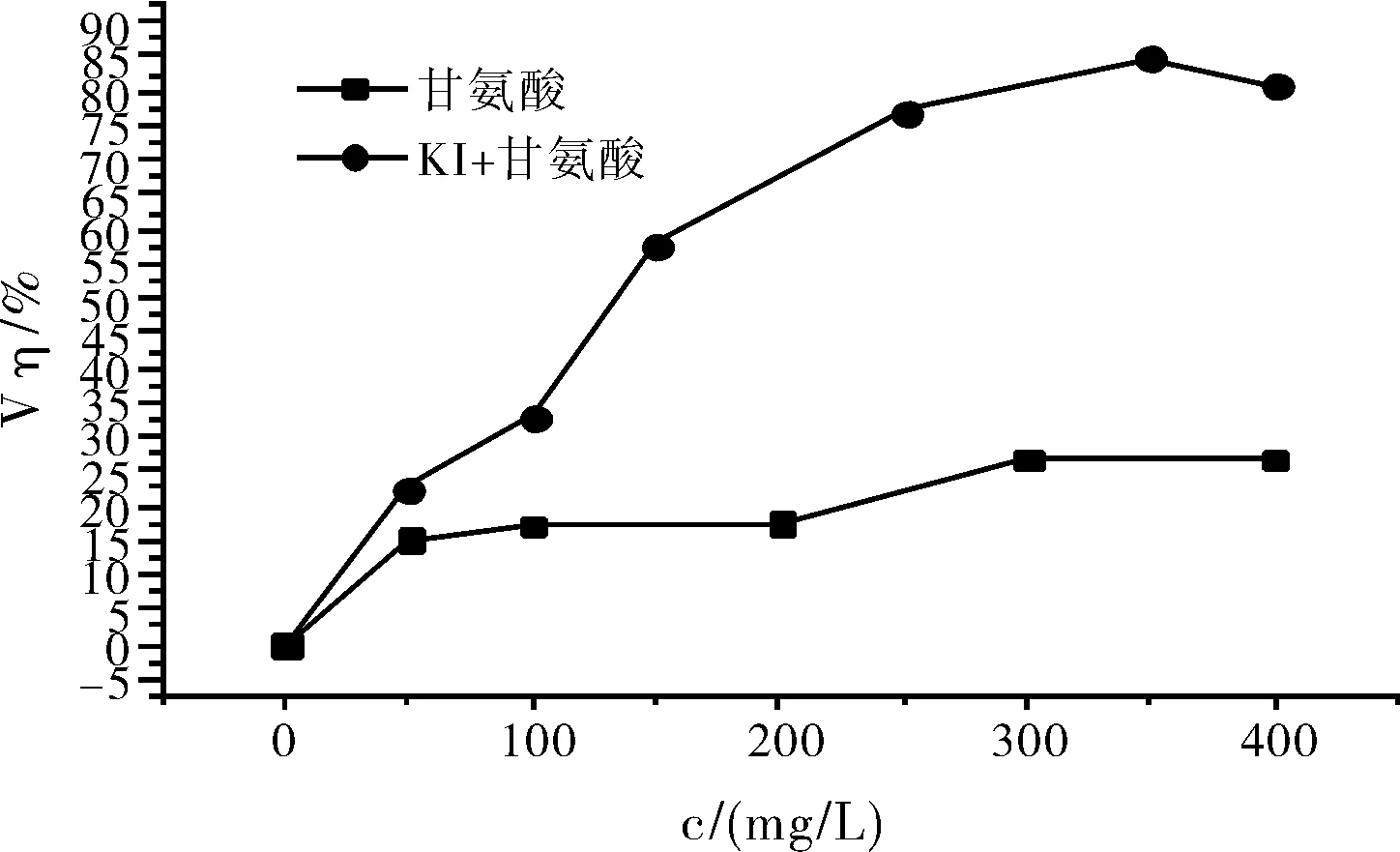
图5 不同浓度甘氨酸和甘氨酸+不同浓度KI复配时的缓蚀效率Fig.5 Corrosion inhibition efficiency of different concentrations of glycine andglycine combined with different concentrations of KI
2.3 缓蚀机理类型的研究
为了明确甘氨酸与碘化钾复配后的缓蚀作用类型,利用表3的数据,计算了在腐蚀电位下缓蚀剂对电化学反应的阳极作用系数fa和阴极作用系数fc[4]。
由表4可以看出,在10%H2SO4介质中加入甘氨酸与KI组成的复配缓蚀剂后,碳钢的阳极作用系数fa和阴极作用系数fc均小于1,这说明加入甘氨酸+KI复配溶液,对10% H2SO4介质中的碳钢的阳极反应和阴极反应均有抑制作用。
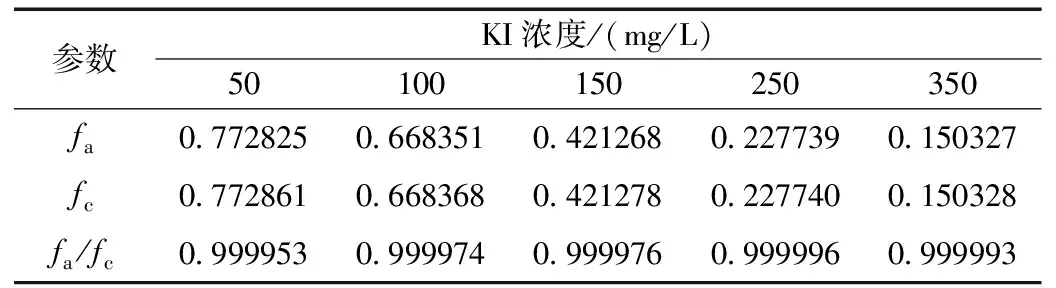
表4 碳钢在10% H2SO4+300 mg/L甘氨酸+不同浓度 KI的作用系数Table 4 Effect coefficient of carbon steel in 10% H2SO4+ 300 mg/L glycine+different content of KI
同一组实验,在10% H2SO4介质中加入甘氨酸与KI组成的复配缓蚀剂后,碳钢的阳极作用系数fa和阴极作用系数fc相当接近,这表明甘氨酸与KI组成的复配缓蚀剂对于抑制碳钢在10% H2SO4介质中的阳极反应和阴极反应是等效的。故此甘氨酸与KI的复配缓蚀剂应是混合型缓蚀剂。
2.4 吸附等温方程
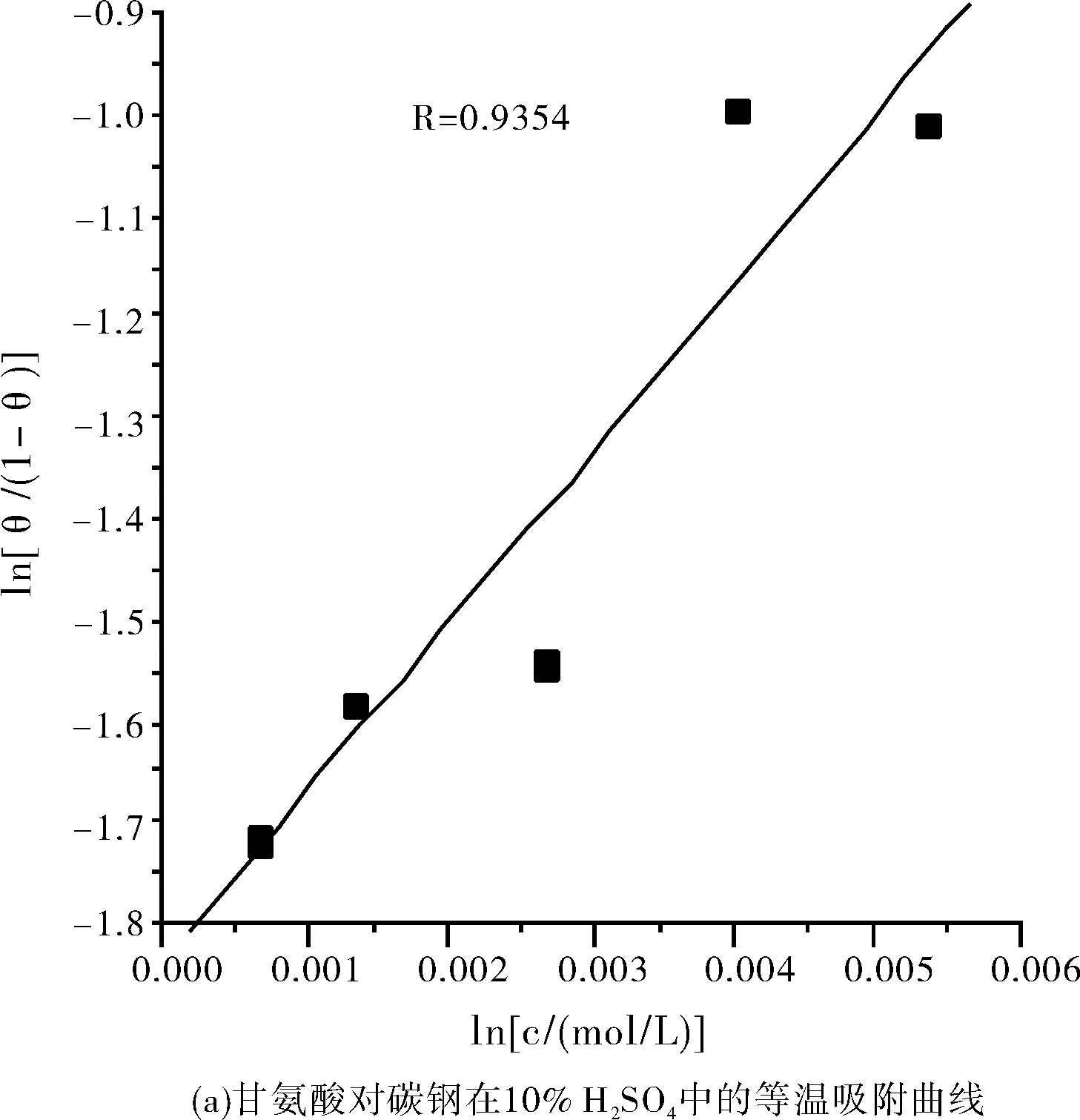
利用表1和表3的数据,采用El-Awady动力学模型对甘氨酸和甘氨酸+KI复配缓蚀剂在碳钢表面的吸附进行拟合[5],拟合出的图形和数据见图6和表5所示。
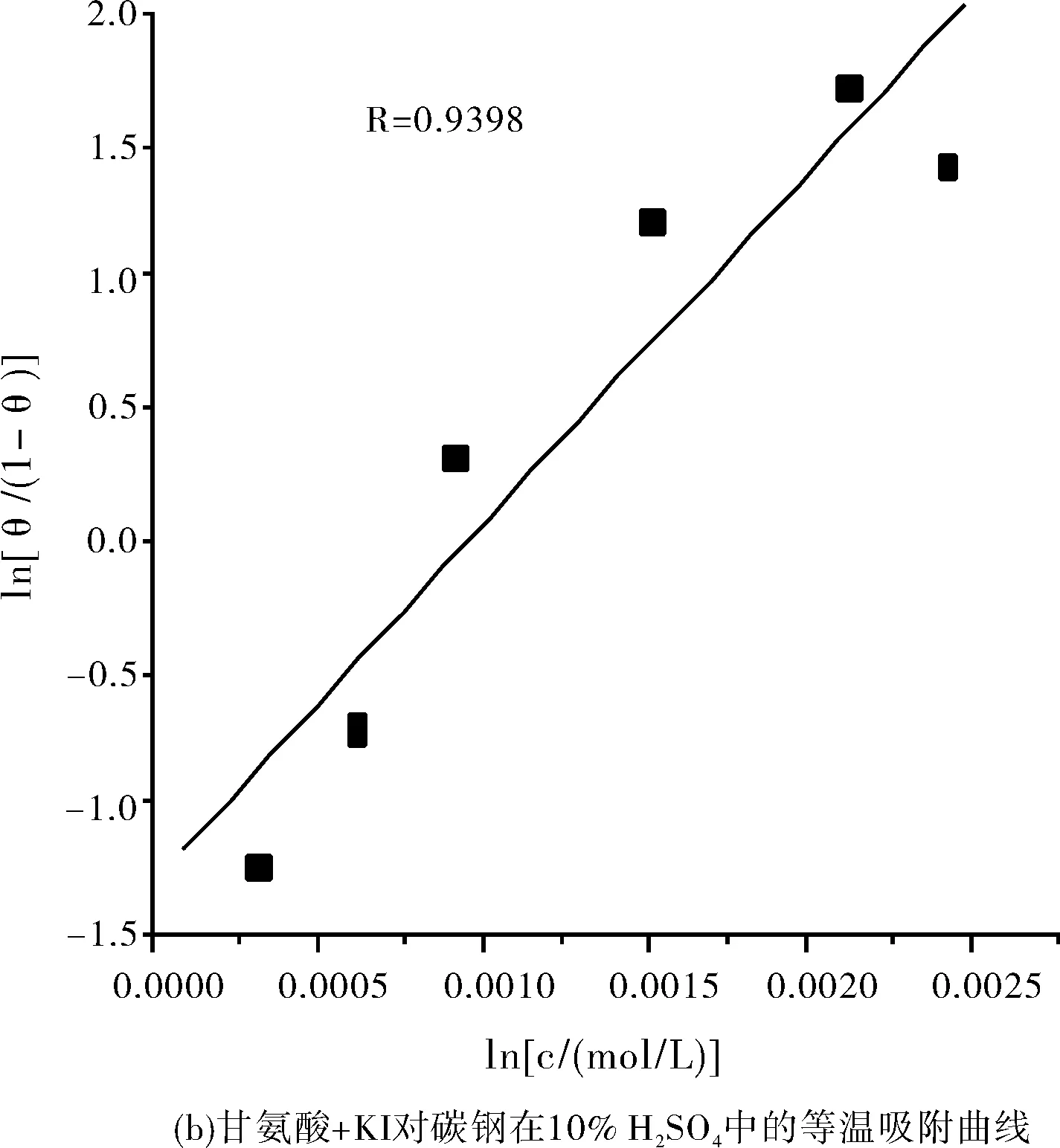
图6 El-Awady动力学模型Fig.6 El-Awady dynamics model
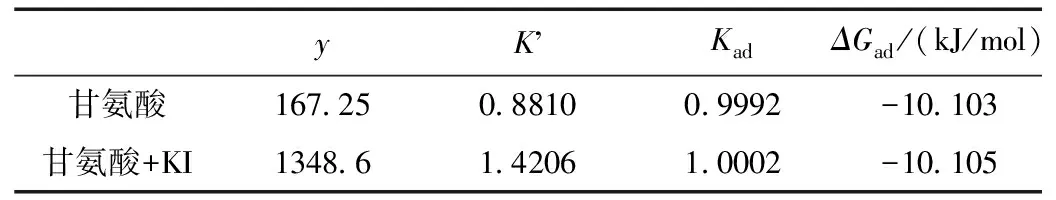
表5 El-Awady模型动力学参数Table 5 Theparameters of isothermal equation
由图6和表5可知,甘氨酸和甘氨酸+KI复配缓蚀剂在碳钢表面的吸附均满足El-Awady动力学模型。因为根据y值的大小可确定吸附分子的吸附形态,又因y值均大于1,表示是一个活性点上吸附多个缓蚀剂分子,故甘氨酸和甘氨酸+KI复配缓蚀剂均属于多分子吸附。
所得的热力学参数ΔGad分别为-10.103 kJ/mol和-10.105 kJ/mol,均小于零,这表明甘氨酸和甘氨酸+KI复配缓蚀剂在碳钢表面的吸附均是自发进行的。
3 结 论
(1)甘氨酸在10%的硫酸介质中对碳钢存在缓蚀作用,但缓蚀效果不明显,当甘氨酸的浓度为300 mg/L时缓蚀效果最好,缓蚀效率为26.98%。
(2)甘氨酸与碘化钾复配后对10%硫酸介质中的碳钢的缓蚀效果明显优于甘氨酸,当甘氨酸的浓度为300 mg/L,碘化钾的浓度为350 mg/L时缓蚀效果最好,缓蚀效率达到84.97%,说明甘氨酸与碘化钾之间存在协同效应。
(3)甘氨酸与碘化钾复配缓蚀剂属于混合型缓蚀剂,在碳钢表面的吸附均满足El-Awady动力学模型,甘氨酸与碘化钾复配缓蚀剂在碳钢表面的吸附是自发进行的,缓蚀机理为多分子层吸附。
