发酵酒中甜蜜素的确证技术分析及解决方案
2021-09-03张书芬张爱芝忻璐琰邢家溧王志强
张书芬,张爱芝,忻璐琰,芦 童,邢家溧,王志强,刘 艳,励 丹,何 怡,袁 伟
(宁波市产品食品质量检验研究院(宁波市纤维检验所),浙江 宁波 315040)
发酵酒是以粮谷、水果、乳类等为主要原料,经发酵或部分发酵酿制而成的饮料酒[1],主要包括葡萄酒、黄酒和果酒等。我国拥有悠久而丰富的酒文化,酒是朋友聚会、大众娱乐不可或缺的元素,但与这种旺盛的消费现状并存的是,一些生产者为了去除发酵酒在发酵过程中产生的苦味,增加口感,在发酵酒中超范围添加甜蜜素。2017-2019年河南省发酵酒中甜蜜素监测结果显示336份发酵酒样品中,甜蜜素不合格率为3.3%[2];2019-2020年福建、浙江、山东等多地都有相关葡萄酒或黄酒中检出甜蜜素的报道,引发社会广泛关注,非法添加甜蜜素成为发酵酒最重要的风险因子。
甜蜜素,化学名为环己基氨基磺酸钠,作为一种食品加工甜味剂,被广泛应用于糕点、饮料、酱腌菜、配制酒等食品中,但过量摄入有致癌、致畸、损害肾功能等副作用[3-6]。为了保证人民的生命安全,GB 2760—2014《食品安全国家标准食品添加剂使用标准》[7]明确规定了甜蜜素在各类食品中的使用量,发酵酒未包括其中。
目前甜蜜素常用的检测方法有气相色谱法[8-9]、液相色谱法[10-11]、液相色谱串联质谱法[12-13]及液相色谱-高分辨质谱法[14-15]。由于发酵酒中添加的甜蜜素含量相对较低,气相色谱法、液相色谱法检测甜蜜素均需进行衍生化处理,且酒中含有的环己醇及环己基等类似物质会与亚硝酸钠反应,生成环己醇亚硝酸酯,造成假阳性的结果,因而我国食品安全国家标准GB 5009.97—2016《食品安全国家标准食品中环己基氨基磺酸钠的测定》[16]中明确规定白酒、葡萄酒、黄酒、料酒中甜蜜素的检测仅能用液质联用法进行检测。与白酒等蒸馏酒不同,葡萄酒、黄酒等发酵酒基质相对复杂,其中含有大量的糖类、单宁及有机酸成分,极易在检测时造成干扰。按照目前国家标准检测时,由于基质干扰,样品中甜蜜素与标准溶液中甜蜜素离子丰度比的偏差经常不能满足液相色谱-质谱法的要求,定性困难[17],存在误判的可能。本实验旨在解决发酵酒中甜蜜素的定性确证困难的问题,以便为食品监管提供更加可靠的数据,保证广大消费者的安全。
1 材料与方法
1.1 材料与试剂
甜蜜素标准品(纯度≥98%):加拿大Torononto Research Chemicals公司;甲醇、乙腈(色谱纯):德国Merck公司;甲酸铵(色谱纯):美国Fisher Chemical公司;乙酸铵(色谱纯):上海麦克林公司。
1.2 仪器与设备
I-CLASS XeVO TQ-XS 超高效液相色谱-三重四级杆质谱仪、WAX固相萃取柱(60 mg,3 mL)、液相色谱柱(ACQUITY UPLCBEHC18(100mm×2.1mm,1.7μm)、ACQUITY UPLC BEH C18(150 mm×2.1 mm,1.7 μm)、ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.7 μm)):美国Waters公司;HHS-21-8数显恒温水浴锅:上海博迅实业有限公司医疗设备厂:Turbovap LV多功能全自动氮吹浓缩仪:英国Biotage公司;VORTEX 2自动涡旋混合器:德国IKA公司;Fotector Plus全自动固相萃取仪:睿科集团股份有限公司;Milli-Q超纯水仪:美国Millipore 公司。
1.3 实验方法
1.3.1 样品前处理
精确称取10 g左右样品于100 mL烧杯中,60 ℃水浴30 min,冷却至室温,转移至100 mL容量瓶中,用水定容至刻度,过0.22 μm水系滤膜,上机分析。当样品中正负扫描通道均出峰,且保留时间与甜蜜素标准溶液一致,但离子丰度比不满足液相色谱-串联质谱定性要求时,不能简单判定为阴性样品,应做如下处理:当上机质量浓度≥200 ng/mL时,稀释20倍后上机分析;当上机质量浓度<200 ng/mL时,取1 mL定容液,加入4 mL 0.1 mol/L HCl,上样于预先活化好的WAX固相萃取柱上(WAX固相萃取柱活化:3 mL甲醇,3 mL水),依次用3 mL水、3 mL甲醇淋洗,3 mL 5%氨水甲醇洗脱,洗脱液氮吹至干,以1 mL水溶解,过0.22 μm水系滤膜,上机分析。
1.3.2 标准溶液的配制
准确称取10 mg标准品于10 mL的棕色容量瓶中,以甲醇+水(1∶1)定容至刻度,得到1 mg/mL的储备液,存放于-18 ℃冰箱中,可存放1年。
1.3.3 仪器条件
(1)超高效液相色谱条件
色谱柱:WatersACQUITYTMUPLCBEHC18柱(100 mm×2.1 mm,1.7 μm);柱温:40 ℃;样品室温度:20 ℃;进样体积:3 μL。流动相A:5 mmol/L甲酸铵水溶液;流动相B:甲醇;梯度洗脱程序:0~2.0 min,95%A;2.0~5.0 min,95%~50%A;5.0~5.1 min,50%~10%A;5.1~6.0 min,10%A;6.1~9.0 min,95%A。
(2)质谱条件
离子源:电喷雾电离(electrospray ionization,ESI),采用正负离子同时扫描多反应监测(multiple reaction monitoring,MRM)模式;毛细管电压正离子模式:3.00 kV,负离子模式:2.50kV,锥孔电压:30 V;离子源温度:150 ℃;脱溶剂温度:600 ℃;脱溶剂气流量:900 L/h。
1.3.4 仪器条件对基质效应消除的优化
考察了流动相体系(乙腈-甲酸铵、甲醇-甲酸铵、乙腈-乙酸铵、甲醇-乙酸铵)、色谱柱(ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)、ACQUITY UPLC BEH C18(150mm×2.1mm,1.7μm)、ACQUITYUPLCHSST3(100mm×2.1mm,1.7μm))、梯度洗脱程序、进样体积(7μL、5μL、3μL)及上机液稀释倍数在减弱或消除基质效应方面的作用。
1.3.5 前处理对基质效应消除的优化
前处理方面减小基质效应的基本途径是尽可能将样品净化,SPE固相萃取法是分析检测中最有效、最常用的净化方式之一,因而本实验采用SPE固相萃取法对样品进行净化。并考察SPE固相萃取柱、萃取柱上样液pH以及净化条件对基质效应消除方面的影响。
1.3.6 数据处理
定性测定:在相同实验条件下,样液中被测化合物的保留时间,与标准溶液的保留时间偏差在±2.5%之内,且样品中各组分定性离子的相对丰度与浓度接近的标准工作溶液中对应的定性离子的相对丰度进行比较,偏差不超过表1规定的范围,方可判定为样品中存在对应的被测物。

表1 定性分析时相对离子丰度的最大允许偏差Table1 Maximum allowable deviation of relative ion abundance in qualitative analysis
定量测定:采用Masslynx4.1软件处理数据,以Masslynx 4.1和Microsoft word 2007软件分析并绘图。
基质效应:基质效应是残留检测中普遍存在的现象,本实验通过基质匹配标准溶液与同浓度溶剂标准的响应强度对比进行基质效应的考察,其计算公式为:

2 结果与分析
2.1 基质效应的消除
2.1.1 仪器方面基质效应的消除
(1)流动相体系的选择
流动相的组成不仅会影响到目标化合物的保留时间和峰型,亦会影响到离子化效率,从而影响灵敏度。在质谱条件摸索时,发现只有在酸性条件下正离子采集模式才会有响应,因而流动相体系必定为酸性体系。
由图1可知,乙腈-铵盐体系的峰型及灵敏度均不及甲醇-铵盐体系。甲酸铵和乙酸铵对离子化效率的影响不同,同等条件下甜蜜素在甲酸铵体系中响应较乙酸铵稍强。铵盐的浓度对甜蜜素的电离影响较小,而流动相体系的改变对基质效应基本无影响,因而选择以甲醇-5 mmol/L甲酸铵为流动相体系。

图1 流动相体系对发酵酒中甜蜜素分析的影响Fig.1 Effect of mobile phase system on sodium cyclamate analysis in fermented wine
(2)色谱柱的选择
从现有文献和标准来看,甜蜜素的分离多采用C18[19-22]、T3[23]等色谱柱,因而实验比较了Waters公司生产的ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)、ACQUITY UPLC BEH C18(150 mm×2.1 mm,1.7 μm)、ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.7 μm)对甜蜜素的分离效果,结果见图2。由图2可知,甜蜜素在三种色谱柱上均能获得较好的峰型,色谱行为无太大差异,但均不能解决甜蜜素正离子采集模式的基质效应问题。实验最终选择通用型色谱柱ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)作为分离柱。
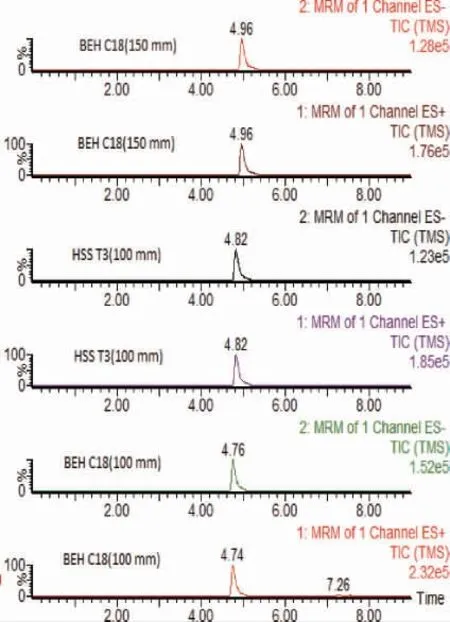
图2 液相色谱柱对发酵酒中甜蜜素分析的影响Fig.2 Effect of liquid chromatographic column on sodium cyclamate analysis in fermented wine
(3)梯度洗脱程序的优化
梯度洗脱程序的改变也是减弱和消除基质效应的有效途径,不同梯度洗脱程序对结果的影响见图3。

图3 流动相梯度对发酵酒中甜蜜素分析的影响Fig.3 Effect of mobile phase gradient on sodium cyclamate analysis in fermented wine
由图3可知,在对甜蜜素标准品进行分离时,通过调节洗脱梯度,甜蜜素在2 min后均可获得良好的峰型,但在分析阴性发酵酒加标样品时发现当出峰时间早于4 min时,甜蜜素负离子采集模式有干扰峰,正离子采集模式增强。调节梯度洗脱程序,发现当甜蜜素在4 min后出峰时,负离子采集模式干扰消除,正离子基质干扰有一定的减小,但仍存在较大的基质效应,实验通过再次延缓梯度洗脱程序,来减小基质效应,效果不理想。当在95%A的等度洗脱的极限条件下,甜蜜素在6 min左右出峰。因而实验选用1.3.3的梯度洗脱程序,此时甜蜜素在4.7 min左右出峰。
(4)进样体积的优化
小体积进样是减小基质效应的一种有效方式,本实验室配备的定量环体积为10 μL,进样体积在2.5~7.5 μL之间定量最为准确,因而考察了进样体积为3 μL、5 μL、7 μL时的基质效应,结果见图4。
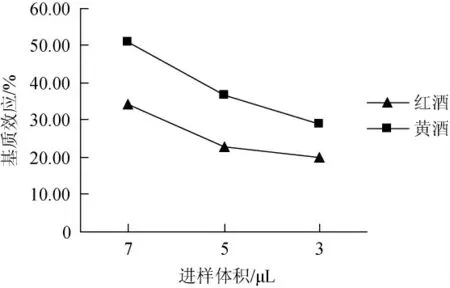
图4 进样体积对基质效应的影响Fig.4 Effect of injection volume on matrix effects
由图4可知,基质效应随着进样体积的减少而呈逐渐减弱趋势后趋于平衡,因而,最后选择以3 μL体积进样。
(5)稀释对基质效应的影响
稀释会减少单位中干扰物含量从而减少对目标分析物电离的影响,试验中经常采取稀释上机液的方式来减小基质效应,稀释对基质效应的影响见图5。

图5 样品稀释对基质效应的影响Fig.5 Effect of sample dilution on matrix effects
由图5可知,当样品稀释20倍时基质效应基本消除,结合仪器的灵敏度,甜蜜素含量为定量限0.1 mg/kg时,对应上机质量浓度为10 ng/mL,那么疑似阳性样品上机质量浓度≥200 ng/mL时,通过稀释的方法即可消除干扰物对正离子模式的干扰,解决了相对离子丰度比超过允许的最大相对偏差,定性困难的问题。
当上机质量浓度<200 ng/mL时,由于值相对较小,考虑到定量限的关系,单纯的稀释已不能解决问题,因而采取前处理净化的方式来减小基质效应。
2.1.2 前处理方面基质效应的消除
(1)SPE固相萃取柱的确定
在前处理方面,SPE固相萃取净化法是消除基质效应最有效、最常用的方式之一。甜蜜素含有磺酸基团,适合采用阴离子交换小柱进行净化,WAX小柱是一种混合型弱阴离子交换反相吸附柱,在酸性条件下填料表面电离带正电,能吸附带负电的环己基氨基磺酸基负离子,在碱性条件下填料表面不带电,可对甜蜜素进行洗脱。因而本实验采用WAX固相萃取小柱进行净化。
(2)SPE固相萃取柱上样液pH的确定
阴离子交换小柱在上样时应处于酸性环境,通过文献调研发现[18],阴离子交换小柱的上柱试样基本由0.1 mol/L HCl进行溶解,以保证目标化合物可以有效保留在小柱上,因发酵酒样品定容液(1.3.1)基本呈现弱酸性偏中性状态,因而在上柱前需经过0.1 mol/L HCl进行稀释,方能满足其要求。0.1 mol/L HCl的pH值为1.0,1 mL定容液上柱前预先采用4 mL0.1 mol/L HCl稀释至其pH为1.0。
(3)SPE固相萃取柱净化条件的确定
实验采取在红葡萄酒和黄酒阴性样品中添加甜蜜素的方式,考察了WAX的净化程序,具体见1.3.1。实验发现,WAX小柱经淋洗后,肉眼基本看不到有色物质,洗脱液也较为清澈,上机分析后发现所有样品基质效应均完全消除,且回收率在可接受范围。
2.2 标准曲线和检出限
将甜蜜素标准溶液逐级稀释成质量浓度为10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL、500 ng/mL、1 000 ng/mL标准溶液,按试验方法进行测定,甜蜜素在10~1000ng/mL范围内线性关系良好,其线性方程为:y=257802x+295.267,其中x为甜蜜素质量浓度,y为响应强度。线性相关系数(R2)为0.999 2,均符合理化检验对线性相关性的规定。
采用向空白样品中逐级降低加标浓度的方法确定方法的检出限,以3倍信噪比、10倍信噪比分别计算方法的检出限和定量限,得到其检出限为0.03 mg/kg,定量限为0.1 mg/kg。
2.3 加标回收率实验
实验对发酵酒按糖度进行分类,对红葡萄酒(干型、半干型、甜型、半甜型)[24]、黄酒(干型、半干型、甜型、半甜型)[25]8种阴性样品中分别添加不同浓度水平的甜蜜素标准溶液,每个添加水平按试验方法平行测定6次,计算回收率、相对标准偏差(relative standard deviation,RSD)及样品中甜蜜素与相当浓度甜蜜素标样的离子丰度比偏差结果见表2。

表2 发酵酒中甜蜜素三个加标水平下的回收率、相对标准偏差及定性数据Table2 Recovery rates,relative standard deviation and qualitative data of sodium cyclamate at 3 spiked levels in fermented wine
由表2可知,经WAX小柱净化,甜蜜素的回收率在82%~109%之间,试验结果相对标准偏差(RSD)为2.2%~8.6%。发酵酒加标样品中甜蜜素与同浓度标样离子丰度比能够满足液相色谱-质谱法定性要求,无定性困难。
2.4 实际样品应用
应用本实验建立的方法对104份不同类型的葡萄酒、黄酒及部分料酒样品进行了分析测定,其中5份干红葡萄酒样品检出甜蜜素,其含量在0.2~1.7 mg/kg之间,1份黄酒样品检出甜蜜素,其含量为2.1 mg/kg,离子丰度比均满足液相色谱-质谱/质谱定性要求。
3 结论
本实验以甲醇-5 mmol/L甲酸铵为流动相体系,采用正负离子同时扫描的方式对发酵酒中甜蜜素进行测定。样品在60 ℃水浴中挥去酒精,用水稀释10倍后上机分析,对甜蜜素进行快速初筛测定,当样品中正负模式下甜蜜素出峰位置同时出峰,离子峰度比不满足液相色谱-串联质谱定性要求时,通过稀释或固相萃取小柱净化的方式进行进一步确认。方法可用于实际样品检测,较好地解决了发酵酒中甜蜜素检测定性困难的问题。
