基于转录组学分析耐高糖酿酒酵母耐受脱氢乙酸钠胁迫的分子机制
2021-09-03裴宇鹏肖泽涛谈亚丽
裴宇鹏,李 啸,2 ,肖泽涛,谈亚丽
(1.三峡大学 生物制药学院 中国轻工业酵母功能重点实验室,湖北 宜昌 443002;2.安琪酵母股份有限公司 湖北省酵母功能重点实验室,湖北 宜昌 443003;3.安琪生物集团有限公司湖北省酵母功能重点实验室,湖北 宜昌 443003)
耐高糖酵母是一种能够在含高浓度糖的环境中进行生长、发酵产生乙醇和二氧化碳的真菌[1],广泛应用于烘焙等食品生产领域。脱氢乙酸钠是一种常用于面包等食品的安全防腐剂,具有抑制霉菌等杂菌生长的作用,但是也会对酵母的增殖造成不利影响[2-3]。有关脱氢乙酸钠的抑菌研究指出,首先脱氢乙酸钠具有弱酸盐类抑制剂通性,其水解产生的脱氢乙酸会穿过细胞的类脂膜,扰乱胞内pH致使细胞酶活性降低[4-5];同时也会对细胞组分造成影响,如改变细胞膜的通透性和形态,还能引起线粒体损伤等[6-7];其次还会影响细胞对物质的吸收与利用,如葡糖的摄取与氨基酸的合成[7];最后抑制了细胞内的呼吸作用,使能量代谢紊乱[8-9]。然而,有关脱氢乙酸钠的抑菌研究大多集中在细胞水平以及生理生化水平,缺乏分子水平的证据。
因此,本研究采用0.3 g/L脱氢乙酸钠处理处于对数生长期的耐高糖酿酒酵母(Saccharomycescerevisiae)BH1,以未处理组为对照,通过核糖核酸测序(ribonucleic acidsequence,RNA-Seq)技术对其进行转录组测序及分析,并对差异表达基因(differentially expressed genes,DEGs)进行基因本体论(gene ontology,GO)与京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集分析,并用实时荧光实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)对结果进行了验证,初步探究耐高糖酿酒酵母耐脱氢乙酸钠的分子机制,为构建及优化耐脱氢乙酸钠菌株提供科学依据和理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
耐高糖酿酒酵母(Saccharomyces cerevisiae)BH1:安琪酵母股份有限公司。
1.1.2 试剂
脱氢乙酸钠(分析纯):上海麦克林生化科技有限公司;蔗糖(食品级):广西凤糖制糖有限责任公司;酵母浸粉:安琪酵母股份有限公司;磷酸二氢钾、七水硫酸镁(均为分析纯):西陇化工股份有限公司;Total RNA Extractor提取试剂盒:生工生物工程(上海)股份有限公司;PrimeScriptTMRT-PCR试剂盒:宝生物工程(大连)有限公司;SYBR Green RT-PCR试剂盒:南京诺唯赞生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[10]:葡萄糖2%,酵母膏1%,蛋白胨1%;115 ℃高压蒸汽灭菌20 min。
分批发酵培养基[11]:蔗糖100 g/L,酵母浸粉20 g/L,KH2PO41g/L,MgSO4·7H2O1g/L;115℃高压蒸汽灭菌20min。
1.2 仪器与设备
SP-752型紫外可见分光光度计:上海光谱仪器有限公司;FUS-50 L型全自动发酵罐:上海国强生化工程装备有限公司;QYC-211型恒温摇床:苏州威尔实验用品有限公司;HiSeq X Ten型高通量测序仪:美国Illumina公司;实时荧光定量PCR检测系统:美国Bio-Rad公司。
1.3 方法
1.3.1 耐高糖酿酒酵母BH1种子液制备
将保藏于甘油管的耐高糖酿酒酵母BH1接入装液量为20 mL/250 mL的YEPD培养基中,30 ℃、180 r/min条件下培养24 h。再将复壮后的菌液按10%(V/V)的接种量接入分批发酵培养基,30 ℃、180 r/min条件下培养12 h,作为种子液备用。
1.3.2 不同质量浓度的脱氢乙酸钠对耐高糖酿酒酵母BH1生长的影响
将种子液按10%(V/V)的接种量接种于装液量为45 mL/250 mL的分批发酵培养基,30 ℃、180 r/min条件下培养;在发酵4 h时,向发酵液中分别添加0、0.005 g、0.010 g、0.015 g、0.020 g和0.025 g脱氢乙酸钠。培养过程中,每隔1 h取样,采用紫外可见分光光度计在波长600 nm处测定菌液的OD600nm值,根据不同质量浓度的脱氢乙酸钠对酵母生长的抑制情况来确定其合适的添加质量浓度。
1.3.3 脱氢乙酸钠胁迫下耐高糖酿酒酵母BH1的发酵过程研究
将种子液按10%(V/V)的接种量接种于装有18 L分批发酵培养基的50 L发酵罐中,于初始pH值4.8、温度30 ℃、转速200 r/min、罐压0.035 MPa、通气量40 L/min的条件下培养,在耐高糖酵母发酵对数期(4 h),向处理组(SD2G)加入脱氢乙酸钠6 g,使发酵液中脱氢乙酸钠的质量浓度达到0.3 g/L。对照组(CG)不添加脱氢乙酸钠,两组pH值维持在4.35,发酵12 h。每隔1 h取发酵液50 mL,发酵液稀释到合适倍数后,采用紫外可见分光光度计在波长600 nm处测定菌液的OD600nm值。另外采用亚甲基蓝染色法进行酵母活细胞计数,并计算出死亡率[12]。实验重复3次,数据为3次的平均值。
1.3.4 脱氢乙酸钠胁迫下酵母转录组数据测序及分析
在耐高糖酿酒酵母BH1发酵过程中,取发酵6 h时的对照组与处理组菌液1.5 mL,在液氮中速冻10 min,于-80 ℃保存备用,实验重复3次,委托深圳华大基因进行转录组测序,测序所得的数据经质控后得到Clean reads,与酿酒酵母模式菌株S288c的基因组序列进行比对,然后进行基因和转录本定量分析、基于基因表达水平的各项分析,并对筛选出的样品间差异表达基因进行GO功能显著性富集分析、KEGG代谢通路显著性富集分析等更深入的挖掘分析[13]。
1.3.5 实时荧光定量PCR验证
采用PrimeScriptTMRT-PCR试剂盒对样本核糖核酸(ribonucleic acid,RNA)进行反转录合成互补DNA(complementaryDNA,cDNA),进而采用实时荧光定量PCR检测系统和SYBR Green RT-PCR试剂盒进行验证实验,所有实验重复3次。内参基因β-actin[14]及转录组学数据中随机挑选的10个差异表达基因的引物序列见表1。

表1 实时荧光定量PCR引物序列Table1 Sequences of real-time fluorescent quantitative PCR primers

续表
2 结果与分析
2.1 脱氢乙酸钠对耐高糖酿酒酵母BH1生长的影响
不同质量浓度的脱氢乙酸钠对耐高糖酿酒酵母BH1生长的影响见图1。

图1 不同质量浓度的脱氢乙酸钠对耐高糖酿酒酵母BH1生长的影响Fig.1 Effect of different concentrations of sodium dehydroacetate on the growth of high-glucose resistant Saccharomyces cerevisiae BH1
由图1可知,不同质量浓度的脱氢乙酸钠对耐高糖酿酒酵母BH1的生长繁殖有不同程度的抑制作用,且质量浓度越高,抑制作用越强。为了获得有较为明显抑制效果的转录组学数据,本研究选择质量浓度为0.3 g/L的脱氢乙酸钠作为后续发酵罐实验的处理条件。发酵罐实验中,0.3 g/L脱氢乙酸钠对耐高糖酿酒酵母BH1生长的影响见图2和图3。

图2 50 L发酵罐中0.3 g/L脱氢乙酸钠对耐高糖酿酒酵母BH1生长的影响Fig.2 Effect of 0.3 g/L sodium dehydroacetate on the growth of high-glucose resistant Saccharomyces cerevisiae BH1 in a 50 L fermenter
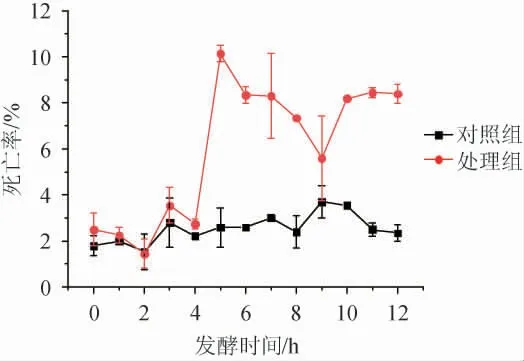
图3 50 L发酵罐中0.3 g/L脱氢乙酸钠处理后耐高糖酿酒酵母BH1的死亡率Fig.3 Mortality of high-glucose resistant Saccharomyces cerevisiae BH1 after 0.3 g/L sodium dehydroacetate treatment in 50 L fermentor
由图2可知,在发酵前4 h,处理组与对照组中耐高糖酿酒酵母BH1的生长情况无显著差异(P>0.05),在第4小时向处理组添加0.3 g/L脱氢乙酸钠后,耐高糖酿酒酵母BH1的生长速度明显放缓,且生长至10 h时,其OD600nm值达到稳定。此时,二者的OD600nm值有显著差异(P<0.05)。
由图3可知,处理组中添加0.3 g/L脱氢乙酸钠后,耐高糖酿酒酵母BH1死亡率提高,但死亡率始终维持在10%以下,与对照组中酵母细胞的死亡率相差不大。综上可知,添加0.3 g/L的脱氢乙酸钠对耐高糖酿酒酵母BH1增殖具有明显的抑制作用,但是其在一定程度上也能适应这种胁迫。
2.2 测序数据质控
测序数据的质量水平直接决定后续测序结果的准确性,对测序所得的原始数据进行质控,其结果见表2。

表2 测序数据统计结果Table2 Statistics results of sequencing data
由表2可知,处理组与对照组中质控后的数据其Q20值>95%,Q30值>90%,表明转录组测序结果良好,可用于后续分析。
2.3 差异表达基因筛选
对处理组(SD2G)和对照组(CG)的差异表达基因(DEGs)进行分析,筛选阈值设为:q值<0.05且log2(差异表达倍数)>1。结果共筛选出723个差异表达基因,其中上调基因253个,下调基因470个。由DEGs绘制的差异火山图见图4,其中横坐标代表差异倍数值,纵坐标代表显著性值。由图4可知,处理组(SD2G)和对照组(CG)间存在一定量的差异表达基因,且部分基因的表达倍数较大,有利于后续的深入分析。
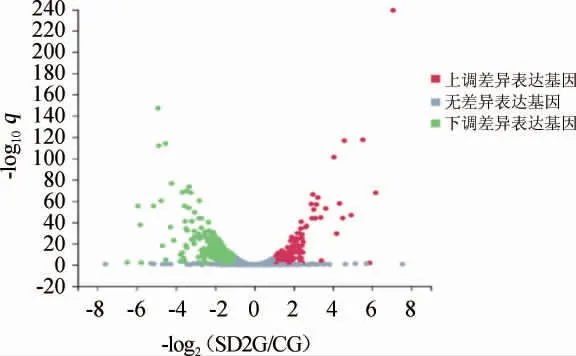
图4 处理组与对照组耐高糖酿酒酵母BH1差异表达基因的火山图Fig.4 Volcano plot of differentially expressed genes of high-glucose resistant Saccharomyces cerevisiae BH1 in treatment group and control group
2.4 差异表达基因功能富集和信号通路分析
GO数据库(http://www.gEneontology.org/)是基因功能数据库,主要分为生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)[16]。差异表达基因的GO富集分析结果见图5。

图5 差异表达基因的基因本体论富集分析结果Fig.5 Results of gene ontology enrichment analysis of differentially expressed genes
由图5可知,大多数DEGs主要富集到细胞质翻译、核糖体、跨膜运输、脱氧核糖核酸(deoxyribonucleic acid,DNA)的合成、氧化还原和铁离子的稳态等过程。KEGG数据库(http://www.Genome.jp/kegg/)是有关基因通路的主要公共数据库,主要分为细胞过程、环境信息处理、遗传信息处理、代谢和有机系统[17]。差异表达基因的KEGG富集分析结果见图6。由图6可知,显著富集通路涉及次级代谢产物的生成、核糖体、氨基酸的合成、碳代谢、二氧代羧酸代谢、氧化磷酸化、糖酵解、三羧酸循环(tricarboxylic acid cycle,TCA)、泛素蛋白水解和三磷酸腺苷结合盒(adenosine triphosphate binding cassette,ABC)转运体等。
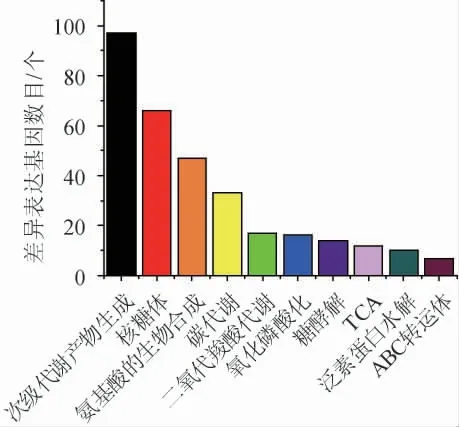
图6 差异表达基因的京都基因与基因组百科全书富集分析结果Fig.6 Results of Kyoto Encyclopedia of Genes and Genomes enrichment analysis of differentially expressed genes
2.5 脱氢乙酸钠对酵母细胞代谢过程的影响
2.5.1 酵母胞内蛋白的合成与分解代谢
通过对DEGs进行KEGG富集分析,发现核糖体通路中所有DEGs下调表达,其中基因RPS22A与RPS12共同编码核糖体40S亚基蛋白,是核糖体的重要组成部分[18],而核糖体合成量的减少会抑制蛋白质的翻译。另外在氨基酸的生物合成中有41个DEGs显著下调表达,有10个DEGs富集到赖氨酸的生物合成途径,其中包括共同编码高柠檬酸合酶(homocitrate synthase,HCS)的基因LYS20和LYS21,该酶催化了第一步合成赖氨酸的反应[19],同时编码后续合成反应的催化酶的基因也下调表达,所以细胞内的赖氨酸合成量可能不足。ALMIEDA B等[20]研究发现,乙酸胁迫会引起酿酒酵母胞内的氨基酸饥饿,这与脱氢乙酸钠的胁迫有相似之处。有大量的上调DEGs集中在泛素依赖的蛋白分解途径,其中基因CUL3和HRT1共同参与编码E3泛素连接酶复合物,该酶合成的增加能促进蛋白质的修复与折叠[21-22]。综上所述,脱氢乙酸钠可能引起了胞内氨基酸的缺乏和翻译紊乱,以致细胞内的蛋白质无法正常合成。另外,酵母会加强泛素依赖的蛋白水解途径以抵御脱氢乙酸钠的胁迫。
2.5.2 酵母胞内能量代谢
由图5可知,KEGG富集到了糖酵解、TCA和氧化磷酸化途径,这些都与细胞内能量代谢紧密相连。其中,基因HXK1和PYK2都下调表达,它们分别编码己糖激酶和丙酮酸激酶,这两个酶是糖酵解反应的限速酶,其合成通量的减少意味着糖酵解反应受到抑制。TCA中除了编码苹果酸脱氢酶的基因MDH2和编码柠檬酸缩合酶的基因CIT2上调表达外,其他10个DEGs均下调表达,所以整体来看TCA被抑制。氧化磷酸化中富集到的16个DEGs全部下调表达,例如基因SDH1、SDH2和SDH4共同编码电子传递链上的琥珀脱氢酶(复合体Ⅱ);基因CYC1用于调控细胞色素c的合成,而细胞色素c承担复合体Ⅲ和Ⅳ之间电子传递的作用,这些基因的下调表达表明了脱氢乙酸钠干扰线粒体中电子传递链的正常运作。值得注意的是线粒体中的下调DEGs编码的酶大多含有铁离子结合位点,因此推测,脱氢乙酸钠可能消耗了细胞内铁离子导致这些酶的合成减少,进而使得TCA与氧化磷酸化过程被抑制,最终酵母细胞难以产生和利用能量。ZHU X L等[23]研究表明天然药物活性成分厚朴酚可能会络合酵母细胞内的铁离子从而引起TCA和呼吸链相关的基因的下调表达,这与本研究结果有相通之处。总体来说,脱氢乙酸钠严重干扰了耐高糖酿酒酵母BH1细胞内的能量代谢,使其生长和繁殖受到抑制。
2.5.3 酵母胞内铁离子稳态和ABC转运体
在上调的DEGs里发现了一组与铁离子稳态相关的基因,它们涉及了铁元素的吸收、转运及利用。其中基因FIT2和FIT3共同编码糖基磷脂酰肌醇糖锚整合入细胞壁的甘露糖蛋白,可促进细胞对环境中铁的吸收,还可能用于铁元素的储藏[24];而基因LOS1编码的Ran GTPase结合蛋白参与细胞膜上铁的转运[25];基因SIT1与ARN1参与编码铁氧嘧啶B转运蛋白和铁载体蛋白,后者在脱氧核糖核酸(deoxyribonucleic acid,DNA)复制压力下会大量合成并从质膜转移到液泡[26-27];有报道指出基因TIS11响应于铁缺乏,使出芽的酿酒酵母(Saccharomyces cerevisiae)会进行代谢重塑,以优化铁的利用率[28];最后基因ISU1编码线粒体中的铁结合蛋白是合成Fe/S蛋白簇中所必需的,而Fe/S蛋白是电子传递链上重要的电子载体[29]。此外,编码ABC转运体的基因Pdr5与Snq2在脱氢乙酸钠胁迫下被诱导,两者编码的蛋白能协同将生物异源物质排出质膜[30-32],因此推测酵母细胞可能通过上调ABC转运体排出脱氢乙酸根离子。综上分析,脱氢乙酸钠可能引起了胞内的铁缺乏,而酵母细胞试图通过促进铁吸收及转运以维持细胞内铁代谢平衡,以及通过ABC转运体加速脱氢乙酸根离子的排出来共同抵御外界胁迫。
2.6 实时荧光定量PCR验证结果
随机选取10个显著的DEGs进行qPCR验证实验,包括5个上调基因与5个下调基因,验证结果见图7。

图7 实时荧光定量PCR验证结果Fig.7 Results of real-time fluorescence quantitative PCR verification
由图7可知,qPCR验证结果与转录组测序结果中DEGs在表达幅度上有一定差异,但表达趋势是一致的,说明转录组测序的结果是可信的。
3 结论
本研究初步探讨了耐高糖酵母应对脱氢乙酸钠胁迫的分子调节机制。采用0.3 g/L的脱氢乙酸钠对处于对数生长期的耐高糖酿酒酵母BH1进行处理,以未处理组为对照,采用RNA-Seq技术对其进行转录组测序及分析。结果表明,与对照组相比,处理组有723个DEGs,其中上调基因253个,下调基因470个,通过GO与KEGG富集分析发现脱氢乙酸钠会抑制耐高糖酵母中核糖体、氨基酸的合成、糖酵解、TCA和氧化磷酸化等途径,进而导致胞内蛋白合成困难,能量摄取不足;耐高糖酵母也会上调泛素依赖性蛋白水解和ABC转运体,将合成异常的蛋白水解以及将细胞内的脱氢乙酸根离子排出质膜,以抵御脱氢乙酸钠对细胞代谢活动造成的破坏。另外,酵母细胞试图通过上调众多与铁离子稳态相关的显著DEGs(FIT2,FIT3,LOS1,SIT1,ARN1,TIS11,ISU1)来抵御脱氢乙酸钠引起的胞内铁缺乏。
