喹啉生物碱锌配合物的合成研究
2021-09-03冉思妍陆婷婷邓佑林
周 宁,冉思妍,张 鹏,陆婷婷,高 雷,邓佑林
(河池学院化学与生物工程学院,广西 宜州 546300)
从20世纪开始,癌症的发病率与死亡率一直在上升,手术、化疗和放疗等,是现阶段治疗癌症的主要方法[1-4]。化学药物治疗和其他治疗方法配合,可以在很大程度上控制肿瘤细胞的扩散和转移,提高对恶性肿瘤增殖的抑制效果[5-6]。金属配合物可抑制肿瘤细胞增殖,对多种类的癌细胞有作用,但也存在一些缺点,如有毒副作用、水溶性小、不利于药物吸收等,因此有效克服此类临床药物的毒副作用,成为该领域研究的重点和热点[7-9]。
以具有生物活性的化合物为配体,具有特殊生物活性的金属离子为配位中心进行配位结合,是寻找新型抗肿瘤药物的一种有效的手段。喹啉生物碱具有抗肿瘤、抗疟疾、抗结核、抗菌消炎等重要的药理活性,同时具有很好的平面结构,与金属离子结合后,可与DNA分子发生作用[10-13]。锌拥有良好的配位几何环境和灵活多变的配位数,展现出优异的荧光性能,检测较为方便,同时锌作为人体中含量仅次于铁的必要的微量元素,参与DNA及RNA聚合酶的合成,对维持体内蛋白质的结构和功能有着至关重要的作用[14-15]。
本文以喹啉为原料,金属锌为配位中心,采用热溶剂法合成可能具有抗肿瘤活性的金属配合物,通过红外光谱仪确定其大致结构,紫外-可见光谱仪检测配合物的稳定性。
1 实验部分
1.1 仪器与试剂
仪器:NICOLET6700傅里叶红外变换光谱仪,Agilent8453紫外-可见光谱仪,DF-101S恒温加热磁力搅拌器。
试剂:5-氯-8-羟基喹啉、5,7-二氯-8-羟基喹啉、8-羟基喹啉、硝酸锌、二氯甲烷、三氯甲烷、甲醇、乙醇(均为分析纯)。
1.2 配合物的合成
配合物1的合成:称取1.2009 g的Zn(NO3)2·6H2O和0.5812 g的8-羟基喹啉,置于50 mL圆底烧瓶中,加入8mL无水甲醇和8mL三氯甲烷作溶剂。溶剂加完后溶液显亮黄色,将其置于水浴锅中回流搅拌8h后停止加热,溶液为暗橙色。静置至室温,过滤,收集滤液于25mL小烧杯中,保鲜膜封口后用针扎20个小孔,静置,于室温下缓慢挥发。待液体全部挥发后,取少量固体进行紫外光谱和红外光谱的测定。
配合物2的合成:称取0.5403g的5-氯-8-羟基喹啉和0.8991g的Zn(NO3)2·6H2O置于50 mL圆底烧瓶中,加入 8mL无水甲醇和8mL三氯甲烷作溶剂。溶剂加完后溶液显亮黄色,将其置于水浴锅中回流搅拌8h后停止加热,溶液为亮黄色浊液。静置,待其冷却至室温,过滤,收集滤液于25mL小烧杯中,保鲜膜封口后用针扎20个小孔,于室温下缓慢挥发。待液体全部挥发后,取少量固体进行紫外光谱和红外光谱的测定。
配合物3的合成:称取0.9611g的Zn(NO3)2·6H2O和0.6421g的5,7-二氯-8-羟基喹啉置于50mL圆底烧瓶中,加入 10mL无水甲醇和5mL三氯甲烷作溶剂,溶剂加完后溶液呈黄绿色。将其置于水浴锅中回流搅拌8h,停止加热时溶液为黑褐色。静置,待其冷却至室温,过滤,收集滤液于25mL小烧杯中,保鲜膜封口后用针扎20个小孔,于室温下缓慢挥发。待液体全部挥发后,取少量固体进行紫外光谱和红外光谱的测定。
2 配合物的结构表征
2.1 配合物1的结构表征
图1是配合物1的红外光谱图。由图1可知,1550cm-1的吸收峰是C=C骨架伸缩运动引起的,在3180cm-1有一吸收峰,源于N-H的伸缩振动,2420cm-1的吸收峰是酚羟基的伸缩振动,1384 cm-1的吸收峰是C-H(芳基碳)的伸缩振动引起的,800cm-1的吸收峰是C-H的变形振动引起的。以上几处吸收峰证明了N-H、C=C骨架、C-H(芳基碳)和C-H官能团的存在。
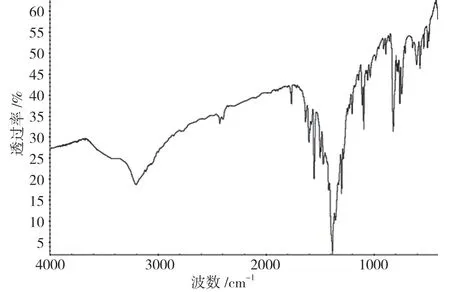
图1 配合物1的FTIP光谱
量 取2×10-3mol·L-1的 储 液30 μL,加 入2970μL、pH=7.45的Tris-HCl-NaCl缓冲液中,使用紫外光谱仪,每隔24h测1次吸光度,结果见图2。由图2可知,随着时间的推移,配合物1未产生明显的红移及蓝移现象,也没有新的吸收峰出现,只有配合物的特征吸收峰产生了一定的减色效应。这可能是配合物在溶液状态下发生了解离或聚合,进而影响了它们的有效浓度。结果表明配合物1在生理条件下能够稳定存在。

图2 配合物1的紫外可见吸收光谱图
2.2 配合物2的结构表征
图3是配合物2的红外光谱图。由图3可知,在3490cm-1有一吸收峰,源于N-H的伸缩振动;2420cm-1的吸收峰是酚羟基的伸缩振动,1386 cm-1的吸收峰则是C-H(芳基碳)的伸缩运动引起的,800cm-1的吸收峰是C-H的变形振动引起的,1590cm-1的吸收峰是C=C骨架的伸缩运动。以上几处吸收峰证明了N-H、C=C骨架、C-H(芳基碳)和C-H官能团的存在。

图3 配合物2的FTIP光谱
取2×10-3mol·L-1的储液30 μL,加入2970 μL、pH=7.45的Tris-HCl-NaCl缓冲液中,使用紫外光谱仪,每隔24h测1次吸光度,结果见图4。由图4可知,随着时间的推移,配合物2未产生明显的红移及蓝移现象,也没有新的吸收峰出现,只有配合物的特征吸收峰产生了一定的减色效应。这可能是配合物在溶液状态下发生了解离或聚合,进而影响了它们的有效浓度。结果表明配合物2在生理条件下能够稳定存在。

图4 配合物2的紫外可见吸收光谱图
2.3 配合物3的结构表征
图5是配合物3的红外光谱图。由图5可知,3480cm-1有一吸收峰,源于N-H的伸缩振动;2420cm-1的吸收峰是酚羟基的伸缩振动,1550cm-1的吸收峰是C=C骨架的伸缩运动,1384 cm-1的吸收峰则是C-H(芳基碳)的伸缩运动引起的,800cm-1的吸收峰是C-H的变形震动引起的。以上几处吸收峰证明了N-H、C=C骨架、C-H(芳基碳)和C-H官能团的存在。

图5 配合物3的FTIP光谱
取2×10-3mol·L-1的储液30 μL,加入2970 μL、pH=7.45的Tris-HCl-NaCl缓冲液中,使用紫外光谱仪,每隔24h测1次吸光度,结果见图6。由图6可知,随着时间的推移,配合物3未产生明显的红移及蓝移现象,也没有新的吸收峰出现,只有配合物的特征吸收峰产生了一定的减色效应。这可能是配合物在溶液状态下发生了解离或聚合,进而影响了它们的有效浓度。结果表明配合物3在生理条件下能够稳定存在。

图6 配合物3的紫外可见吸收光谱图
3 结论
本实验合成了 3个喹啉环金属锌配合物,合成的锌配合物可以通过MTT法进行体外肿瘤细胞活性检测,测定其IC50值,以判断配合物的抗肿瘤活性效果。配合物的抗肿瘤、抗菌活性正在测试中。如果目标产物能测试到较好的生物活性,我们后续还将对其进行作用机理研究。
