IL-33、MIF及PLTP水平与新生儿支气管肺发育不良的关系
2021-09-03杨婕曹霞李翠霞郑莉佳陈国欢
杨婕 曹霞 李翠霞 郑莉佳 陈国欢
支气管肺发育不良(Bronchopulmonary dysplasia,BPD)是新生儿科常见的慢性肺病,多见于早产儿。BPD 发病机制尚未明确,在遗传易感性的基础上,氧中毒、气压伤、炎症等各种因素导致发育不成熟的肺出现损伤,在损伤之后肺部组织异常修复是导致BPD 的关键环节[1]。白介素-33(Interleukin-33,IL-33)属于白介素家族中的一员,与哮喘、自身免疫性疾病、炎性疾病等相关[2]。巨噬细胞移动抑制因子(Macrophage migration inhibitory factor,MIF)在临床中认为具有细胞因子活性的多功能炎性传递物质,参与机体炎症反应、免疫应答、血管形成等,与多种肺部疾病发生有关[3]。磷脂转运蛋白(phospholipid transprotein,PLTP)参与磷脂蛋白之间磷脂酰胆碱(Phosphatidylcholine,PC)的转运,PC 缺乏或合成不足和肺气肿、肺水肿、BPD 发生存在一定的联系[4]。基于此,本文将分析血清IL-33、MIF 及PLTP 水平变化与新生儿BPD 的关系,以期为临床诊疗BPD 提供参考依据。
1 资料与方法
1.1 一般资料
选取2017年5月至2020年5月新生儿科收治的141 例早产儿(胎龄≤30 周),根据是否患有BPD分为非BPD 组(n=63)和BPD 组(n=78)。BPD 诊断标准:参考美国国立儿童健康与人类发育研究中有关BPD 诊断标准:任何氧依赖(FiO2>0.21)超过28 d 新生儿即判定为BPD[5]。纳入标准:①临床资料完整;②研究对象监护人均知晓本次研究并签署知情同意书。排除标准:①合并先天性心脏病、脑颅急性、肺大泡、染色体异常等疾病者;②临床资料不完整;③入院日龄>1 d 者。两组一般资料上比较差异无统计学意义(P>0.05)。见表1。本研究经医院医学伦理委员会批准通过。
表1 一般资料比较[n(%),(±s)]Table 1 General information comparison[n(%),(±s)]
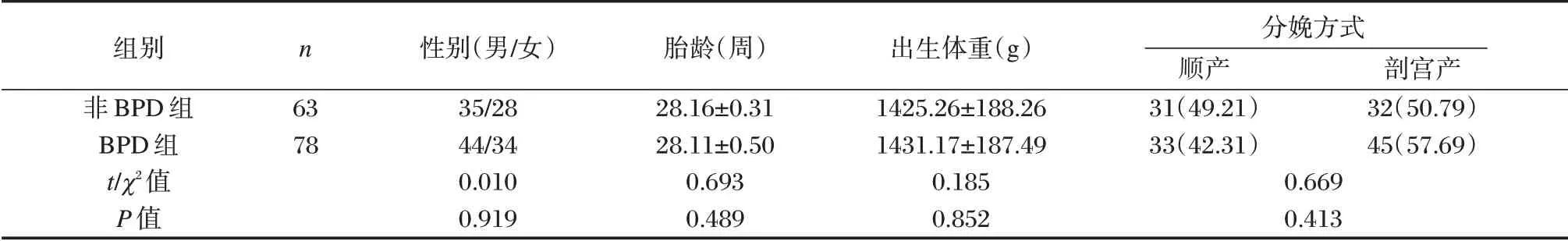
表1 一般资料比较[n(%),(±s)]Table 1 General information comparison[n(%),(±s)]
组别非BPD 组BPD 组t/χ2值P 值n 63 78性别(男/女)35/28 44/34 0.010 0.919胎龄(周)28.16±0.31 28.11±0.50 0.693 0.489出生体重(g)1425.26±188.26 1431.17±187.49 0.185 0.852分娩方式顺产31(49.21)33(42.31)0.669 0.413剖宫产32(50.79)45(57.69)
1.2 方法
1.2.1 病情评价
根据患儿校正胎龄为36 周(出生胎龄<32周)、出院时需要吸入氧浓度FiO2进行评价[6]:未 用氧为轻度,FiO2<0.30 为中度,FiO2>0.30 或需要持续气道正压力通气、机械通气为重度。
1.2.2 IL-33、MIF 及PLTP 水平检测
纳入对象均在入院后的第7 d 静脉采血3 mL,使用离心半径为10 cm,转速为3 000 r/min,的离心机离心10 min 后,分离上清液后置入-80℃冰箱保存,在标本收集完成后进行统一检验。IL-33、MIF 及PLTP 均使用酶联免疫吸附法进行检测,检测试剂由北京百奥莱博科技有限公司,操作步骤严格按照试剂所配套说明书进行,酶标仪为美国伯乐Bio-rad 550。
1.3 观察指标
比较非BPD 组和BPD 组以及不同病情BPD患儿血清中IL-33、MIF、PLTP 水平变化,并分析IL-33、MIF 及PLTP 对BPD 诊断价值。
1.4 统计学方法
采用SPSS 20.0 软件进行统计分析,计量资料采用()表示,组间比较行t检验,多组间比较行F 检验;计数资料采用n(%)表示,行χ2检验;绘制ROC 分析L-33、MIF 及PLTP 对BPD 诊断价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 非BPD 组 和BPD 组 血 清 中IL-33、MIF、PLTP 水平比较
BPD 组血清中IL-33、MIF 水平明显高于非BPD 组,PLTP 水平明显低于BPD 组,差异均有统计学意义(P<0.05)。见表2。
表2 非BPD 组和BPD 组血清中 IL-33、MIF、PLTP 水平比较(±s)Table 2 Comparison of serum IL-33,MIF and PLTP levels between non BPD group and BPD group(±s)
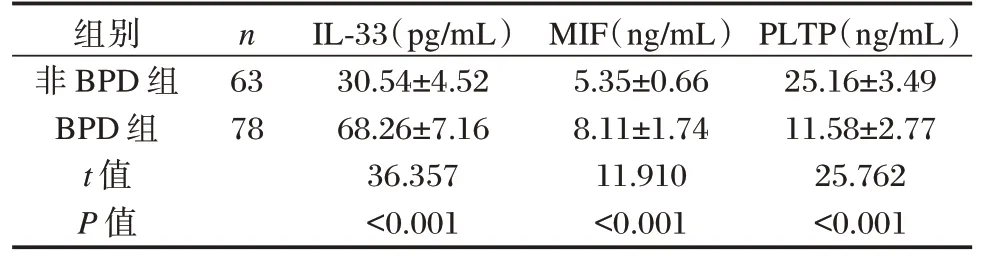
表2 非BPD 组和BPD 组血清中 IL-33、MIF、PLTP 水平比较(±s)Table 2 Comparison of serum IL-33,MIF and PLTP levels between non BPD group and BPD group(±s)
组别非BPD 组BPD 组t 值P 值n 63 78 IL-33(pg/mL)30.54±4.52 68.26±7.16 36.357<0.001 MIF(ng/mL)5.35±0.66 8.11±1.74 11.910<0.001 PLTP(ng/mL)25.16±3.49 11.58±2.77 25.762<0.001
2.2 不同病情程度BPD 患儿血清中IL-33、MIF、PLTP 水平比较
3 组血清中IL-33、MIF 表达水平:轻度组<中度组<重度组,PLTP 表达水平:轻度组>中度组>重度组,差异均有统计学意义(P<0.05)。见表3。
表3 不同病情程度BPD 患儿血清中IL-33、MIF、PLTP水平比较(±s)Table 3 Comparison of serum IL-33,MIF and PLTP levels in children with BPD of different severity(±s)
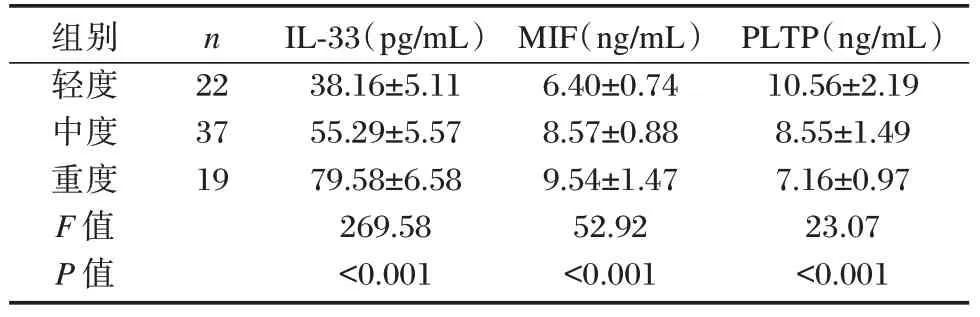
表3 不同病情程度BPD 患儿血清中IL-33、MIF、PLTP水平比较(±s)Table 3 Comparison of serum IL-33,MIF and PLTP levels in children with BPD of different severity(±s)
组别轻度中度重度F 值P 值n 22 37 19 IL-33(pg/mL)38.16±5.11 55.29±5.57 79.58±6.58 269.58<0.001 MIF(ng/mL)6.40±0.74 8.57±0.88 9.54±1.47 52.92<0.001 PLTP(ng/mL)10.56±2.19 8.55±1.49 7.16±0.97 23.07<0.001
2.3 IL-33、MIF 及PLTP 对BPD 诊断价值
ROC 曲线结果显示,IL-33、MIF 及PLTP 单独检测诊断BPD 时ACU 分别为0.726、0.661、0.725,联合诊断为0.783,明显高于单独诊断(P<0.05)。见表4 及图1。
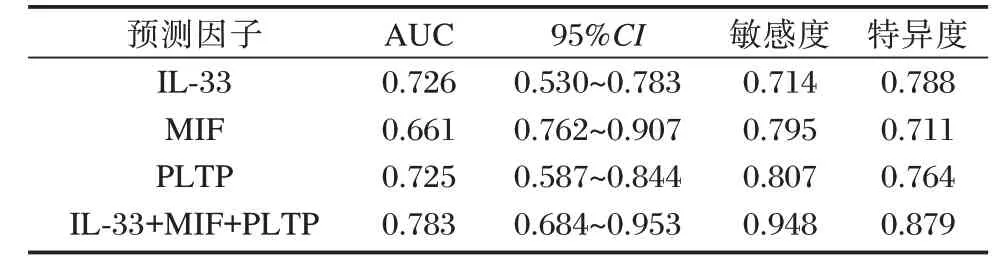
表4 IL-33、MIF 及PLTP 对BPD 诊断价值Table 4 Idiagnostic value of IL-33,MIF and PLTP in BPD

图1 IL-33、MIF、PLTP 及联合诊断BPD 曲线图Figure 1 the curve of IL-33,MIF,PLTP and their combination in the diagnosis of BPD
3 讨论
BPD 常出现在低于34 周的早产儿中。以往动物实验研究发现,在高氧新生鼠中其肺泡间隔发育存在明显异常,高氧会抑制肺泡间隔化,阻止肺泡形成,降低肺泡Ⅱ型上皮细胞修复能力,最终导致肺停止发育[7]。BPD 的发生是逐步进展的病理过程,目前在临床中对BPD 诊断主要依据氧依赖超过28 d 作为诊断标准,确诊时间长可导致错过最佳治疗时机。
IL-33 作为IL-1 的新家族成员,可与受体ST2结合从而激活肥大细胞,刺激淋巴细胞核嗜酸性粒细胞产生Th2 因子,在机体自身免疫性疾病、感染、炎症中有着重要的作用。气道上皮细胞、血管上皮细胞、树突状细胞等均可分泌出IL-33,其参与黏膜组织的炎症及免疫反应,可调节黏膜内环境平衡[8]。许惠娟等人[9]研究显示,在肺部炎症疾病患者中,气道和全身的炎症反应会导致IL-33 升高,且和疾病严重程度存在一定联系。以往有研究证明炎症反应在BPD 中发病中发挥着重要作用[10]。在动物实验中通过建立BPD 大鼠模型发现炎性因子可使IL-33 表达水平上调,在使用抗体将IL-33 中和后,炎性因子的释放和细胞凋亡被抑制,从而阻止BPD 进展[11]。
文献研究显示,早产儿肺部组织中MIF 呈高表达,在新生儿呼吸窘迫综合征患者中表达更为明显[12]。MIF 可在肺组织、肺泡内皮细胞、肺泡巨噬细胞中表达,且活化的炎性因子可破坏毛细血管通透性,导致肺泡损伤,进一步引起肺部炎症反应失调,妨碍肺部发育。高惠等[13]建立缺氧肺动脉压小鼠模型,研究结果显示MIF 及炎症因子释放与持续性肺动脉收缩及肺血管重塑有关,MIF可增加RAS 系统对肺部血管重塑和收缩作用。
BPD 发病是多种因素共同导致肺部炎症反应增加,导致肺血管异常发育,最终阻碍肺泡发育[14]。PLTP 参与肺表面活性物质中PC 的合成,相关研究表明,肺表面活性物质不足可导致新生儿呼吸窘迫综合征、肺气漏、BPD 等肺部疾病[15]。PLTP通过介导三酰甘油转变成为PC,从而促进PC 合成;此外BPD 还可调节机体内维生素E 代谢,从而清除机体内氧自由基减少高氧带来的肺部损伤[16]。
本研究结果提示IL-33、MIF、PLTP 可能在BPD 发生中发挥着重要作用,且三者变化与BPD患儿病情严重长度存在一定的联系。参考ROC曲线分析,IL-33、MIF、PLTP 对BPD 均存在一定的预测及诊断价值,且三者联合诊断AUC 面积、灵敏度、特异度高于三者单独诊断。
综上所述,血清IL-33、MIF 及PLTP 水平变化与新生儿BPD 发生、发展之间存在密切联系,其水平变化可为患儿病情严重程度评估提供参考。IL-33、MIF 及PLTP 可作为BPD 早期诊断的有潜力的生物标记,也有潜能成为BPD 药物治疗的新靶点。
