垂体腺瘤组织DCX表达水平与肿瘤侵袭性的关系
2021-09-02祝启海夏国庆
祝启海 夏国庆 宋 伟
垂体腺瘤大多源于垂体前叶,是颅内常见的良性肿瘤,但部分垂体腺瘤可见海绵窦、硬脑膜、蝶筛窦等受累[1]。垂体腺瘤早期很难预测肿瘤侵袭发生风险,通常在侵袭发生之后才能诊断,但往往错过了全切除的机会,术后残留风险高[2]。目前,垂体腺瘤侵袭的机制尚未完全明确。近年来,研究指出肿瘤发生与基因异常表达等有关[3]。有学者发现双皮质素(doublecortin,DCX)在神经胶质瘤组织中存在过表达,可能与肿瘤侵袭有关[4]。本文探讨DCX 与垂体腺瘤侵袭性的关系。
1 资料与方法
1.1 研究对象①纳入标准:术后病理证实为垂体腺瘤;年龄≥18岁;精神状态正常;认知功能、沟通能力良好。②排除标准:有其他部位肿瘤;心、肝、肾等重要脏器受损;凝血功能障碍,不适宜行手术;患造血系统疾病、自身免疫性疾病。
2017年1月至2020年1月收治符合标准的垂体腺瘤88例,其中56例获取瘤旁垂体组织。88例中,男48例,女40例;年龄20~74岁,平均(48.44±11.82)岁;肿瘤最大径8~62 mm,平均(35.39±16.87)mm。内分泌激素免疫组化分类:混合型19 例,生长激素型8 例,泌乳素型23 例,促肾上腺皮质素型6 例,无功能型32例。
1.2 检测方法
1.2.1 DCX的免疫组化检测 标本经10%福尔马林固定,行石蜡包埋,切片厚度为1.5 μm。脱蜡入水,行抗原修复;利用PBS 洗涤3 次,3 min/次;加一抗,在37 ℃下孵育60 min,在室温下反应30 min,复温;PBS洗涤2 次,3 min/次;加二抗,在37 ℃下反应20 min;PBS洗涤2次,3 min/次;行DAB显色,在避光条件下进行观察,1~3 min 内终止显色;苏木素复染1 min;脱水、封片。免疫组化染色结果评估[5]:光学显微镜观察,若细胞膜、细胞浆内可见棕黄色则为阳性(图1),至少选取5个高倍视野(×400),根据阳性细胞占比、染色强度计分:①阳性细胞占比≤5%、6%~25%、26%~50%、≥51%分别计0、1、2、3 分;②染色强度无染色、淡黄色、棕黄色、棕褐色分别计0、1、2、3 分。两种计分乘积为最终计分结果,总分≤2分为阴性,≥3分为阳性。
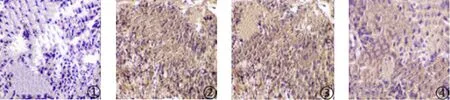
图1 双皮激素免疫组化染色(SP法,×400)
1.2.2 微血管密度(microvessel density,MVD)的检测采用免疫组化法测定,若血管内皮细胞胞浆呈现为棕黄或棕褐色,为FⅧAg 阳性细胞。利用低倍镜(×100)对血管高密度区进行选择,经高倍镜(×200)选取3个视野,计算该区域内MVD,以3个视野均值为最终结果。
1.2.3 qRT-PCR检测DCX mRNA 利用TRizol试剂提取总RNA,逆转录成cDNA,行扩增PCR。引物序列:① DCX 上 游 序 列 为 5'- TCCCCAACACCTCAAAAGAC-3',下游序列为5'-TTTGTTAGACGAAGCTTGGGCTGCA-3';②内参GAPDH 上游序列为5'-GGCGATCTGGTGGAGTTCGT-3',下游序列为5'-AGATCCACAACGGATACATT-3'。反应条件为94 ℃3 min,94 ℃30 s、60 ℃30 s、72 ℃30 s,共35 个循环,72 ℃7 min。以2-△△Ct法计算相对表达量。
1.3 垂体腺瘤侵袭性的评价 根据Knosp分类方法评估肿瘤侵袭性[6]。根据MRI扫描,将蝶鞍中段扫描平面视作参考平面,观察海绵窦周围显影状态,分成5个等级:0级,海绵窦未见侵犯,病灶处于颈内动脉侧壁连线内;1级,内侧静脉丛增强消失,病灶处于颈内动脉内切线与中切线之间;2级,内侧以及下方或上方静脉丛增强部分消失,病灶处于颈内动脉中切线、外切线之间;3级,内侧以及下方或上方静脉丛增强完全消失,外侧增强也可见部分消失,病灶超过颈内动脉外切线:4级,静脉丛增强彻底消失,肿瘤将颈内动脉完全包裹。其中0、1级为无侵袭组,2~4级为侵袭组。
1.4 统计学方法 采用SPSS 20.0软件分析;计数资料行χ2检验;计量资料以x±s表示,行t检验;利用多因素logistic 回归分析检验侵袭性的危险因素;绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析DCX mRNA 水平预测肿瘤侵袭性的效能;P<0.05为差异有统计学意义。
2 结果
2.1 垂体腺瘤组织DCX 表达情况 垂体腺瘤组织DCX 阳性率(71.59%,63/88)明显高于瘤旁组织(17.86%,10/56;P<0.05)。垂 体 腺 瘤 组 织DCX mRNA 表达量(5.65±1.87)明显高于瘤旁组织(0.85±0.28;P<0.05)。
2.2 垂体腺瘤发生侵袭性的影响因素 本文88 例垂体腺瘤中,侵袭组41 例,无侵袭组47 例。单因素分析显示,MVD、DCX 表达水平与垂体腺瘤侵袭性有关(P<0.05,表1)。多因素logistic 回归分析显示MVD≥28.68、DCX 表达阳性是垂体腺瘤发生侵袭的独立危险因素(P<0.05,表2)。
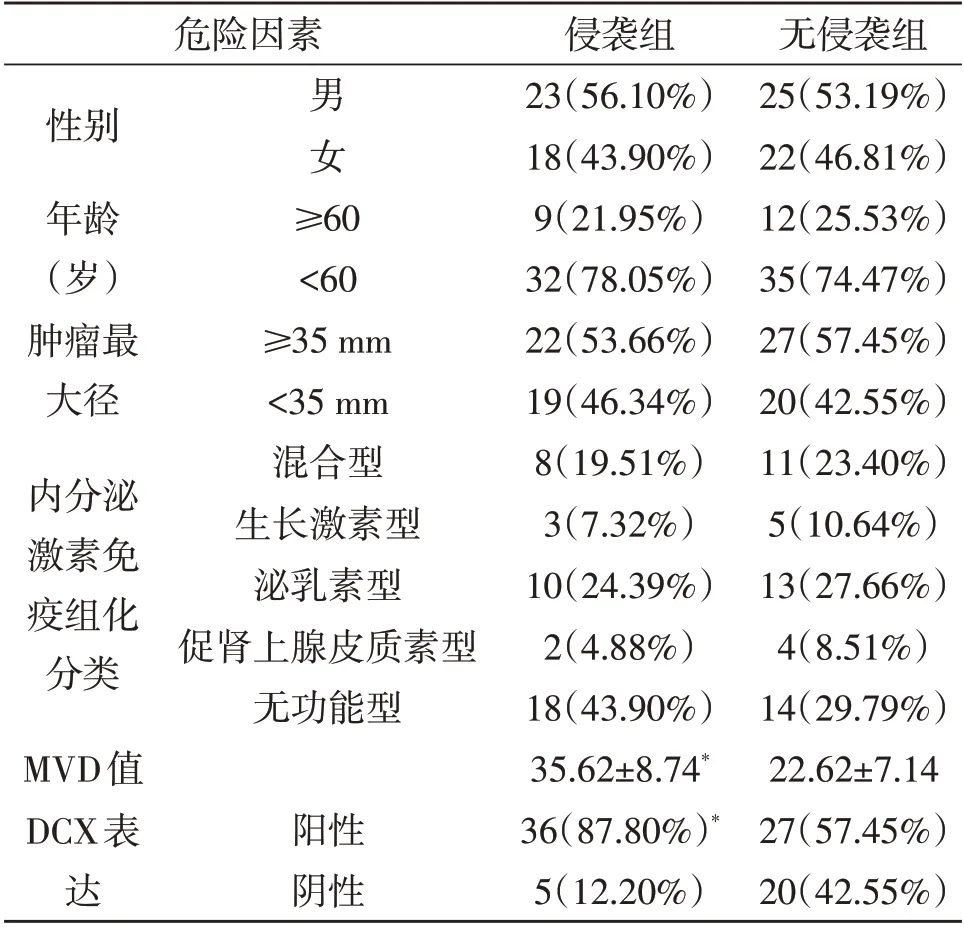
表1 垂体腺瘤发生侵袭性影响因素的单因素分析(例)
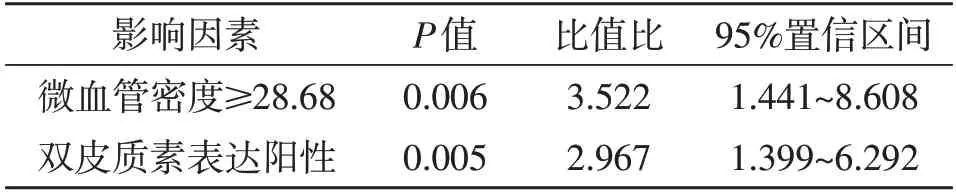
表2 垂体腺瘤发生侵袭性影响因素的多因素logistic 分析结果
2.3 DCX mRNA 表达量预测垂体腺瘤侵袭性的价值
侵袭组DCX mRNA 表达量(6.42±0.86)明显高于无侵袭组(4.98±0.94;P<0.05)。ROC 曲线显示,DCX mRNA 表达量预测垂体腺瘤侵袭性的曲线下面积(area under the curve,AUC)为0.775(95% CI 0.676~0.874;P<0.001),最 佳 界 值 为5.640,敏 感 度 为78.00%,特异度为61.70%。见图2。
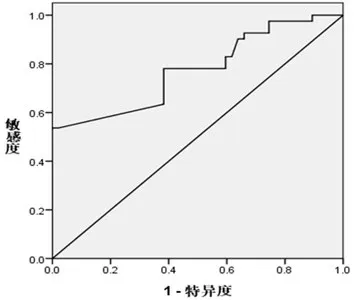
图2 ROC 曲线分析双皮激素mRNA 表达量预测垂体腺瘤侵袭性的效能
3 讨论
目前,垂体腺瘤的发病机制尚未完全阐明,但基因异常表达等可能参与其进展过程[7]。有学者指出抑癌基因活性丧失以及原癌基因活性增强与垂体腺瘤的发生有关[8]。侵袭性垂体腺瘤可导致海绵窦、颅骨、颈内动脉等受累,手术风险大,术后易复发,其侵袭过程涉及的机制较复杂[9]。研究认为DCX与肿瘤发生、发展有关,与微管结合,导致细胞骨架系统处于松散状态,促进细胞迁移[10]。本文结果显示,垂体腺瘤组织DCX 表达水平明显高于瘤旁组织。DCX是一种微管相关蛋白,在人脑多个部位存在表达,例如海马齿状回颗粒下层、脑室室管膜下区等。它的表达缺失可导致细胞迁移受阻,引起迁移过程紊乱,诱发智力障碍[11]。然而,DCX过表达也会引起疾病,例如它在肿瘤组织中呈过表达,可导致大量囊泡侵及机体,促进生长椎膨胀,使细胞核加速运动,促进细胞迁移,导致肿瘤细胞侵袭、转移[12]。有学者以前列腺癌小鼠进行研究,发现正常前列腺、前列腺癌以及转移病灶DCX 表达未见差异[13]。这表明DCX 在不同肿瘤中的表达可能存在特异性。
本文结果显示MVD、DCX阳性表达与垂体腺瘤侵袭有关。MVD值反映肿瘤血管生成情况,该值越高提示肿瘤血管生成越明显。肿瘤血管生成是促进肿瘤细胞转移的基础条件,通常在肿瘤生长初期属于无血管期。当病灶体积长至1~2 mm3时,则可见血管生成,肿瘤细胞能够释放大量血管生成因子,促使血管形态发生变化,致肿瘤局部血管网络形成,高侵袭性肿瘤大多可见丰富的血管网络,与肿瘤细胞迁移密切相关[14]。DCX过表达与肿瘤侵袭也存在关联,可能通过影响肿瘤细胞运动以及细胞骨架变化,介导肿瘤细胞的迁移、侵袭[15]。本文ROC 曲线结果显示,DCX mRNA 水平对垂体腺瘤侵袭性具有一定预测作用。
总之,垂体腺瘤DCX 呈高表达,检测DCX 表达水平对判断垂体腺瘤的侵袭性有一定的预测作用。
