天幕脑膜瘤的影像学分型及显微手术治疗
2021-09-02安学锋胡军民秦海林
安学锋 胡军民 秦海林 秦 汉
天幕脑膜瘤是指肿瘤大部分基底附着在小脑幕和颅后窝底部硬脑膜的脑膜瘤,占颅内脑膜瘤的2%~5%,属于颅底和脑深部肿瘤,常与静脉窦粘连,并与脑干、重要颅神经及血管关系密切[1]。随着显微外科技术和影像学技术的进步,天幕脑膜瘤的诊断和治疗水平不断提高,但天幕脑膜瘤的显微手术治疗仍有很大的挑战性。2018 年1 月至2019 年12 月显微手术治疗天幕脑膜瘤31例,疗效满意。本文就天幕脑膜瘤分型及显微手术治疗进行分析。
1 资料与方法
1.1 一般资料31 例中,男9 例,女22 例;年龄24~69岁;病程2个月~5年,平均29.6个月。头痛26例,视物模糊8例,恶心呕吐10例,步态不稳19例,记忆力障碍3 例,精神障碍2 例,视乳头水肿17 例,水平眼震5 例,同向性偏盲2 例,共济失调16 例,三叉神经损伤4 例,面神经损伤5 例,听神经损伤10 例,后组颅神经损伤4例,无症状3例。
1.2 影像学检查 术前均行头颅CT 平扫示天幕区域稍高密度占位影,增强后肿瘤强化明显,可见脑膜尾征。MRI 检查示T1等、稍低信号,T2高信号,有占位效应。肿瘤最大直径2.0~6.7 cm,平均(4.18±1.50)cm。按Sekhar等报道标准,中型脑膜瘤(1.0~2.4 cm)8 例,大型脑膜瘤(2.5~4.4 cm)19 例,巨大型脑膜瘤(>4.5 cm)4例。
肿瘤分型:根据影像学资料,按Bret 在Yassrgil分型基础上分为5 型[2]:前内侧型(Ⅰ型)、前外侧型(Ⅱ型)、内中型(Ⅲ型)、后内侧型(Ⅳ型)、后外侧型(Ⅴ型);再根据肿瘤生长方向分为幕上型、幕下型、幕上下型。本文31例分型见表1。
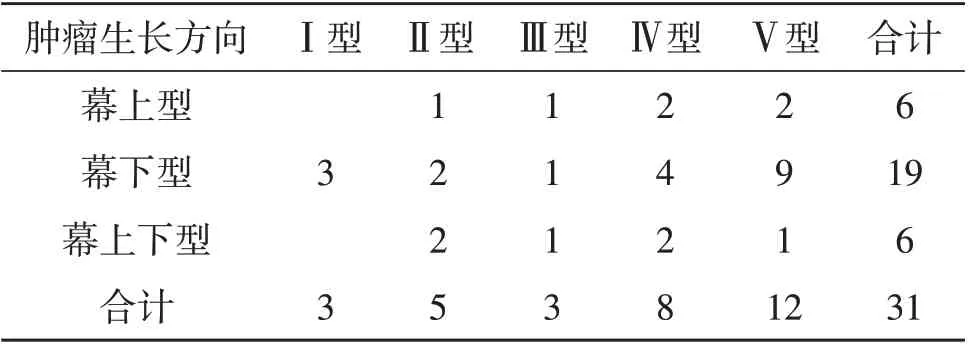
表1 本文31例天幕脑膜瘤分型(例)
1.3 手术入路 依据肿瘤分型选择最适宜手术入路。Ⅰ~Ⅳ型幕下脑膜瘤采用幕下小脑上入路;Ⅱ型幕上脑膜瘤采用翼点入路;Ⅲ~Ⅴ型幕上脑膜瘤采用枕部幕上入路;Ⅴ型幕下脑膜瘤采用乙状窦后或旁正中幕入路;Ⅱ型幕上下脑膜瘤采用颞下入路;Ⅲ、Ⅳ型向幕下扩展轻的幕上下脑膜瘤采用枕部幕上入路,幕上下均扩展较大脑膜瘤采用枕部幕上下联合入路;Ⅴ型幕上下脑膜瘤向幕上扩展轻微采用乙状窦后入路。
2 结果
2.1 肿瘤切除程度 按术中Simpson 分级标准:Simpson分级Ⅰ级23例,Ⅱ级5例,Ⅳ级3例;肿瘤全切除率为90.3%(28/31)。
2.2 病理类型 术后病理显示纤维型16例,砂粒体型6 例,内皮型7 例,均为WHO 分级Ⅰ级;非典型2 例(WHO分级Ⅱ级)。
2.3 术后并发症 无手术死亡病例。术后发生肺部感染2例,少量出血1例(保守治疗),脑脊液漏1例,新发耳鸣2例,视物模糊1例,均经对症治疗后好转。
2.4 术后随访31例术后随访3~18个月;2例部分切除术后行伽玛刀治疗,复查MRI 未见肿瘤增长;1例部分切除术后13个月复查MRI显示肿瘤进展,但无新发症状,动态复查MRI 随访观察。所有病人术后均恢复良好,KPS评分≥70分。
2.5 典型病例56 岁男性,因间断头痛伴行走不稳2个月余入院。既往2013 年曾行同一部位肿瘤切除术,术后病理为非典型脑膜瘤(WHO分级Ⅱ级)。完善术前评估,经原右侧颞部切口,采用联合枕部幕上下入路手术切除肿瘤。术后复查MRI显示肿瘤全切除。术后病理为脑膜瘤(WHO分级Ⅰ~Ⅱ级)。术后头痛缓解,行走不稳稍改善。手术前后影像见图1。
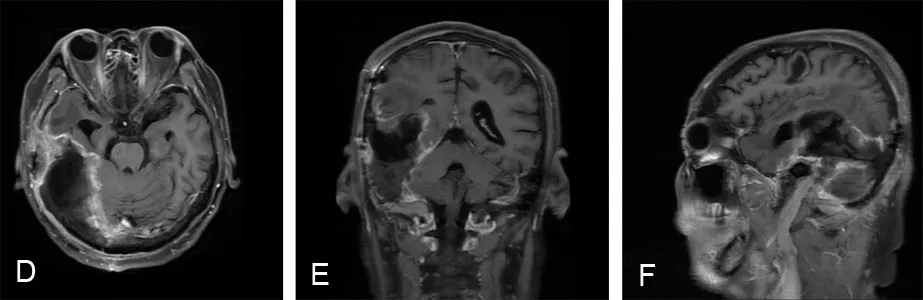
图1 天幕脑膜瘤手术前后MRI
3 讨论
天幕脑膜瘤位置特殊,多起源于窦汇、直窦、横窦及横窦-岩上窦交界处的蛛网膜颗粒或天幕的纤维母细胞,向天幕上下两侧生长,周围解剖结构复杂。早期肿瘤生长缓慢,无特异临床症状,少数经头部影像学体检发现。随着肿瘤体积的增大和生长方向不同,可引起相应神经功能障碍。幕上方向生长,可引起语言障碍、精神症状和癫痫;幕下生长,常引发小脑功能障碍和颅内压增高;位于外侧,可引起颅神经损伤;位于天幕后内侧,可引起视力、视野改变[3]。颅内压增高和小脑共济失调是最常见的临床表现,多数病人就诊时已出现颅内压增高、颅神经功能障碍、共济失调等,而此时肿瘤已经足够大,同时手术难度及风险也随之增加。
天幕脑膜瘤CT 检查多呈高、略高密度肿块影,多数均匀明显强化。MRI检查T1像多为等或稍低信号,T2像肿瘤实性部分多为等、稍高信号,肿瘤内部或周边存在血管流空影,钙化灶T1、T2均呈点、片状低信号,肿瘤周围常有环形脑脊液信号,可以评估肿瘤与脑干间的蛛网膜间隙是否存在,观察肿瘤是否侵犯脑干软脑膜及脑干受压水肿;T1增强扫描多明显均匀强化,且伴有肿瘤基底部脑膜尾征,部分呈现出白质塌陷、假包膜征及骨质浸润征象[4]。脑血管造影检查(DSA、CTA、MRA)可以显示肿瘤的血供来源、静脉回流途径及同周围重要血管关系,便于术中早期阻断血供,同时评估颅内深部静脉和静脉窦受损程度,尤其适合侵犯静脉窦的肿瘤制定静脉窦手术处理预案,且DSA可术前栓塞治疗,以减少肿瘤血供(适合血供丰富肿瘤)。影像学检查综合评估可以明确肿瘤的大小、生长方向、密度、脑膜尾征、周围脑组织水肿及其基底部位置[5]。
文献报道的天幕脑膜瘤分型方法较多,较为经典的是Yassrgil天幕脑膜瘤分类,根据天幕解剖特点将天幕脑膜瘤分为:切迹中央、切迹外侧、岩骨旁、窦汇、横窦、横窦与乙状窦交界。Bret 在Yasargil 分型基础上分为5型:①前内侧型(Ⅰ型),肿瘤起源于天幕切迹定点的边缘;②前外侧型(Ⅱ型),肿瘤起源于天幕切迹外侧边缘;③内中型(Ⅲ型),肿瘤起源于天幕切迹中间部分,远离天幕切迹和硬脑膜静脉窦;④后内侧型(Ⅳ型),肿瘤靠近天幕窦汇处;⑤后外侧型(Ⅴ型),肿瘤靠近天幕乙状窦处;再根据肿瘤生长方向分为幕上型、幕下型、幕上下型。不同分型脑膜瘤可采取不同手术入路[3,6~8]:Ⅰ型脑膜瘤多采用枕下-大脑半球间入路或幕下小脑上入路,而枕下-大脑半球间入路能够经天幕较早触及肿瘤基底并断离肿瘤血供,同时可直视深部静脉系统,避免牵拉损伤;Ⅱ型脑膜瘤采用颞下入路、扩大翼点入路或额颞入路;Ⅲ型脑膜瘤中,幕下型多采用枕下正中或旁正中切口的幕下小脑上入路和枕下乙状窦后入路,幕上生长者多采用枕下幕上入路,幕上下者多采用幕上下联合入路,如乙状窦前幕上下联合入路、枕部幕上下联合入路和颞下经岩骨幕上下联合入路;Ⅳ型多采用枕下正中或旁正中切口的幕下小脑上入路和枕下乙状窦后入路;Ⅴ型多采用枕下正中或旁正中切口的幕下小脑上入路和枕下乙状窦后入路。
部分天幕脑膜瘤容易侵犯静脉窦。颅内静脉窦的受累程度直接影响肿瘤切除。窦旁型或全窦型,可将肿瘤切除后灼烧窦壁或将受肿瘤累及完全闭塞的静脉窦一并切除;窦内型需要考虑静脉窦的修补或重建,但有学者认为横窦和乙状窦等受侵犯损伤时,即使术后行修补术,仍容易出现窦内血栓形成,部分代偿不良者可造成严重的并发症,因此,窦内型的肿瘤可以考虑次全切除,再行伽玛刀治疗。
临床上,需要在熟悉掌握局部解剖同时加上精炼的显微手术技术是手术成功的关键,手术入路选择要结合肿瘤大小、生长方向、基底部及分型,个体化设计,选用合适的手术入路。若术前担心颅内压致暴露困难时,部分病人可提前放置腰大池置管引流。骨窗大小应能够满足肿瘤的暴露同时便于断离肿瘤血供。切开天幕时注意避免损伤附近动眼神经、滑车神经、脉络膜前动脉、大脑后动脉、小脑上动脉,先断基底血供,减少术中出血。肿瘤分离要在蛛网膜界面进行,瘤体较大时,先行包膜内分块切除,肿瘤毗邻脑干、深静脉重要结构,避免过度牵拉损伤,必要时可联合使用神经内镜观察评估并分离切除。选择幕上枕下入路时,应充分暴露小脑幕切迹、静脉窦及毗邻结构,同时避免过度牵拉枕叶,以免引发视觉障碍。选择幕下小脑上入路时,利用小脑与小脑幕的自然间隙,沿中线解剖分离肿瘤,避免过多损伤小脑上部桥静脉引发小脑肿胀、梗死及出血。选择枕部幕上下联合入路时,可采用幕上下去骨瓣,保留中间骨桥。
天幕脑膜瘤术后复发相关危险因素包括性别、年龄以及肿瘤大小、部位、形态、病理类型、切除程度,其中影响最大者是肿瘤切除程度,尤其是当肿瘤侵犯静脉窦时,在处理窦内肿瘤时易残留;其次为肿瘤病理级别。本文3例静脉窦内肿瘤残留,其中2例行伽玛刀治疗后复查未见肿瘤增长,1 例复发未行二次手术治疗,动态复查MRI。
天幕脑膜瘤手术治疗的目标应主要是改善病人临床症状,减少手术并发症,提高术后生活质量,在保护重要神经、血管结构前提下尽可能全切肿瘤。
天幕脑膜瘤总体预后良好,手术入路的选择必须依据肿瘤的位置、大小及生长方向综合分析,个体化设计,选择合适手术入路,熟悉掌握运用局部显微解剖关系,术中尽量避免过度牵拉造成肿瘤周围组织及血管损伤,最大程度的减少手术并发症,方能取得良好手术效果。
