复合菌系发酵改性对豆渣膳食纤维结构及物化特性的影响
2021-09-02张艳莉佐兆杭刘淑婷李志芳
张艳莉 王 颖,2 王 迪 佐兆杭刘淑婷 张 裕 李志芳
(黑龙江八一农垦大学食品学院1, 大庆 163319)(国家杂粮工程技术研究中心,粮食副产物加工与利用教育部工程研究中心,黑龙江省农产品加工与质量安全重点实验室2,大庆 163319)
豆渣是常见的食品加工副产物,常被当做饲料或废弃物丢弃。最常见的豆渣原料为大豆,近些年来因杂豆加工业得到重视,以芸豆、红豆、绿豆等为主的杂豆豆渣被作为研究对象。芸豆是我国主要的小宗杂豆之一,作为黑龙江[1]主产杂粮之一,成为饮料[2]、豆沙[3]等食品的加工原料。
豆渣中富含膳食纤维(DF)[4],按其溶解性可分为可溶性膳食纤维(SDF)和不可溶性膳食纤维(IDF)。研究表明,DF中SDF含量超过10%的可称为优质膳食纤维[5]。改性能够较好地改善、提高DF的物化特性。DF的物化特性直接决定其功能价值,因其较好的持水力、持油性起到控制体重、预防肥胖症[6]的功效;较好的吸附性[7]、离子交换能力[8]能够降血糖、血脂[9]进而预防糖尿病[10]、心血管疾病[11]等营养慢性病;特有的发酵性、溶解性能够改善肠道菌群[12]。改性常作为提高DF中SDF含量的手段,常见的改性方法包括以酸碱法为主的化学改性[13];以双螺杆挤压[14]、超微粉碎[15]为主的物理改性;以酶法[16]、发酵[17]为主的生物改性及联合两种单一改性方法的复合改性法。发酵改性可提高DF中SDF的含量,亦可增加这些可溶性成分原本不存在的功能性质,或增强已经存在的弱功能性质[18]。研究表明植物乳杆菌[19]、嗜酸链球菌[20]、双歧杆菌[21]、鼠李糖乳杆菌[22]能产生多种生物活性酶,具有提高DF中可溶性成分含量的功能,植物乳杆菌是活性最强的纤维素酶菌株之一,其中纤维素酶对IDF有显著的降解作用。复合菌系[23]能够更好地提高SDF的含量并改善DF的功能特性,目前研究常以单一菌种进行发酵改性,复合菌系发酵鲜有研究。
本研究利用复合菌系对豆渣进行发酵,提取发酵膳食纤维(FDF)并分离发酵可溶性膳食纤维(FSDF)和发酵不可溶性膳食纤维(FIDF),通过响应面试验确定最佳发酵提取工艺,并探究改性前后的FSDF和FIDF基本结构及物化特性,旨在为芸豆膳食纤维的功能性研究提供参考。
1 材料与方法
1.1 菌种、材料与试剂
植物乳杆菌LactobaciLLuspLantarumCGMCC 1.569、嗜酸链球菌StreptococcusacidophiLusCGMCC 1.2919、双歧杆菌BifidobacteriumCGMCC 1.5090、鼠李糖乳杆菌LactobaciLLusrhamnosusCGMCC 1.576;奶白花芸豆豆渣;95%乙醇、氢氧化钠、盐酸、水杨酸、亚硝酸钠、胆固醇等均为分析纯;碱性蛋白酶(酶活200 000 U/g)、耐高温α-淀粉酶(酶活200 000 U/mL)。
1.2 仪器与设备
LABSJB-450型数显型实验室搅拌机,DL-360B型超声波清洗机,C-04B型高速超微粉碎机,DGG-9140A型电热恒温干燥箱,LMQ.C-50E型高压灭菌锅,LHS-350HC型恒温培养箱,JIDI-18D型台式多用途高速离心机,FTIR-1500型傅里叶变换红外光谱仪,UV759型紫外分光光度计,SU7000型扫描电镜.
1.3 菌种活化与培养基制备
菌种活化:取植物乳杆菌、嗜酸链球菌、双歧杆菌和鼠李糖乳杆菌(1∶1∶1∶1混合菌种)接种于MRS肉汤培养基中培养(培养基采用高压湿热灭菌121 ℃、15 min,接种量是从固体培养基里取2环到3环至液体培养基),于37 ℃条件培养24 h,用菌落总数计数法,使菌数含量>1×107CFU/mL[11],即为培养基发酵调节。
培养基制备:取预处理的豆渣粉,按料液比加脱脂奶粉2%、白砂糖1.5%,料液搅拌、混合均匀,调节pH后灭菌后,接菌发酵后提取DF。
1.4 响应面优化膳食纤维制备工艺
脱脂豆渣→接菌发酵→热水(70 ℃)漂洗至中性→烘干→超微粉碎→酶解脱蛋白去淀粉→控温
1.5 IDF持水力、持油力、膨胀力测定
称取0.5 g样品计m1于50 mL离心管中,加入30 mL蒸馏水,搅拌30 min后静置1 h,4 000 r/min,离心10 min,倾倒出上清液,用滤纸吸干离心管壁残留水分,残渣计m2,按式(1)计算持水力。称取0.5 g样品计m1于50 mL离心管中,加入30 mL食用油,搅拌30 min后静置1 h,4 000 r/min,离心10 min,倾倒出上清液,用滤纸吸干离心管壁残留油滴,残渣计m2,按式(2)计算持油力。称取1.0 g样品mo于10 mL量筒中测定其初始体积V1,加入足量蒸馏水,振荡均匀,室温下静置18 h后观察量筒中物料的自由膨胀体积V2,按式(3)计算其膨胀力。
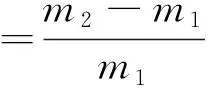
(1)
式中:m1为样品质量/g,m2为残渣质量/g。
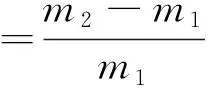
(2)
其中m1为样品质量/g,m2为残渣质量/g。
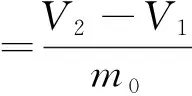
(3)
其中V1为初始体积,V2为膨胀后体积/mL,m0为样品质量/g。
1.6 IDF吸附能力测定
称取0.5 g样品于锥形瓶中,加入胆酸溶液20 mL,37 ℃水浴振摇2 h,4 000 r/min,15 min。准确量取上清液1.0 mL测定残余胆酸的量,根据反应前后的浓度差别计算吸附量,按式(4)计算。称取1.0 g样品于250 mL的三角瓶中,加入0.1 mg/mL的胆固醇溶液100 mL,调节体系pH值至2.0和7.0,置摇床中,37 ℃振荡,反应一段时间4 000 r/min下离心20 min,吸取0.4 mL上清液,采用邻苯二甲醛法测定胆固醇含量,按式(5)计算。

(4)
式中:n1为吸附前胆汁酸的量,n2为吸附后胆汁酸的量,m1为样品质量/g。

(5)
式中:n1为吸附前胆汁酸的量,n2为吸附后胆汁酸的量,m1为样品质量/g。
1.7 IDF离子交换能力测定
称取干燥样品,用0.1 mol/L HCl进行酸化处理,之后用蒸馏水清洗,用AgNO3溶液滴定去除氯离子,干燥。将干燥后样品均匀分散于15% NaCl溶液中,以酚酞作指示剂,用0.02 mo1/L NaOH溶液滴定微红时停止,摇匀再滴直至不再变色。记录消耗NaOH的体积V,按式(6)计算其阳离子交换能力(CEC)。确称取0.5 g样品于250 mL锥形瓶中,加入浓度100 μmol/L的NaNO2溶液100 mL,调节体系pH至2.0和7.0,于37 ℃下恒温磁力搅拌,反应一定时间,准确移取0.1 mL样液,之后加入2 mL 0.4%氨基苯磺酸,静置5 min后再加入1 mL 0.2%盐酸萘乙二胺,显色稳定后在分光广度计上测538 nm处吸光度,按式(7)计算其阴离子交换能力(AEC)[24]。
(6)
式中:CNaOH为NaOH浓度;V为消耗NaOH的体积;m为样品质量/g。
(7)
式中:n1为吸附前NO2-的量,n2为吸附后NO2-的量,m为样品质量/g。
1.8 SDF抗氧化能力测定
配制9 mmoL/L水杨酸-乙醇,9 mmoL/L FeSO4溶液,8.8 mmoL/L的H2O2溶液,按顺序加入到试管中,在37 ℃温育30 min,于510 nm处测吸光值。每个浓度组平行测定3次,求其平均值,测定清除·OH的能力,测定结果以清除率表示,按式(8)计算。ABTS溶于水中配成7 mmoL/L的ABTS溶液,该溶液与2.45 mmoL/L过硫酸钾在室温下避光反应12 h,后用pH 7.4,0.2 mmoL/L的PBS稀释60倍。在2.5 mL不同浓度的可溶性膳食纤维溶液中加入2 mL ABTS溶液,避光反应6 min,以蒸馏水为空白,在734 nm波长下测定其吸光度Asample。同时测定2.5 mL蒸馏水与2.0 mL ABTS溶液的吸光度(Acontrol),计算清除率,按式(9)计算[25]。
(8)
式中:AX为样品吸光度值,A0为模型对照组的吸光度值,AX0为模型对照组的吸光度值。
(9)
式中:Acontrol为模型对照组的吸光度值,Asample为样品吸光度值,Aj为模型对照组的吸光度值。
1.9 DF的显微结构测定
扫描电镜(SEM)研究方法[26]:试样干燥至恒重,取少量用双面胶固定在样品座上,表面喷金处理后进行电镜观察并拍照。电镜扫描条件:电压15 kV,放大倍数1 000、2 500倍。
1.10 DF的红外光谱测定
傅里叶红外光谱(FTIR)的测定方法[27]:取1~2 mg干燥至恒重的DF于研钵中,加入100 mg左右的干燥的光谱纯嗅化钾,研磨混匀至细微的粉末状,装入并使其均匀平铺于压片模具中,抽气加压,保持3 min左右,将制成的透明薄片迅速放入仪器进行分析扫描,扫描次数:32次,分辨率:4 cm-1,扫描范围:500~4 000 cm-1。
1.11 数据统计与分析
数据以平均值±标准偏差(SD)表示,并通过t检验和Tukey-Kramer的进行多重比较测试,SPSS 20和Origin 8.0软件进行数据分析及图表绘制。
2 结果与讨论
2.1 发酵前后膳食纤维含量
由表1可看出发酵后的芸豆豆渣IDF含量较未发酵的芸豆豆渣降低了2%,发酵后的芸豆豆渣SDF含量较未发酵的芸豆豆渣提高了11.84%,发酵后DF质量分数提高了2.81%。发酵过程中利用细菌等微生物,消耗原料中的碳源、氮源,以消除原料中的植酸,减少蛋白质、淀粉等成分,最后得到膳食纤维。植物乳杆菌等菌类会在发酵过程中产生半纤维素酶等酶类物质,从而将IDF中的大分子物质转化成SDF中的小分子单糖类物质。

表1 发酵前后豆渣膳食纤维质量分数
2.2 IDF持水力、持油力、膨胀力
由表2可知,经过发酵改性处理后的IDF持水力、持油力和膨胀力都有显著改善,FIDF的持水力较未改性提高了2倍,FIDF的持油力较未改性提高了6倍,改性后IDF的膨胀力较未改性提高了1.9倍。经改性后的IDF,其分子间有大部分极性和非极性基团暴露出来,改变了其与水和油的相互作用[28],因此FIDF的持水力及持油力显著提高。

表2 发酵前后IDF持水力、持油力及膨胀力
2.3 IDF吸附能力
由图1可知,FIDF吸附胆酸钠能力显著优于未处理的IDF,随吸附时间增加,发酵前后IDF的吸附能力都在升高,这是因为IDF表面有很多活性基团,能吸附鳌合胆汁酸等有机化合物。肠腔内,IDF与胆汁酸可能是通过静电力、氢键力或疏水键间的相互作用,其中氢键力结合也许是主要的作用形式[18]。图2可看出,在不同pH环境下,FIDF对胆固醇的吸附能力都显著高于未处理的IDF,pH 2条件下IDF对胆固醇吸附能力优于pH 7条件下,pH 2条件下FIDF对胆固醇吸附能力显著优于pH 7条件下。说明IDF对胆固醇的吸附作用除了物理作用以外还表现出一定的化学吸附。FIDF粒径减小,吸附表面积增大,吸附效果变好,粒径变化还会影响到胆固醇分子渗入纤维其内部的路径长度[29]。
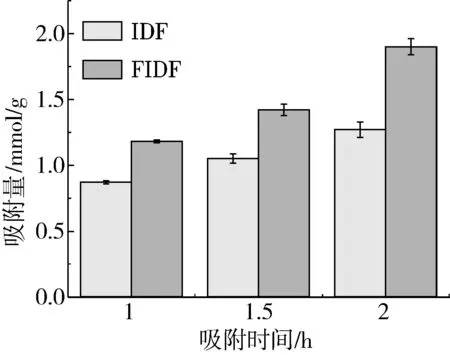
图1 发酵前后IDF吸附胆酸钠能力

图2 发酵前后IDF吸附胆固醇能力
2.4 IDF离子交换能力
由图3可知,发酵前后的IDF在pH 2时对阴离子的吸附能力皆显著高于在pH 7时,在pH 2的条件下发酵前后的IDF的吸附能力较强,大约在吸附后3 h,2种pH条件下IDF的吸附均基本达到饱和。图4可看出发酵改性前后IDF对阳离子交换能力均有影响,且皆成上升趋势,FIDF阳离子交换能力明显高于IDF,因为豆渣膳食纤维结构中的一些羟基侧链基团和羧基基团可以通过和肠道内有机阳离子进行可逆性的交换,不但能使之随食物残渣排出,而且可以改变离子的瞬间浓度,在起到稀释作用的同时延缓了它们转换的时间,从而造成肠道内氧化还原电位、渗透压以及pH值发生改变,形成一个更易于吸收的缓冲环境[30]。
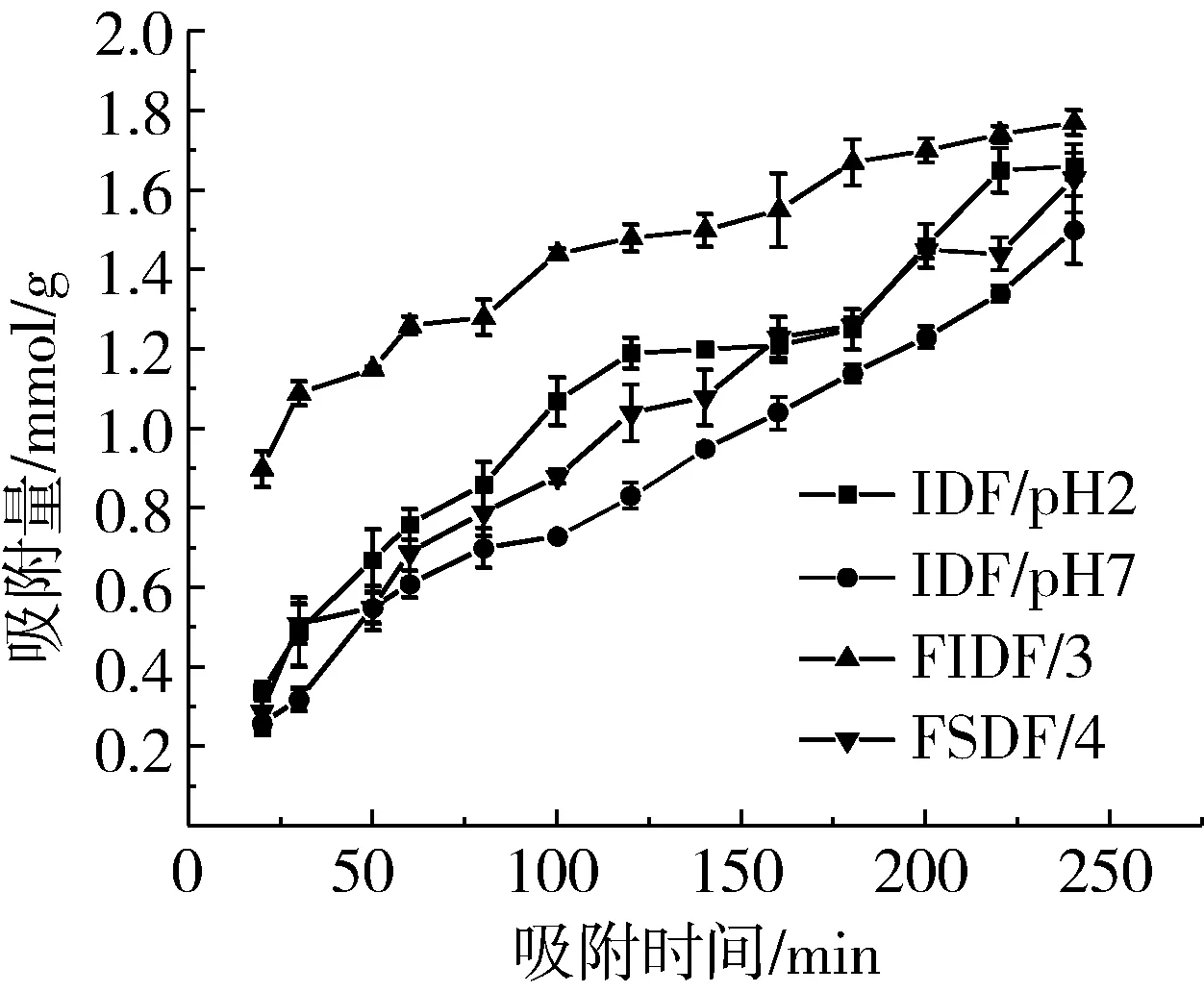
图3 发酵前后IDF阴离子交换能力

图4 发酵前后IDF阳离子交换能力
2.5 SDF抗氧化能力
图5可看出,豆渣SDF对·OH有一定的清除能力,发酵后的SDF对·OH的清除能力明显增强,这可能是因为发酵豆渣SDF后多糖的一级结构上的部分羟基被硫酸基取代后影响多糖对·OH清除力,也可能是取代的硫酸基影响了多糖空间结构或支链类型,从而增加了其清除·OH能力。豆渣SDF对ABTS有一定的清除能力,直接提取的SDF清除能力在SDF浓度达到20 mg/mL时被抑制,开始下降,FSDF的清除能力显著优于直接提取的。因为豆渣SDF

图5 发酵前后SDF抗氧化能力
组成成分为多糖类物质,由于多糖分子构象中羟基包裹于分子内部,大部分为分子内强键,因此直接提取的SDF对ABTS有一定的清除作用但清除力有限,FSDF由于引入了硫酸基,多糖分子空间非共价键重新分布,糖链及空间结构舒展,较多羟基被暴露在外面,此外,硫酸基的存在也使得多糖分子极性增强,因此对ABTS清除力增大[6]。
2.6 DF微观结构
由图6a、图6b可看出FIDF空间结构明显发生改变,由原来的致密状态变成松散的空间结构,图6c、图6d可以看出与直接提取的SDF相比,FSDF表面褶皱更明显,结构疏松,带有明显的片状结,其原因可能IDF经改性后,大分子物质发生降解,分子链被切断,分子量相对降低,使得聚合度下降,颗粒变小,微观结构和分子大小发生了变化。由图6e、图6f可看出,经发酵后豆渣,SDF含量明显提高,可能因为发酵过程中产酶的作用,其结构形态与直接提取的SDF不同,由图6g、图6f FSDF颗粒明显较小,形状不规则、结构紧簇且呈密集的蜂窝状,直接提取的SDF颗粒较大,形状规则,呈松散的蜂窝状结构,说明发酵过程能使SDF的微观结构和分子大小发生改变。这可能是因为发酵过程复合菌种会产生纤维素酶、半纤维素酶等酶类物质,使DF内部发生水解作用,导致IDF转换成SDF,豆渣中原有SDF的直链和支链结构被纤维素酶等酶类水解,使得分子质量下降,聚合度降低,颗粒变小[31]。

图6 发酵前后IDF、SDF扫描电镜图
2.7 DF红外光谱图
由图7可看出发酵前后的IDF各组分吸收峰无明显差别,在3 500~3 400 cm-1和2 900~2 800 cm-1附近分别出现纤维素和半纤维素分子内或分子间羟基、亚甲基相应的伸缩振动峰,1 200~1 000 cm-1处为纤维素、半纤维素C—O—C基的伸缩振动,可表明IDF主要由纤维素、半纤维素和木质素组成。说明发酵产生的纤维素酶对样品中的纤维素和半纤维素起到了一定的水解作用,并且促进了羟基基团的暴露[32]。发酵前后的SDF红外光谱图大致相同,为典型的多糖特征红外图谱,在3 500 cm-1左右吸收峰更宽更强,表明处于缔合状态的氢键较多,在1 700 cm-1的吸收峰是羰基吸收峰,存在糖醛酸,在900 cm-1处有弱小尖峰,是β-吡喃糖C—H变角振动的特征吸收峰,在750~674 cm-1附近出现的弱的吸收峰,表明多糖中存在α-D-吡喃木糖[26, 33],可推断豆渣SDF很可能含有酸性多糖或氨基多糖,并同时由β-D-吡喃葡萄糖,β-D-半乳糖,D-脱氧鼠李糖等成分组成。

图7 发酵前后IDF、SDF红外光谱图
3 结论
采用发酵法制备豆渣膳食纤维,结果表明,发酵改性能显著提高豆渣中SDF含量;发酵后DF的微观结构显著改善,且具备IDF及SDF特有的组分;FIDF的物化特性显著提高,发酵后SDF的抗氧化能力较好,发酵能够较好地改善DF的表征结构并提高其物化特性。
