荒漠绿洲过渡带不同年限雨养梭梭(Haloxylon ammodendron)对土壤水分变化的响应
2021-09-02王国华陈蕴琳缑倩倩
王国华,陈蕴琳,缑倩倩
1 山西师范大学,地理科学学院,临汾 041004 2 中国科学院西北生态环境资源研究院,中国生态系统研究网络临泽内陆河流域研究站,兰州 730000 3 中国科学院沙漠与沙漠化重点实验室 中国科学院西北生态环境资源研究院,兰州 730000
干旱地区约占全球整个陆地面积的30%,涉及到全球近20多个国家,是陆地生态系统重要的组成部分[1]。我国干旱地区主要包括分布在35°N以北、106°E以西的干旱荒漠地区,也包括年降水量在300—400mm左右的农牧交错地区,这些地区一个显著的地理特征是形状和大小各异的天然或人工绿洲沿河流发育,在广袤的荒漠中呈斑块状或带状分布[2]。近50年来,随着我国西北地区人口快速增加,绿洲边缘天然灌木林地和草地被大面积开垦,人工绿洲过度扩张,从而导致荒漠与绿洲之间过渡带严重萎缩,绿洲边缘人工固沙植被种植面积不断向荒漠扩展[3]。然而,由于远离河流,种植密度过大,加之干旱荒漠地区降水稀少且时空分布极其不均,干旱造成的土壤水分亏缺导致绿洲边缘人工林在种植后期普遍出现退化现象[4]。
在目前全球气候变化的背景下,北半球地区可能会面临更多、更严重的极端强降水事件[5- 6],年内年际间的降水波动更加频繁[7],区域降水不平衡和水资源短缺的局面也将更为严峻[8- 9],尤其是对于降水稀少、植被稀疏、生态环境最为脆弱的干旱荒漠地区[10]。尽管荒漠植物在长期进化过程中已形成一系列生态适应策略[11],但剧烈的环境变化仍有可能导致植物在生理或个体形态特征极度不适应,影响植物的生长,造成种群适合度下降,增加植物物种区域性灭绝的风险,尤其是对于干旱荒漠地区大面积种植的雨养固沙植物类群而言这种风险更大。
梭梭(Haloxylonammodendron)作为藜科(Chenopodiaceae)、梭梭属(HaloxylonBge)多年生小乔木,超旱生、耐盐、抗风蚀,在中亚地区和我国西北干旱荒漠、半荒漠地区自然分布极广[12]。梭梭,作为优秀的防风固沙先锋植物种,在我国西北荒漠地区种植面积十分庞大,仅仅在阿拉善地区,“蚂蚁森林”就计划种植一亿棵梭梭。然而近几十年来我国西北干旱荒漠地区,例如新疆区甘家湖天然梭梭林国家自然保护区[13],古尔班通古特沙漠[14]、张掖[15]和民勤[16]绿洲边缘等,天然梭梭和人工种植梭梭都普遍出现大面积衰退和死亡的现象[17],生理和生长形态变化及其对梭梭生长适合度敏感性影响一直被视为是其脆弱性评估的重要指标,一直是梭梭研究关注的焦点问题之一。
近年来,学者们主要对梭梭抗旱性[18]、盐旱胁迫[19]、种子萌发特性[20]、梭梭幼苗存活[21]、梭梭生理特征与环境的关系[22]、以及梭梭的光合水分关系[23]等方面开展了大量研究,为揭示梭梭生存和退化机制以及群落稳定性提供了大量依据。例如,李彦、徐皓等[24- 26]研究发现,梭梭主要利用浅层土壤水分维持生长和存活;许强[27]通过研究梭梭不同生长阶段的分支特征,认为梭梭主要通过形态建成改变来适应环境胁迫;田媛[28]研究梭梭种子萌发到梭梭定居的过程,表明梭梭个体形态调整对其幼苗生长存活至关重要;赵文智[29]等从不同年限的梭梭种群尺度说明了梭梭种群的适应性演变特征;周海[30]等发现梭梭根系空间分布具有显著的二态性特征:梭梭具有广泛分布的表层和浅层根系,能够大量吸收由降水和凝结水补给的浅层土壤水分;另一方面,梭梭具有发达的主根系,在地下水较浅的生境下可以利用地下水来满足植物的水分生理需求;王亚婷[31]等研究表明,梭梭对5mm小降水没有明显的生理响应;而吴玉[32]等对1mm单次降水对梭梭影响的研究发现,梭梭可以间接利用小降水。以上研究认为梭梭通过较强的气孔控制机制和个体形态调节来适应干旱、盐分等胁迫环境。但是,关于梭梭的生理和个体适应机制也存在不同的观点和认识,这可能与梭梭的林龄、具体生境差异有关。同时,人工固沙植被对干旱的适应过程是一个连续长期的过程,然而迄今为止,尚未有研究系统论述梭梭退化死亡原因及其与环境胁迫因素的关系,也并未充分考虑不同生境下或不同生长阶段植物生理特性与适应对策之间、生理特征与个体形态之间的复杂联系。
河西走廊作为我国西北主要的粮食生产基地,地处我国内陆干旱荒漠地区,气候干燥,风沙活动强烈,生态环境脆弱,是我国风沙活动危害最为严重的地区之一,也是西北地区建立防风固沙生态屏障的重点区域[33]。多年来为了有效遏制风沙危害,该地区开展了一系列以人工植被建设为主要生态修复措施的生态建设工程,有效促进了局地生境恢复[34]。梭梭作为当地关键的人工固沙植被建群种,种植面积最大,分布范围最广,是维持和保护河西走廊荒漠绿洲稳定的关键植被。近50a来,随着绿洲面积不断扩张,荒漠绿洲过渡带的人工梭梭生境破碎化严重,种植梭梭大量出现退化、死亡以及种群无法天然更新等问题,这直接影响了绿洲边缘风沙区生态恢复以及人工固沙林防风固沙效益的可持续性[35]。但目前对于人工梭梭林长期观测数据较少,对不同种植年限梭梭生理和生长特征及其与主导制约因素(土壤水分)的关系还并不清楚,这不仅影响着利用特有植物建立固沙植被实践的开展,也是荒漠生态系统生态水文研究的知识缺陷。本文拟通过在5、10、20、30和40a固沙梭梭林地调查取样,还原一个长时间序列的梭梭人工林的土壤和植被变化过程,分析不同种植年限梭梭不同土壤干旱条件下梭梭的生理和形态特征,并阐明梭梭生理和个体形态对不同水平土壤干旱的适应机制,研究结果有助于更加准确地预测土壤干旱对荒漠绿洲过渡带人工固沙植被的潜在影响。
1 材料与方法
1.1 研究区概况
研究区位于甘肃省河西走廊临泽县北部荒漠绿洲边缘,地处巴丹吉林沙漠边缘和临汾绿洲的交汇处(39°09′—39°21′N,100°02′—100°21′E,海拔1350—1367 m),是风沙入侵临泽绿洲的主要通道。气候属于典型的温带大陆性干旱荒漠气候,年温差大,年均温为7.6℃;年均降水量为116.8 mm,降水集中于7—9月份;日照充足,昼夜温差大;春季风沙活动强烈,主要集中于3—5月,以西北风为主,最大风速可达21 m/s;土壤类型主要为非地带性的风沙土、盐土。绿洲边缘沙丘上主要分布有沙拐枣 (Calligonummongolicum)、红砂(Reaumuriasoongorica)、泡泡刺 (Nitrariasphaerocarpa)等天然植被,梭梭是人工固沙植被的建群种和优势种,梭梭林下常常伴生有一年生草本植物例如雾冰藜 (Bassiadasyphylla)、沙米(Agriophyllumsquarrosum)、刺沙蓬(Salsolaruthenica)等。从20世纪70年代开始,绿洲边缘开始大面积种植梭梭防治沙漠化,并在2000年以后,又在荒漠进行了多期的固沙造林建设,逐渐形成了从绿洲到荒漠大约5km×10km的人工固沙植被带,同时也为本研究提供一个长时间序列梭梭防护林体系。
1.2 调查取样
植被调查于2019年7—9月进行,在种植5、10、20、 30和40a的典型梭梭林内选择3个典型梭梭种植样点作为植物和土壤取样点,同时,在未栽种梭梭的流动沙地作为对照样点(0a)。由于梭梭都栽种在流动沙地,土壤质地、养分和结构基本一致。取样方法采用巢式取样法,在不同种植年限梭梭林每个样点设置3个25×25 m2的样方,样方位置均为平坦沙地,且每个灌木样方之间的距离大于20m。在每个样方内,各选取5株长势良好,高度冠幅接近于样方内平均高度冠幅的林内植株,同时避免边缘效应,摘取每株梭梭的新叶(即绿叶)与老叶(即黄叶),保证叶片足量,且上中下部位的叶子均匀采集(从20a开始新叶即绿叶主要集中在梭梭上部,老叶即黄叶集中在梭梭的下部,图1);不同种植年限梭梭的根系调查主要通过挖土法完成,在5株梭梭取样植株根茎附近分层提取,每层深度为10 cm,提取两次取到20cm。取样后筛出健康的毛细根,用游标卡尺测量根系直径,将小于等于2mm的根系认定为吸收根系。将新鲜叶片(新叶和老叶)和毛细根均匀保存在铺有干冰的泡沫保温箱内,以备实验室测定叶片和根系各项生理指标。记录取样梭梭植株个体的株高、冠幅、茎干枝条生物量、叶片生物量和枯枝比例。生物量采用烘干法测定,即将取回的植物样品放入定温80℃的烘干箱内烘干至恒重。

图1 不同种植年限的梭梭生长状态 Fig.1 Growth status of Haloxylon ammodendron with different plantation ages 新叶即绿叶,主要集中在梭梭植株上部,老叶即黄叶,主要集中在梭梭植株下部;从30a开始,梭梭枯枝落叶明显增加,40a梭梭生物量明显减少
1.3 土壤水分测定与植物样品测定
在5、10、20、 30和40a梭梭林内选择3个典型梭梭定位样点,在梭梭植株茎干10cm左右用土钻取不同土壤深度20—40cm,100—120cm和180—200cm土壤,放入铝盒,然后将铝盒带回实验室立即称重,在105℃恒温箱内烘干至恒重,移到干燥器内冷却至室温,称重,通过计算得到土壤水分含量,同时,在流动沙丘取样作为对照(0a),并结合中国科学院临泽内陆河流域研究站对20a梭梭林龄固定监测样点连续近20年土壤水分监测,还原0—40a人工雨养梭梭林土壤水分状况特征。
梭梭叶片(新叶和老叶)生理指标测定:选取植物上部和下部枝条上的叶片,立即称量新鲜样品0.1g,剪碎,用95%乙醇和80%丙酮(1:1)混合溶液室温黑暗浸提24h直接测量,提取液分别在波长663nm和645nm下测定吸光度,通过Lambert-Bee定律计算出提取液中叶绿素a、b 含量的浓度(mg/g);叶片(新叶和老叶)渗透调节物质指标用蒽酮比色法测定可溶性糖含量;用考马斯亮蓝G- 250法测定可溶性蛋白含量;用茚三酮显色法测定游离脯氨酸含量;采用硫代巴比妥酸法测定丙二醛(MDA)含量;根系生理指标测定:用TTC法测定0—10cm和10—20cm毛细根的根系活力。
1.4 数据处理与分析
实验数据分析采SPSS21软件进行数据整理和分析,通过在One-Way ANOVA在95%的置信水平上,采用Duncan法进行显著检验。文中所有图均利用Origin8软件完成。
2 结果
2.1 不同年限梭梭林土壤水分变化
随着梭梭种植年限的增加,沙土浅层20—40cm土壤水分呈波动状态,土壤水分含量保持在2%—3%左右;而在100—120cm和180—200cm,土壤水分在前期(0—20a)基本保持在3%—4%左右,而从30—40a开始土壤水分下降到只有1%—2%左右,并且保持低含水量稳定状态。

图2 不同种植年限梭梭林不同土壤深度土壤水分变化Fig.2 Soil moisture changes in different soil depths of Haloxylon ammodendron with different plantation ages
2.2 不同年限梭梭叶片和根系生理特征
2.2.1叶片渗透调节物质含量变化
不同年限梭梭叶片(新叶和老叶)的渗透调节物质可溶性糖和可溶性蛋白含量差异显著;可溶性糖和可溶性蛋白含量在5—20a含量较低,而在30—40a时含量较高。游离脯氨酸含量变化未达到显著水平,但也呈现和其他两种渗透调节物质相类似的结果,在20—40a时含量处于高值。同时,本文发现在0—40a中新叶的渗透调节物质含量要普遍低于老叶(图3)。
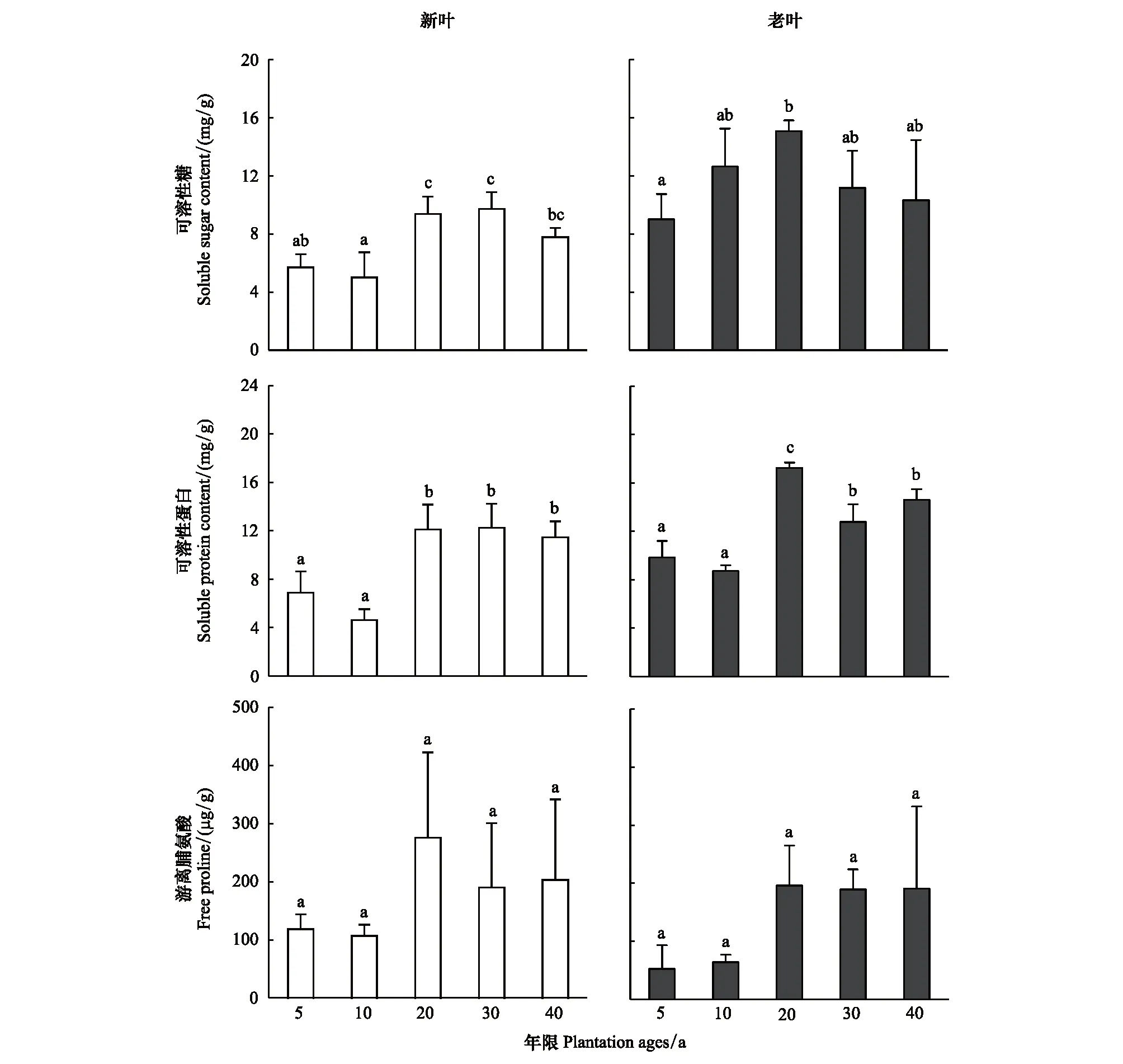
图3 不同种植年限梭梭新叶和老叶叶片可溶性糖、可溶性蛋白和游离脯氨酸含量变化Fig.3 Changes in soluble sugar, soluble protein and free proline contents in young leaves and old leaves of Haloxylon ammodendron at different plantation ages不同字母代表叶片在不同年限的差异显著,P<0.05
2.2.2叶片丙二醛含量变化
不同年限梭梭新叶丙二醛含量远远低于老叶含量,新叶丙二醛含量基本保持在0.01umol/g,而老叶除了在20a保持在较低水平,其他年限梭梭老叶丙二醛含量基本在0.16—0.02 umol/g左右(图4)。
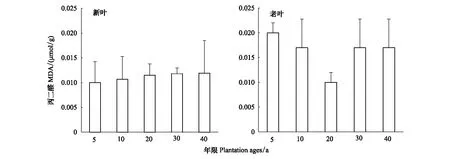
图4 不同种植年限梭梭新叶和老叶叶片丙二醛含量变化Fig.4 Changes in MDA in young leaves and old leaves of Haloxylon ammodendron with different plantation ages
2.2.3叶片叶绿素含量变化
不同年限梭梭新叶叶绿素含量远远高于老叶含量,新叶总叶绿素含量保持在400—600 mg/g,而老叶总叶绿素含量低于100mg/g。同时,新叶叶绿素a、b和总含量都随着种植年限的增加而呈现显著的增加,而老叶叶绿素含量都保持在较低的水平,没有显著变化(图5)。

图5 不同种植年限梭梭新叶和老叶叶绿素a 、b和总含量的变化Fig.5 Changes in chlorophyll a, b and total contents of young leaves and old leaves of Haloxylon ammodendron with different plantation ages
2.2.4根系活力含量变化
不同年限梭梭,0—10cm土壤深度的根系活力存在显著差异(P<0.05),根系活力的变化趋势近似抛物线型:5—20a间整体是增加的趋势,20a时梭梭的根系活力达到了最大值(为8.51mg/g),30—40a逐年下降,40a时根系活力最低(1.20mg/g);10—20cm土壤深度的根系活力变化幅度较小,5—20a相对来说是高值区,10a时达到最大值(为3.42mg/g),30—40a是低值区(图6)。

图6 不同种植年限梭梭根系活力的变化Fig.6 Changes in feeder root activity of Haloxylon ammodendron with different plantation ages at 0—10 cm and 10—20 cm
2.3 不同年限梭梭个体生物量和形态变化
2.3.1个体生物量
单株梭梭新叶老叶总生物量的变化趋势是:先增加后减少,5—30a不断增加,在20—30a时达到最大值(588 g),40a迅速下降,在40a叶片总生物量最低(为218 g)。单株新叶生物量在5—30a逐年上升,在20—30a时达到了最大值(为205 g),到40a时迅速下降到了最低值(为56 g);单株老叶生物量在5—30a持续上升,30a时达到了峰值(401 g),在40a时下降到了最低值(163g)。单株梭梭枝条生物量的变化呈现先增加后减少的趋势,5—20a间不断上升,5a时生物量最小,在20a时达到了最大值,20—40a阶梯式下降;单株梭梭茎干生物量的变化趋势也是:先上升后下降,5—30a间呈现不断上升的趋势,5a时生物量最小(85g),在达到20—30a时快速生长,茎干乔木化,30a时生物量达到了最大值(8742 g),40a茎干干枯,生物量严重下降(891g)(图7)。
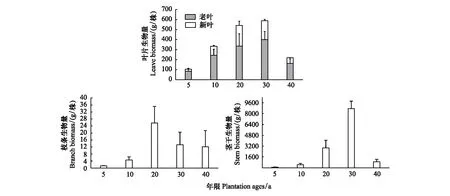
图7 不同年限梭梭叶片、枝条、茎干的单株生物量(平均值±标准误差)Fig.7 The biomass of leaves, branches and stemsof Haloxylon ammodendron with different ages (mean±SD)
2.3.2个体形态变化
梭梭株高的变化呈现不断上升的趋势,5—20a上升幅度较大,20—40a上升幅度较缓,最大值是在40a(为379cm);梭梭冠幅的变化趋势,先上升后下降,5—20a间呈上升趋势,20a时是最大冠幅(为4.94m2),20—40a间梭梭冠幅缓慢下降;梭梭枯枝比的变化呈现不断上升的趋势,5a时梭梭枯枝比最低(35%),40a时达到最大比例(74%)(图8)。

图8 不同年限梭梭个体形态(高度、冠幅、枯枝比)的变化(平均值±标准误差)Fig.8 Changes of individual morphological characteristics (height, crown and ratio of dead branches) of Haloxylon ammodendron with different plantation ages (mean ± SD)
3 讨论
3.1 不同种植年限人工梭梭林土壤水分变化
本研究发现种植30a后,雨养梭梭林内100—120cm和180—200cm土壤含水量下降明显,从3%—4%下降到1%—2%;而20—40cm土壤含水量呈波动状态,无明显下降。和本研究相类似,马全林[36]等研究发现在民勤人工梭梭林土壤含水量在种植30a后,林地土壤含水量保持在1%左右。一般认为,人工梭梭林土壤干燥化的原因主要有两个;一方面,干旱荒漠地区降水稀少,而蒸发强烈,同时降水主要以小降水事件为主,降水入渗主要分布在60cm以内,浅层土壤能够得到降水补给,而深层土壤水分补给不显著[37];同时,梭梭的蒸腾耗水量远大于降水量[38],尤其是在梭梭种植30a后,梭梭根系对根际土壤水分的过度消耗利用,进一步导致人工梭梭林土壤水分状况恶化[39]。
3.2 不同种植年限梭梭生理特征
叶片,作为植物与空气接触总面积最大的器官,对环境胁迫因子的敏感性和感知力最强,对抵抗外界胁迫和实现抵抗后的功能恢复有着重要的作用[40]。本研究发现,5—20a梭梭生长前期,土壤水分保持在3%—4%,梭梭叶片各渗透调节物质的含量整体不断上升积累,在20a的时候达到峰值,而从30a土壤水分下降到1%—2% 时,叶片渗透调节物质并没有显著提高,这暗示着在前期5—20a,梭梭叶片主要通过渗透调节抵御干旱胁迫,而到了后期30—40a叶片渗透调节功能下降,由此可以看出,梭梭叶片渗透调节能力是有限的,只能在一定的干旱胁迫阈值范围内发挥缓冲作用。
同时,本研究发现在种植前期5—20a,梭梭老叶的可溶性糖、可溶性蛋白的含量是新叶含量的近2倍,这说明老叶水分含量较低,渗透调节主要发生在老叶。虽然很多研究认为渗透调节物质可溶性糖、可溶性蛋白对植物是有益的,但过度的渗透调节物质可能会导致植物叶片中蛋白质、叶绿素和酶等其他有机物质减少,特别是与光合作用相关的物质,例如叶绿素a、b,因此,叶片渗透调节物质可溶性糖、可溶性蛋白积累的过程其实也是叶片退化的过程,即新叶(绿叶)向老叶(黄叶)转化的过程。
丙二醛是植物在逆境下产生的膜质过氧化的主要产物之一,对细胞产生毒害,造成细胞膜的功能紊乱。它的积累会对植物造成一定的伤害,因此其含量可以反映植物遭受干旱伤害的程度,即膜脂过氧化作用越强,丙二醛的含量越高,则对叶片的损伤就越大[41]。本研究发现:不同年限梭梭新叶丙二醛含量保持低水平,说明梭梭在新叶状态下,由于叶片渗透调节物质的作用,梭梭叶片的细胞膜是完整的,而在老叶中丙二醛积累比新叶高60%—100%,说明老叶受到干旱胁迫的影响更大,老叶原生质膜结构受到破坏远远大于新叶。
叶绿素作为植物叶绿体类囊体膜上重要的光合吸收和转化分子,是植物光合结构的重要组成部分,能灵敏反映光合作用的变化情况, 为植物抗逆生理、作物增产潜力预测等方面的研究提供依据, 因而被视为揭示植物光合作用与环境关系的内在探针[42]。通常,干旱胁迫会直接损伤植株的生理代谢, 导致叶绿素含量减少、光合作用下降、植株生长受阻,进而影响植物正常生长发育。本研究发现,梭梭新叶和老叶的叶绿素a、叶绿素b及总叶绿素含量随着年限的增加不断增加,说明梭梭在生长过程中叶片光合能力不断提高;但同一年限的梭梭新叶老叶的叶绿素a、叶绿素b及总叶绿素含量对比差异明显,新叶的叶绿素含量接近于老叶的5倍,这说明梭梭主要光合发生在新叶,而老叶的光合作用能力相对来讲是很低的。同时通常植物叶绿素a∶b的值约为3∶1[43],而本研究发现,不同年限梭梭新叶的叶绿素a∶b的值约为3∶1,而老叶的叶绿素a∶b的值下降到了2∶1,这也说明老叶叶绿素比例失调,光合作用下降。这些现象表明了梭梭应对土壤干燥的策略,即尽量保持或提高植株上部新叶的叶绿素含量,保持新叶较高的光合能力,而生理胁迫主要发生在光合作用较弱的老叶,这样一方面可以减少蒸腾水分消耗,抵御干旱,另一方面提高梭梭个体光合作用水分利用效率,保证梭梭正常生长和生理过程所需要的水分和生物量积累。
本研究还发现,在种植前期5—20a梭梭随着种植年限的增加,表层土壤(0—10cm)根系活力明显增加,在20a时达到了最大值,说明20a的梭梭根系在表层土壤中是最有活力,对降水吸收能力增强,而在后期30—40a,表层根系活力下降,对降水吸收能力减弱,因此干旱胁迫进一步加剧。
3.3 不同种植年限梭梭个体生长和形态特征
在干旱胁迫下, 植物的生长和个体形态会发生一系列调整。很多的相关研究表明,干旱胁迫会对树木的生长形态产生抑制作用,其株高、基径、冠幅面积等指标成为衡量抗旱的能力的重要参考[44- 45]。本研究发现,在种植前期,梭梭株高、冠幅、生物量随着种植年限的增加而增加,20年的梭梭是其生长过程中的最佳时期,在种植后期30—40年,梭梭老叶(黄叶)比例增加,叶片和枝条也出现了大量脱落的现象。梭梭老叶黄化和同化枝脱落,一方面保证梭梭正常的水分生长代谢,并减少低效的光合器官(老叶)水分消耗,另一方面保证新叶(绿叶)生物量,提高光合水分利用效率,这与许皓[26]的观点较为一致。
梭梭在干旱荒漠环境下长期的生态适应过程中,不断进化,逐渐形成了适应荒漠干旱生境的生态型。在本研究中,我们发现当梭梭种植30—40a土壤水分下降到1%—2%时,梭梭枝条叶片大量脱落减缓了蒸腾作用水分过度消耗,维持植物体内水碳平衡。但同时同化枝条和叶片大面积脱落也导致光合作用急剧下降,个体生物量显著降低。这与赵兴梁对沙坡头固沙植物沙土水分研究结果类似,即在沙漠环境下土壤水分在2%以上时,固沙植物生长正常;而当土壤水分在1%—2%时,固沙植物出现衰退现象;而在1%左右固沙植物大量死亡。尽管梭梭可以用凋落叶片和枝条的方法来降低老化光合器官水分消耗,但老叶、枝条以及茎干水分匮缺极其严重,基本已经达到了极限,而大量叶片和枝条脱落进一步减少其个体生物量,恶化其生存能力,最后茎干也由于植株体内的水分过少也出现干枯断裂。因此,基于以上研究结果,我们提出在梭梭种植30—40a后通过适度人工干预,例如修剪枯枝、适当灌溉、一定程度的平茬或间伐,可能会对人工雨养梭梭复活和复壮具有积极的意义。
4 结论
本文研究发现,在典型荒漠绿洲过渡带种植梭梭5—20a,雨养林土壤水分保持在3%—4%,梭梭叶片渗透调节物质和叶绿素含量的显著增加,说明梭梭内在水分利用效率(WUE)随着干旱程度增加而明显提高。但是,种植后期30—40a,土壤水分降低到1%—2%,严重干旱造成叶片叶肉结构不可复原的破坏,当叶片水势下降到一定阈值范围内,叶片叶绿素含量下降,叶片生理调节失效,叶片开始死亡并随后脱落。最后在种植40a后,多数梭梭进入休眠状态(假死)。
