线粒体受体转位蛋白靶向光动力学治疗对结肠癌的作用
2021-09-02肖日姣廖照辉韩赫魏房李震
肖日姣,廖照辉,韩赫,魏房,李震
(中国医科大学附属第四医院第四普通外科,沈阳 110032)
光动力学治疗(photodynamic therapy,PDT)是一种经临床批准且高度可控的微创治疗方法,已成为传统癌症治疗(如化疗和手术)的一种替代或补充方法[1-3]。PDT需要光敏剂、光辐照和氧这3个要素。在氧气存在的条件下,进入细胞内的光敏剂通过特定波长光的辐照被激活,产生活性氧(reactive oxygen species,ROS),如单线态氧和自由基,从而导致细胞死亡。PDT的疗效在很大程度上取决于光敏剂的肿瘤细胞选择性和亚细胞定位[1-2]。线粒体在为细胞提供能量和调节细胞凋亡方面发挥着至关重要的作用,故其作为PDT靶标的前景尤为广阔。线粒体受体转位蛋白(mitochondrial receptor 18 kDA translocation protein,TSPO)是位于线粒体外膜的转运蛋白,在正常组织和器官有不同程度的表达,但在乳腺癌、前列腺癌、脑胶质瘤等多种肿瘤中,其表达水平均有显著升高,且较高的TSPO表达水平与肿瘤侵袭、转移及预后相关。此外,TSPO还与胆固醇转运、类固醇生成、细胞增殖、卟啉转运和凋亡等许多细胞过程有关。TSPO靶向治疗可能延长线粒体通透性转变孔(mitochondrial permeability transition pore,MPTP)的开放时间,导致凋亡因子由线粒体释放到细胞质中,触发线粒体凋亡级联反应。高水平ROS可有效地破坏MPTP,导致细胞凋亡、死亡。因此,TSPO有望成为提高肿瘤治疗效果的靶点[2-4]。TSPO靶向光敏剂IR700DX-6T接受690 nm光辐照后可产生ROS,可使低功率光照射获得高效的PDT结果,从而避免潜在的非肿瘤组织光毒性损伤[2-3,5]。
结肠癌是最常见的恶性肿瘤,已成为全球肿瘤相关死亡的第三大原因[6]。当前主要的治疗策略包括手术、化疗和放疗,然而通常因肿瘤发生远处转移而生存率较低。本研究拟利用IR700DX-6T验证离体及在体结肠癌细胞对于PDT的敏感性,评估IR700DX-6T相对于传统光敏剂的优势,以期为结肠癌PDT的临床应用提供理论依据。
1 材料与方法
1.1 材料
结肠癌细胞系,包括MC38、LS174T、SNU-C4、SNU-503、HCT116、HT-29、DLD-1、RKO、SW620和SW480,均来自American Type Culture Collection(ATCC),KM12-SM、KM12-C、SC和CC来自美国范德堡大学Coffey实验室;氧化偶氮甲烷/葡聚糖硫酸钠(azoxymethane/dextran sulfate sodium,AOM/DSS)诱导的结肠癌小鼠模型获赠自美国范德堡大学Coffey实验室;RPMI-1640、DMEM培养基、小牛血清购自美国Gibro公司;TSPO抗体、兔抗TSPO一抗、山羊抗兔二抗、蛋白酶抑制剂购自美国Abcam公司;抗体稀释液购自美国Cell Signaling公司;兔抗β-actin一抗、RIPA缓冲液、抗体稀释液购自美国Sigma公司;BCA蛋白分析试剂盒购自美国Thermo Scientific公司;CCK-8购自美国Dojindo Molecular Technology公司。
1.2 方法
1.2.1 细胞培养:用含10%胎牛血清、5%青霉素-链霉素双抗RPMI-1640或DMEM培养基,于37 ℃、5%CO2培养箱中培养结肠癌细胞。
1.2.2 免疫组化:将小鼠结肠癌及癌旁组织于10%甲醛溶液中固定后石蜡包埋。切片后于60 ℃烤片1 h,脱蜡及复水等步骤均在Leica Bond Max IHC免疫组化染色机上进行。脱蜡后用抗原表位提取液热诱导抗原还原20 min。载玻片与抗TSPO抗体在信号素抗体稀释液(1 ∶ 1 000)中孵育1 h后,与山羊抗兔二抗在抗体稀释液(1 ∶50)中孵育15 min。采用Bond Polymer Refine检测系统实现可视化。
1.2.3 Western blotting:将小鼠结肠癌及癌旁组织在液氮中研磨成粉末,用RIPA缓冲液和1/100蛋白酶抑制剂混合物从组织或培养的细胞中提取蛋白。采用BCA蛋白分析试剂盒进行蛋白定量。每个样品取20 μg总蛋白上样,行12% SDS-PAGE凝胶电泳,转至硝酸纤维素膜,4 ℃阻滞过夜。用TBST洗膜3次后加入兔抗TSPO一抗孵育12 h;TBST洗膜3次,加入兔抗β-actin一抗,于4 ℃孵育12 h,TBST冲洗3次;加入IR Dye 800CW驴抗兔二抗,室温孵育1 h。TBST冲洗3次,在Odyssey CLx成像系统下扫描蛋白条带。
1.2.4 PDT体外实验:接种细胞至96孔板并培养过夜。弃培养基,更换为含不同浓度IR700DX-6T的新鲜培养基。孵育细胞16 h,新鲜培养基冲洗细胞后,用LED光(波长670~710 nm,峰值690 nm,辐照功率30 mW/cm2)照射细胞行PDT治疗。继续培养细胞16 h,使用CCK-8试剂盒测量细胞活力。
1.2.5 皮下种植结肠癌小鼠模型建立与PDT体内实验:动物研究获得范德比尔特机构动物护理和使用委员会(IACUC)的批准。6~8周龄雌性C57BL/6小鼠购自美国范德堡大学Jackson实验室。将结肠癌MC38细胞(5×106)皮下注射于每只小鼠侧翼两侧。细胞注射后7 d,注射部位皮下产生体积>8 mm3肿瘤且无局部皮肤破溃及感染症状小鼠视为成功荷瘤小鼠。将荷瘤小鼠随机分为实验组和对照组,每组4只。向荷瘤小鼠尾静脉注射含10 nmol/L IR700DX-6T的100 μL PBS(实验组)或不含IR700DX-6T的100 μL PBS(对照组)。注射后2 h用LED光照射左侧肿瘤,LED灯置于肿瘤上方约1.5 cm处区域,辐照功率为30 mW/cm2,持续10 min。将经PDT治疗的左侧肿瘤视为原发肿瘤,未经治疗的右侧肿瘤视为远端肿瘤。每天用卡尺测量小鼠双侧肿瘤大小,计算肿瘤体积=肿瘤长度(mm)×肿瘤宽度2(mm2)/2,持续测量14 d。
1.3 统计学分析
采用SPSS 19.0 软件进行统计学分析,计量资料采用表示,组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 TSPO在结肠癌细胞系及癌组织中的表达
Western blotting结果显示,13株人类结肠癌细胞株和1株小鼠AOM诱导的结肠腺癌细胞株MC38中,TSPO表达水平均明显高于正常结肠黏膜上皮(图1A)。选取3只AOM/DSS诱导的小鼠结肠肿瘤组织、癌旁正常黏膜及MC38细胞皮下移植肿瘤组织,结果显示,肿瘤组织中TSPO表达水平均高于匹配的邻近正常结肠黏膜组织(图1B)。免疫组织化学检测结果同样证实了肿瘤组织中TSPO的表达高于其周围正常结肠黏膜组织(图1C)。
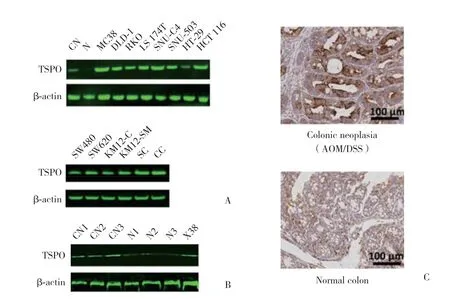
图1 TSPO在结肠癌细胞系及小鼠结肠癌组织中的表达Fig.1 The expression of TSPO in colon cancer cell lines and mouse colon cancer tissues
2.2 TSPO-PDT抑制结肠癌细胞增殖
结果显示,TSPO-PDT可抑制鼠源性结肠癌细胞株MC38增殖(P< 0.01),并具有浓度依赖性和时间依赖性(图2A);同时,对9种人类结肠癌细胞株LS174T、SNU-C4、SNU-503、HCT116、HT-29、DLD-1、RKO、SW620和SW480的增殖均有抑制作用(P<0.01),并具有浓度依赖性和时间依赖性(图2B)。表明PDT联合IR700DX-6T对TSPO(+)结肠癌细胞株均有抑制增殖作用。
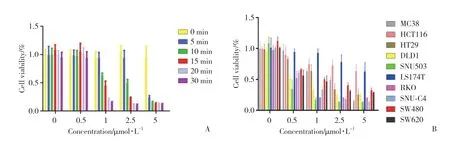
图2 PDT对不同结肠癌细胞系的作用Fig.2 Effects of PDT on different colon cancer cell lines
2.3 TSPO-PDT抑制皮下种植结肠癌小鼠模型肿瘤生长
对免疫活性C57BL/6J小鼠侧翼两侧皮下注射MC38细胞,建立皮下种植结肠癌小鼠模型。TSPOPDT只应用于每只小鼠左侧的肿瘤(原发肿瘤),右侧肿瘤被认定为远端肿瘤。结果(图3)显示,对照组小鼠双侧肿瘤生长速度无明显差异,而实验组小鼠的原发肿瘤生长速度明显低于远端肿瘤(P<0.01),但无论是原发肿瘤或远端肿瘤,其生长速度均低于对照组,差异有统计学意义(P< 0.01)。
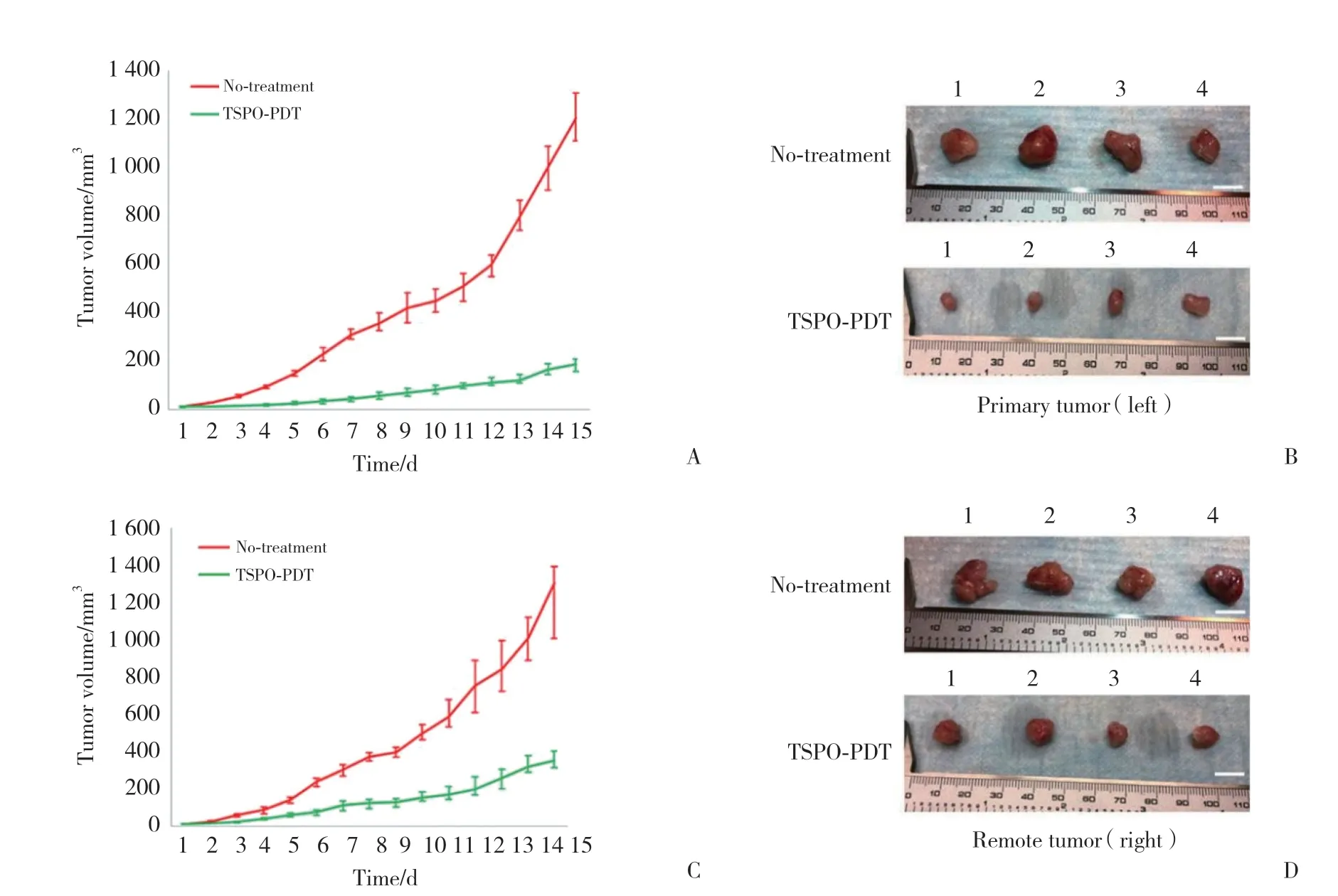
图3 PDT对皮下种植结肠癌小鼠模型的作用Fig.3 Effects of PDT on the mouse model of colon cancer implanted subcutaneously
3 讨论
近年来,PDT的临床应用日益受到广泛重视。EICKHOFF等[7]应用5-氨基酮戊酸为光敏剂对长达10 cm的上段食管癌进行PDT 3个疗程后,利用内镜直视和超声内镜检查发现肿瘤已经完全消退,且组织活检也证实肿瘤已经完全消除,随访23个月,未见复发征象,因此认为早期表浅的食管鳞状上皮细胞癌可以通过5-氨基酮戊酸PDT完全治愈,但仍需对这些患者进行远期随访。根治性切除是胃癌的首选治疗措施,疗效十分肯定。近年来,有研究者对部分早期胃癌患者尝试应用PDT治疗,目的是在治愈胃癌的同时免除手术创伤。NAKAMURA等[8]应用PDT治疗7例早期胃癌,均获得成功,术后病理活检未发现癌组织残留。研究认为,PDT对胃肠道早期小癌变、癌前病变是可行的,对于拒绝手术治疗的胃肠道肿瘤患者,PDT可以用作替代治疗措施之一。PRASAD等[9]采用PDT治疗25例已无法手术切除的胆管癌患者,在PDT治疗后放置胆管支架进行胆道减压,患者的总平均生存期为344 d,其中PDT治疗后生存期为214 d,1年生存率为30%。多因素分析表明,影像学检查结果显示存在明显肿块,确诊胆管癌,开始PDT的时间间隔越长,愈后就越差。
PDT也存在一定的不足和局限性,其中,对非肿瘤组织产生的光毒性最为突出[1,10-13];其次,由于可见光在组织中穿透性的限制,对位于体内深部肿瘤的作用很微弱;另外,光敏剂摄取和肿瘤内氧化存在不均一性等[4,10,14-16]。前期研究[2-3,5]证实,以TSPO为靶向的光敏剂IR700DX-6T可以较高浓度富集于肿瘤细胞内,而肿瘤周围正常细胞中则浓度较低。本研究证实TSPO在结肠癌细胞中表达水平明显高于正常组织。因此,相对于普通PDT,TSPO-PDT可以明显降低其对非肿瘤组织产生的光毒性。
本研究还证实,尽管实验组荷瘤小鼠未经TSPO-PDT的远端肿瘤生长速度大于原发肿瘤,但与对照组相比,其生长速度仍明显降低。IM等[17]认为,PDT对远端肿瘤的抑制作用可能是因其可诱导机体产生免疫原性碎片并招募树突状细胞聚集于肿瘤部位,增强了抗原呈递,并推测PDT可能是一种有前途的基于树突状细胞的免疫治疗方案。
综上所述,本研究利用前期合成的TSPO靶向光敏剂IR700DX-6T,验证了离体及在体结肠癌细胞对于PDT均具有较高敏感性,IR700DX-6T相对于传统光敏剂具有明显优势。因此,PDT有可能成为一种新的结肠癌临床治疗措施。
