冬季大连砂质潮间带自由生活海洋线虫群落结构及多样性的比较
2021-09-01宋慧丽慕芳红孙燕华尔
宋慧丽,慕芳红,孙燕,华尔*
( 1.中国海洋大学 海洋生命学院,山东 青岛 266003)
1 引言
沙滩是由潮汐、沉积物运动等物理力相互作用而形成的简单而敏感的生态系统[1]。它是指大部分海岸带的砂质潮间带部分,在海洋生态系统中占有重要的地位。沙滩曾经被许多生物学家认为是海洋荒漠,一直被忽视,直到19世纪三四十年代才慢慢被重视,此后加大了对沙滩的研究,从而对沙滩生态系统有了更加系统的了解,其实际上拥有着丰富多彩的生物群落,栖息着极为多样的底栖动物[2]。但是沙滩生态系统相对脆弱,容易受到人类活动的影响[3-4]。沙滩常被用于旅游业的发展,人们利用沙滩这种天然的资源来进行娱乐活动,从而使沙滩生态系统的结构和功能受到威胁。为有效地检测和保护沙滩生态系统的健康,有必要加大对沙滩生物群落的研究,为沙滩生态健康评价提供基础数据。
自由生活海洋线虫(以下简称海洋线虫)属于线虫动物门,是小型底栖动物的一个重要类群,其丰度往往占据小型底栖动物丰度的第1位。海洋线虫主要生活在海洋沉积环境中,其种类多样性较高,可以占据不同的营养级,促进营养物质的循环,同时,还可刺激微生物的生产,加速有机质的降解,在底栖生态系统的能量流动和物质循环中发挥着重要的作用[5]。海洋线虫对环境具有较高的耐受程度,生殖周期短且具有持续的生殖能力,而且对广盐、低氧都具有较强的耐受力,这些特点使得它在沉积物中广泛存在,因此,海洋线虫常被用于评价底栖生态系统健康程度和环境变化的良好指示类群[5-6]。此外,线虫作为对人为扰动的一种潜在指示物,已引起了研究人员的高度关注[7]。
目前,国际有关砂质潮间带小型底栖动物的研究已遍及热带、亚热带、温带、寒带等气候带区域。这些研究揭示了不同地区砂质潮间带小型底栖动物(包括海洋线虫)群落特点及与环境因子的关系。沉积物分选系数[8]、沉积物类型[9-11]、有机物含量[11]、化学污染(有机物和重金属)[12]、水动力状态[12]等往往对各地砂质潮间带小型底栖动物(包括海洋线虫)的群落特征和多样性格局产生重要影响。同时,小型底栖动物大尺度时空分布及季节变化也有报道。Kotwicki等[13]对处于北极、温带、亚热带、热带及南极沿海沙滩小型底栖动物的纬向分布研究,以及Lee和Riveros[14]对智利(18°~42°S)沿岸66处裸露沙滩自由生活海洋线虫物种丰富度的纬向变化模式研究均显示,小型底栖动物(包括海洋线虫)扩散到更高纬度地区受温度制约,能量越高的地区物种越丰富。这对小型底栖动物纬向分布模式的探索具有重要意义。但是,相关研究有限,这一格局仍需要在更广范围内进行探索和验证。同时,局部环境条件的差异对海洋线虫分布的重要性也需要在更广范围进行评估。
我国沿岸潮间带底栖生物的研究从20世纪50年代开始。国内学者对砂质潮间带小型底栖动物包括海洋线虫的研究主要集中在秦皇岛、大连、青岛、厦门等地[15-31],研究内容包括小型底栖动物群落动态、多样性以及对环境变化和人为扰动的响应,极大地丰富了中国砂质潮间带小型底栖动物的研究,为深入了解中国沙滩生态系统的结构及小型底栖动物对沙滩生态系统的作用提供了大量的数据支持。大连位于中国辽东半岛最南端,具有海洋性特点的暖温带大陆性季风气候,四季分明,但冬无严寒,夏无酷暑,年平均气温为8~11℃,自南向北降低,是我国东北地区最温暖的地区。且大连东濒黄海,西临渤海,黄海与渤海风浪、潮汐、洋流等水文条件的差异[32-34],引起砂质潮间带沉积环境及水动力特征的差异,形成各自独特的沉积环境。张志南等[18]对大连石槽岩礁的附植小型底栖动物包括海洋线虫进行了调查,结果显示,在大多数的藻类样品中,海洋线虫是小型底栖动物中最优势的类群,在鉴定出的46种海洋线虫中,沉积食性的锐棘线虫(Theristus acer)作为优势种普遍分布,指示了大连石槽岩礁潮间带的隐蔽性。Hua等[30]对国内9个砂质潮间带包括大连夏家河子进行小型底栖动物的研究,结果显示,夏家河子砂质潮间带海洋线虫为优势类群,拥有较高的平均丰度(大于2 000 ind./(10 cm2)),其值高于亚热带地区沙滩。杨丹[31]在大连港石油管爆炸漏油事故后1年,对受影响的大连星海海滨浴场海洋线虫群落的研究表明,海洋线虫丰度和多样性较低,耐石油烃的马丽林恩线虫属(Marylynnia)数量增多,石油烃通过有机碳、盐度和pH间接影响了海洋线虫群落结构。这些研究促进了对大连潮间带生态系统以及小型底栖动物群落结构和功能的了解,为大连沙滩生态环境的保护和监测提供了科学数据。但总体上,仍缺乏大连砂质滩小型底栖动物包括海洋线虫群落结构及多样性的基础研究。特别是对濒临渤、黄海的砂质潮间海洋线虫群落结构及多样性特点的比较鲜有报道。
本研究选取濒临渤海的大连夏家河子沙滩和黄海之滨的大连金沙滩作为野外采样点,对海洋线虫群落特征及其生境特点进行研究;目的是了解:(1)两处沙滩线虫群落结构及多样性是否存在差异?(2)引起线虫群落结构及多样性特征差异的主要因子是什么?(3)海洋线虫能否对生境变化提供指示信息。本研究结果可为局域尺度线虫分布特征及影响因子提供数据支持。
2 材料与方法
2.1 研究区域概况
大连位于中国辽东半岛的最南端,东濒黄海,西临渤海,水产品以及海珍品资源丰富,是中国重要的水产养殖基地之一。大连潮间带为不规则半日潮,即在1 d中(指太阴日历时24 h 50 min)有两次高潮和两次低潮,且高潮位与高潮位、低潮位与低潮位潮高不相等。大连3面环海,同时受到黄海及渤海潮流及风浪等的影响,地理位置较为特殊,因此特选取夏家河子海水浴场(39°02′N,121°30′E,平均坡度为 1.3°)、金沙滩海水浴场(38°52′N,121°35′E,平均坡度为 9.0°)作为采样点进行野外采样(图1)。夏家河子和金沙滩分别位于渤海、黄海沿岸,风浪等水文条件存在一定的差异。

图1 大连采样站位Fig.1 Sampling sites in Dalian
2.2 样品采集
2015年12 月(冬季)在金沙滩海水浴场、夏家河子海水浴场砂质潮间带进行野外采样。在潮间带选取两个断面,两个断面之间间隔约为100 m,分别设置高潮带、中潮带、低潮带采样点进行小型底栖动物和环境因子样品的采集。每一个采样点,使用内径为4.4 cm的PVC采样管采集3管20 cm深的沉积物芯样,用于小型底栖动物的分选。芯样采出后立即装入500 mL样品瓶中,并加入等体积的10%甲醛溶液,混匀密封后常温保存,带回实验室进行分选。同时,每一个采样点另取两管20 cm深的沉积物芯样装入封口袋中,-20℃冷冻保存,用于粒度、有机质、叶绿素a(Chla)、质量比等环境因子的测定,并在每个采样点使用多参数水质仪(In-Situ Inc,Smartroll MP)进行间隙水的水温、pH、盐度和溶解氧的原位测定。
2.3 室内分析
小型底栖动物样品分选前,加入虎红染色,样品分选采用倾上清液淘洗法,即将上清液分别过孔径为500 μm和31 μm的两层网筛淘洗,将31 μm网筛截留的生物转移到划线培养皿中,在解剖镜下按小型底栖动物类群鉴定计数。
海洋线虫的鉴定:分选获得的海洋线虫,虫体透明后制成永久封片,在显微镜下观察并鉴定至种水平[35],在属名后添加sp.1、sp.2等区分同一属的不同种。
Wieser[36]将自由生活的水生线虫与其口腔的形态结构联系起来,将线虫的摄食类型划分为4类。即(1)1A型:选择性沉积食性者,不具口腔或口腔很小,依靠食道的吸力,以细菌大小的有机颗粒为食;(2)1B型:非选择性沉积食性者,具有不具齿的杯状口腔,依靠食道的吸力和唇部及口腔前部的运动获得食物;(3)2A型:刮食者,具有带小齿的口腔,将食物刮起,刺破其细胞壁,吸取其中的细胞液;(4)2B型:捕食者或杂食者。具有带大颚的发达口腔,将被捕食者整体吞食,或刺破其细胞壁,吸取其中的胞液。
沉积物有机质含量按《海洋监测规范》[37]中有机质的测定方法进行测定,即重铬酸钾氧化法。沉积物粒度采用激光粒度仪测定,粒径分布曲线上小于该粒径的沉积物颗粒的质量占沉积物总质量的50%对应的粒径即为中值粒径MDΦ=Φ50,其中,Φ=-log2d,d为沉积物颗粒直径(单位:mm)。沉积物叶绿素a测定按照《海洋调查规范》[38]中的荧光分光光度计法,计算沉积物中叶绿素a质量比。
2.4 数据处理与分析
应用ArcGis 10.2绘制采样站点图。应用SPSS软件对所得的生物数据和环境因子进行独立样本T检验(Independent-SamplesTTest)或单因素方差分析(One-way ANOVA)及多重比较(Tukey HSD)。在进行单因素方差分析前,进行Levene方差齐性检验,若方差不齐,则对其进行对数转换至方差齐,之后进行检验;如果数据转换后方差仍然不齐,则进行非参数检验(Kruskal-wallis)。对生物数据及各环境因子进行Pearson相关性分析。应用PRIMER 6.0软件进行多元统计分析:对环境因子进行主成分分析(Principal Component Analysis,PCA);对海洋线虫群落结构进行非度量多维标度( Non-metric Multi-dimensional Scaling,MDS)分析;采用相似性检验(Analysis of Similarity tests,ANOSIM)群落组间差异的显著性,并通过相似百分比(Similarity Percentages,SIMPER)分析优势种对相似性的贡献;利用生物-环境相关分析(Biota-En-vironment,BIO-ENV),了解环境因子与生物群落数据之间的相关关系。
海洋线虫丰富度指数d、香农-威纳多样性指数H'、 均匀度指数J′和优势度指数 1-λ′计算公式如下:

式中,N表示所有物种的个体数之和;S为物种数目;Pi=Ni/N,Ni表示属于第i种的个体数之和。
3 结果
3.1 环境因子
夏家河子和金沙滩潮间带环境因子结果见表1。2015年12月,夏家河子间隙水的平均温度为(1.46±0.81)℃,其潮区温度表现由高到低为高潮带、中潮带、低潮带;间隙水盐度、pH、溶氧浓度平均值分别为 29.27±2.13、8.34±0.11、(4.97±1.40)mg/L。金沙滩的平均温度为(7.63±0.56)℃,潮区间隙水温度表现由高到低为中潮带、低潮带、高潮带;其间隙水盐度、pH、溶氧浓度平均值分别为 34.32±0.59、7.95±0.17、(7.17±2.64)mg/L。夏家河子沉积物叶绿素a质量比、有机质含量平均值分别为(1.19±0.60)μg/g、(0.06±0.04)%,金沙滩则分别为(0.24±0.19)μg/g、(0.80±0.29)%。夏家河子沉积物中值粒径(MDΦ)平均值为(2.82±0.26)Φ,金沙滩为(0.49±0.80)Φ。夏家河子的沉积物组成中,125~250 μm的颗粒(细砂)占比较高,而金沙滩沉积物颗粒主要是250~500 μm(中砂)。独立样本T检验显示,夏家河子和金沙滩两处潮间带在间隙水温度、pH、盐度、沉积物叶绿素a质量比、有机质含量、中值粒径(MDΦ)都存在极显著差异(p<0.01)。
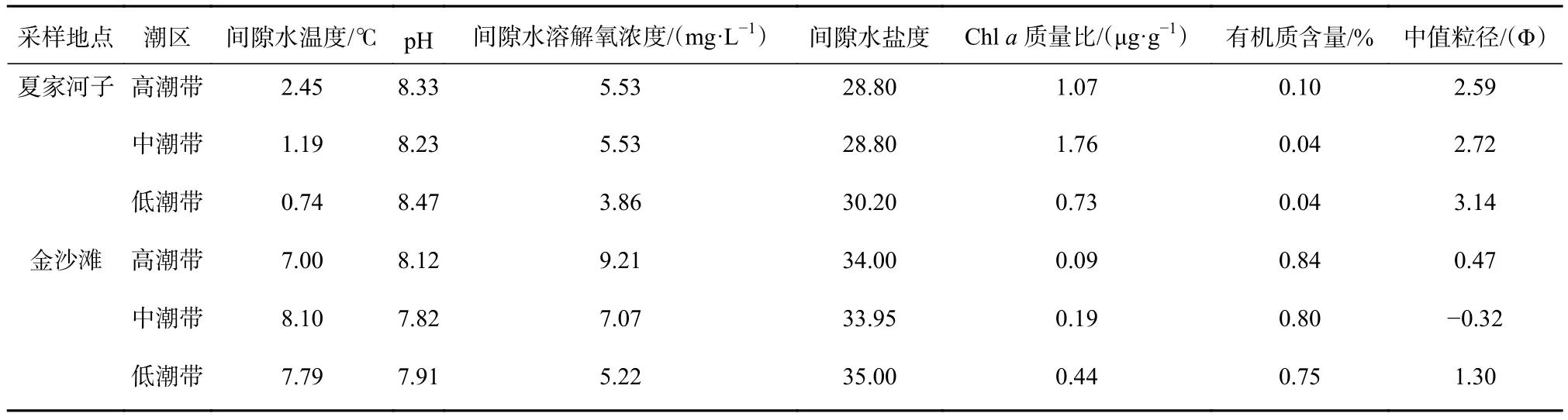
表1 两处沙滩各潮间带环境因子Table 1 Environmental factors in different tidal zones of two beaches
对两处沙滩不同潮区的环境因子分别进行单因素方差分析及多重比较。结果显示,夏家河子不同潮区之间温度存在极显著差异(p<0.01),Tukey HSD结果显示,高潮带和中潮带之间存在显著差异(p<0.05),高潮带和低潮带之间存在极显著差异(p<0.01),而中潮带和低潮带之间无显著差异;中潮带和低潮带的pH存在显著差异(p<0.05);低潮带的MDΦ高于高潮带和中潮带(p<0.01),高潮带和中潮带则无显著差异。其余环境因子在夏家河子不同潮区间均无显著差异。金沙滩不同潮区之间的环境因子无显著差异(p>0.05)。
大连沙滩各环境因子的主成分分析结果如图2所示,反映了两处沙滩环境特征明显不同。PC1轴(第一主成分轴)解释环境变量的71.4%,PC1和PC2轴(第二主成分轴)累计解释环境变量的84%。其中对第一主分量贡献较大的是温度(0.438)、中值粒径MDΦ(-0.422)、有机质含量(0.409)、pH(-0.387)和盐度(0.371),它们是两处沙滩环境特征差异的主要因子。对第二主分量贡献较大的是溶氧(0.871)。

图2 两处沙滩环境因子主成分分析Fig.2 Principal component analysis of environmental factors in two beaches
3.2 海洋线虫丰度
大连两处沙滩高、中、低潮带海洋线虫丰度的分布如图3所示。夏家河子海洋线虫的平均丰度为(592.0±318.9)ind./(10 cm2),金沙滩海洋线虫的平均丰度为(54.6±53.8)ind./(10 cm2)。独立样本T检验显示,两处沙滩海洋线虫丰度存在极显著差异(p<0.01)。夏家河子中潮带海洋线虫丰度最高,为(745.3±313.4)ind./(10 cm2),而低潮带最低,为(396.2±167.9)ind./(10 cm2),高潮带海洋线虫丰度为(634.4±339.1)ind./(10 cm2)。单因素方差分析显示,夏家河子各潮区海洋线虫丰度无显著差异。金沙滩潮间带海洋线虫丰度较低,高、中、低潮带平均丰度分别为(72.2±51.3)ind./(10 cm2)、(18.2±9.1) ind./(10 cm2)、 (73.4±63.2) ind./(10 cm2)。非参数Kruskal Wallis 检验显示,金沙滩各潮区海洋线虫丰度无显著差异。

图3 两处沙滩各潮区海洋线虫丰度Fig.3 The abundance of marine nematodes in different tidal zones of two beaches
3.3 海洋线虫优势种及种类组成
本研究中两处沙滩共鉴定出43种海洋线虫,隶属于36属,17科,其中共有种13个。夏家河子共鉴定出38种,隶属于32个属,金沙滩共鉴定海洋线虫18种,隶属于16个属。 夏家河子海洋线虫优势科为希阿利线虫科(Xyalidae,40.50%)、 联体线虫科( Comesomatidae,23.31%)、 色矛线虫科(Chromadoridae,16.3%)、杯咽线虫科(Cyatholaimidae,10.44%);优势属为吞咽线虫属(Daptonema,36.64%)、棘刺线虫属(Theristus,18.31%)、毛萨巴线虫属(Setosabatier-ia,12.38%)、 拟 小色 矛 线 虫 属 (Prochromadorella,10.53%)、似杯咽线虫属(Paracyatholaimus,7.48%)、萨巴线虫属(Sabatieria,4.02%)、深咽线虫属(Bathylaimus,2%);优 势 种 为Daptonemasp.1(21.03%)、Daptonemasp.2(20.61%)、Theristussp.1(14.7%)、Setosabatieriasp.1(10.28%)、Prochromadorellasp.1(8.75%)、Daptonemasp.3(7.07%)、Paracyatholaimussp.1(6.23%)、短毛萨巴线虫(Sabatieria breviseta,3.24%),贡献率累计达到91.91%。金沙滩海洋线虫优势科为瘤线虫科(Oncholaimidae,43.03%)、Chromadoridae(36.8%)、 Xyalidae(15.75%);优势属为瘤线虫属(Oncholaimus,56.39%)、类色矛线虫属(Chromadorita, 16.3%)、Theristus( 10.45%)、 新色矛线虫属(Neochromadora,4.8%)、 嘴 刺 线 虫 属 (Enoplus,3.29%);优势种Oncholaimussp.1 贡 献率最 高,为54.31%,其次为Chromadoritasp.1(16.51%)、Theristussp.2(10.82%)、Neochromadorasp.1(4.48%)、Enoplussp.1(3.39%)、Prochromadorellasp.1(2.89%),其累积贡献率为92.50%。两处沙滩不同潮区海洋线虫优势种的贡献率(不小于5%)如表2所示。就夏家河子而言,Daptonemasp.1、Daptonemasp.2、Theristussp.1在 3个潮区优势度均不小于5%;Setosabatieriasp.1、Prochromadorellasp.1在两个潮区均为优势种;而Axonolaimussp.1、Bathylaimussp.1、Daptonemasp.3、Sabatieria breviseta为只在高潮带占优势的种,Viscosiasp.1则为只在低潮带占优势的种。就金沙滩而言,Oncholaimussp.1、Theristussp.2在3个潮区的优势度均不小于 5%;Chromadoritasp.1、Enoplussp.1、Neochromadorasp.1为在两个潮区占优势的种;Daptonemasp.1、Enoplolaimussp.1、Prochromadorellasp.1、Thalamonhysterasp.1为只在1个潮区占优势的种。

表2 两处沙滩海洋线虫优势种贡献率及其摄食类型(SIMPER分析,优势度≥5%)Table 2 The contributions and feeding types of dominant nematodes species in two beaches (SIMPER analysis,dominance ≥5%)
不同沙滩及不同潮区进行ANOSIM分析,结果显示,大连两处沙滩海洋线虫种类组成存在极显著的差异(R=0.915,p=0.001),夏家河子海洋线虫群落在高潮带和中、低潮带以及中、低潮带之间都存在显著差异(R=0.448,p=0.029;R=0.76,p=0.029;R=0.667,p=0.029),而金沙滩各潮区之间差异不显著(R=0.042,p=0.332)。SIMPER分析(贡献率均不小于5%)显示,引起两处沙滩线虫种类组成差异的种为Daptonemasp.1、Daptonemasp.2、Theristussp.1、Setosabatieriasp.1、Oncholaimussp.1、Daptonemasp.3、Prochromadorellasp.1、Paracyatholaimussp.1。在夏家河子沙滩,主要由Setosabatieriasp.1、Daptonemasp.1、Prochromadorellasp.1、Daptonemasp.3、Bathylaimussp.1、Paracyatholaimussp.1、Axonolaimussp.1、Sabatieria breviseta引起高、中潮带线虫种类组成差异;Setosabatieriasp.1、Viscosiasp.1、Sabatieria breviseta、Daptonemasp.1、Bathylaimussp.1、Daptonemasp.3、Paracyatholaimussp.1引起高、低潮带线虫种类组成差异;Viscosiasp.1为造成中、低潮带线虫种类组成差异的种。
对夏家河子和金沙滩海洋线虫群落数据进行非度量多维标度(MDS)分析,结果如图4所示,两处沙滩的站位各自聚集,具有明显的区别。差异分析如上所述。

图4 两处沙滩海洋线虫群落组成的非度量多维标度(MDS)Fig.4 Non-metric multidimensional scaling plot for marine nematodes community composition in two beaches
3.4 海洋线虫摄食结构
夏家河子海洋线虫群落以1B型为优势摄食类型,占总丰度的82.5%,其次为2A型(13.9%)、2B型(3.5%)、1A型(0.1%)。金沙滩海洋线虫群落优势摄食类型为2B型,占比为51.6%,其次为2A型(29.2%)、1B型(19.0%)、1A型(0.2%)。两处沙滩海洋线虫摄食类型丰度独立样本T检验结果显示,两处沙滩之间1A型线虫丰度无显著差异;1B型存在极显著差异(p<0.01),表现为夏家河子明显多于金沙滩;2A型和2B型均存在显著差异(p<0.05),其中2A型表现为夏家河子高于金沙滩,2B型则相反。两处沙滩海洋线虫摄食类型存在较大的差异,但1A所占比例都较低。不同潮间带海洋线虫摄食类型所占比例如图5所示,夏家河子高、中、低潮带由高到低都表现为1B、2A、2B、1A,金沙滩中、低潮区由高到低则表现为 2B、2A、1B、1A,高潮区由高到低则为 2B、1B、2A、1A。利用丰度数据分别对两处沙滩不同潮区的海洋线虫摄食类型进行单因素方差分析,结果显示,夏家河子高、中潮带的2B型线虫丰度极显著低于低潮带(p<0.01),其余无显著差异;金沙滩各潮区海洋线虫摄食类型丰度无显著差异。
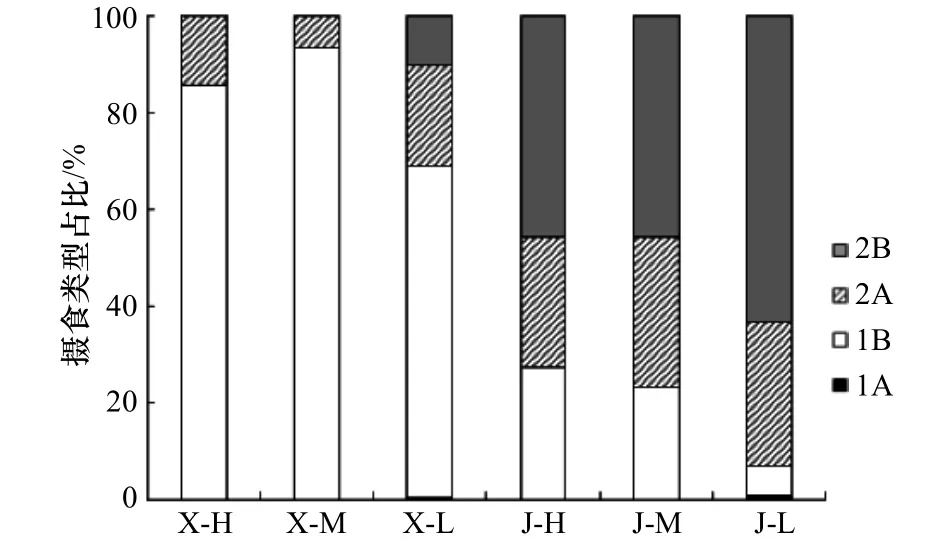
图5 两处沙滩不同潮间带海洋线虫摄食类型占比Fig.5 Proportion of nematodes feeding types in different tidal zones in two beaches
3.5 海洋线虫多样性
夏家河子和金沙滩两处沙滩不同潮区的线虫群落多样性指数见表3。对两处沙滩海洋线虫多样性指数进行独立样本T检验,结果显示:夏家河子潮间带海洋线虫种数S、丰富度指数d和香农-威纳多样性指数H′均极显著地高于金沙滩(p<0.01);均匀度指数J′及优势度指数1-λ′在两处沙滩间无显著差异。对两个沙滩不同潮区多样性指数分别进行单因素方差分析及多重比较(Tukey HSD),结果显示:夏家河子各潮区间均匀度指数存在显著差异,由大到小表现为低潮带、高潮带、中潮带,香农-威纳多样性指数和优势度指数则表现为低潮带显著高于高潮带及中潮带,而高潮带和中潮带间则无显著差异。金沙滩高、中、低潮带均匀度指数存在显著差异(p<0.05),由大到小表现为中潮带、高潮带、低潮带。

表3 研究沙滩海洋线虫多样性指数Table 3 Diversity indices of marine nematodes in study beaches
3.6 海洋线虫群落特征与环境因子的关系
海洋线虫丰度及多样性指数与环境因子的Pearson相关分析结果表明,间隙水温度、pH、盐度以及沉积物叶绿素a质量比、有机质含量、中值粒径(MDΦ)与线虫丰度显著相关。线虫的丰度、物种数以及香农-威纳多样性指数与温度和有机质含量呈极显著的负相关,与pH、和中值粒径(MDΦ)呈显著的正相关(表4)。海洋线虫丰度还与间隙水盐度呈极显著的负相关,与叶绿素a质量比呈显著的正相关(表4)。此外,物种数与叶绿素a质量比之间显著正相关,物种丰富度指数与中值粒径(MDΦ)呈显著正相关(表4)。

表4 大连沙滩海洋线虫丰度及多样性指数与环境因子的相关性分析结果Table 4 Results of correlation analysis of marine nematode abundance and diversity indices with environmental factors in Dalian beaches
两处沙滩线虫群落结构与其环境因子的Pearson相关性分析结果表明,夏家河子间隙水pH与均匀度指数、香农-威纳多样性指数、优势度指数呈显著正相关;叶绿素a质量比与均匀度指数呈显著负相关(表5)。金沙滩海洋线虫群落结构与其环境因子间并无显著相关性(表5)。

表5 不同沙滩海洋线虫丰度及多样性指数与环境因子的相关性分析Table 5 Correlation analysis of marine nematode abundance and diversity indices with environmental factors in different beaches
Bio-env相关性分析结果显示,温度、pH与中值粒径(MDΦ)的组合能最好地解释夏家河子海洋线虫群落结构,其相关系数为0.739;温度、有机质含量与中值粒径(MDΦ)的组合能最好地解释金沙滩海洋线虫群落结构,其相关系数为0.696;pH、有机质含量、中值粒径(MDΦ)能最好地解释两处沙滩海洋线虫群落结构,其相关系数为0.818。
4 讨论
4.1 影响冬季大连砂质潮间带海洋线虫群落特征的因素
本研究结果显示,大连夏家河子和金沙滩海洋线虫群落结构及多样性都存在显著差异,主要体现为:夏家河子线虫群落以沉积食性线虫为优势,丰度高、多样性高;金沙滩海洋线虫群落则丰度低、多样性低,杂食或捕食性线虫占优势。Hulings和Gray[39]推测,夏季生物因子是控制小型底栖生物的主要因素,冬季物理化学等环境因子是主要因素。本研究结果显示,间隙水温度、pH、沉积物中值粒径(MDΦ)和有机质含量是引起研究沙滩间沉积环境差异的重要因子。夏家河子沙滩间隙水pH和中值粒径(MDΦ)高于金沙滩,温度和有机质含量则低于金沙滩。同时,本研究结果显示,pH、有机质含量、中值粒径(MDΦ)能最好地解释两处沙滩海洋线虫群落结构,而且均与海洋线虫群落丰度和多样性指数具有高度相关性。因此,pH、有机质含量及中值粒径(MDΦ)可能是造成两处沙滩群落结构和多样性差异的重要环境因子。
研究表明,沉积物的粒径是影响海洋线虫群落结构和多样性的直接原因[40]。沉积物粒径对潮间带沉积物微环境具有主导作用,尤其是在大尺度的空间分布上,被认为是重要的物理因子[41]。通常认为125~250 μm粒径的沉积物最有助于微/小型底栖动物的生长[42]。Hua等[27]对青岛沙滩海洋线虫群落结构的研究显示,沉积物粒径较细(125~250 μm)的沙滩,海洋线虫多样性高于粒径粗(250~500 μm)的沙滩。本研究结果与Hua等的研究结果一致,夏家河子中值粒径(MDΦ)为(2.82±0.26)Φ,粒径为 125~250 μm 的细砂比例较高,海洋线虫多样性较高;金沙滩中值粒径(MDΦ)为(0.49±0.80)Φ,以粒径为 250~500 μm 的粗砂为主,海洋线虫多样性较低。颗粒较细的沉积物中,体型小、刚毛短的线虫数量较多,进而会引起线虫群落种类组成的变化[43]。夏家河子沙滩线虫群落以体型小的Xyalidae为优势科,金沙滩线虫群落则以体型较大的Oncholaimidae科线虫为优势科。且本研究结果显示,中值粒径与海洋线虫的丰度及多样性高度相关。因此,中值粒径是影响两处沙滩群落结构差异的重要环境因子。线虫口腔结构的差异代表了摄食类型的不同,反映了食物来源的不同及沉积环境中有机物存在形式的差异[44]。Wieser[36]将自由生活的水生线虫与其口腔的形态结构联系起来,将线虫的摄食类型划分为4类,即选择性沉积食性者(1A)、非选择性沉积食性者(1B)、刮食者(2A)、捕食者或杂食者(2B)。非选择性和选择性沉积食者均无齿,前者具有较大的颊腔以吞咽整个有机颗粒(例如硅藻和细菌),而后者具有小的颊腔以消耗较小的颗粒(例如碎屑和细菌)。Urban-Malinga等[45]在对北海砂质沉积物线虫群落的研究中发现,非选择沉积食性线虫的多少与有机质的分解及旧有机质含量呈正相关,而选择沉积食性线虫的多少与沉积环境中新鲜有机质的含量有关。夏家河子非选择沉积食性线虫最多,说明以有机碎屑为起点的摄食结构占主要地位;选择沉积食性者较少,说明研究沙滩新鲜的有机体输入有限。夏家河子低有机质含量和叶绿素a质量比可以证明食物资源受限。青岛仰口沙滩[27]及青岛第二海水浴场沙滩[27]海洋线虫摄食类型也以1B型最多,1A型最少,与夏家河子的研究结果一致。而金沙滩的有机质含量虽高于夏家河子,海洋线虫的丰度和多样性较低,沉积食性线虫比例较低,捕食性或杂食性(2B型)线虫最多。造成这种现象的原因可能是通过食物网而产生的间接影响。有研究表明,底质类型与大型底栖动物的分布息息相关[46],粒级越粗,大型底栖动物密度越小[47]。而金沙滩底质类型为中砂,可能会造成大型底栖动物捕食者的缺少,因此,较多的杂食或捕食性线虫(2B)来填补食物网的空缺[48],从而使得金沙滩2B型海洋线虫占比较高。中值粒径不仅会对线虫群落产生直接的影响,也会通过食物网结构产生间接的影响。福建海坛岛长江澳沙滩[28]的研究也显示,秋冬季节海洋线虫以2B型为主要摄食类型,与金沙滩研究结果相似。
就潮区差异而言,夏家河子沙滩海洋线虫群落种类组成及多样性指数存在显著的潮区差异。夏家河子低潮带线虫群落表现为均匀度指数和优势度指数均高于高、中潮带,杂食或捕食性线虫比例(例如显齿线虫属Viscosia)显著高于高、中潮带,反映了低潮带具有更加复杂的线虫群落结构以及更高的多样性水平。夏家河子低潮带中值粒径(MDΦ)显著高于高、中潮带,沉积物颗粒较小,且本研究结果显示,中值粒径(MDΦ)是引起夏家河子群落组成潮区差异的重要因素之一,因此,中值粒径可能是造成低潮带海洋线虫多样性较高的重要因素。此外,本研究结果表明,夏家河子沙滩间隙水pH与线虫群落种类组成及多样性显著相关,随着由高潮带向低潮带间隙水pH的增加,线虫多样性增加。但是,金沙滩线虫群落结构及多样性在不同潮区间较一致,仅中潮带均匀度指数显著高于其他潮区,代表了相同的线虫群落。该沙滩环境因子在不同潮区间差异不显著,特别是温度、有机质含量与中值粒径等环境因子的一致性,决定了海洋线虫群落结构及多样性水平在潮区间差异不显著。
另外,水动力也是造成海洋线虫群落结构差异的重要因素。海水的运动包括波浪、潮汐、沿岸流等,是形成海滩砂的最主要因素。不同岸段滨岸的水动力强弱不同,海滩沉积物的粒径不同。水动力环境可通过影响沉积物的粒度间接影响海洋线虫的丰度及多样性。夏家河子位于半封闭的海湾,受渤海水动力的影响。渤海是一个近封闭的内陆海,水域相对较浅,平均水深为18 m。金沙滩位于黄海北部海岸,受北黄海水动力的影响,北黄海平均水深为38 m。就海浪而言,渤海与北黄海海浪均以风浪为主,渤海平均波高多为0.1~0.7 m,随季风的交替具有明显的季节性[33],风区较小;而北黄海海浪秋冬两季最大,浪高2.0~6.0 m,当有强大寒潮过境时,浪高有时达3.5~8.5 m。就潮流而言,夏家河子位于渤海海峡北部,为不规则半日潮,渤海海峡平均潮差约为1 m[34]。而金沙滩位于北黄海沿岸,黄海沿岸的平均潮差约为2.1 m,潮流流速一般为1~2 kn[33]。渤海和黄海是强潮流海区,相比之下,海流较弱,黄海暖流流速约为0.2~0.3 kn左右,冬季强、夏季弱,在进入渤海时,势力就已经非常弱了[34]。总体而言,金沙滩海域水动力较强于夏家河子海域。研究表明,在强水动力条件下,细粒物质被搬运到别处,而沉积粗粒物质,弱水动力条件则相反[49]。夏家河子相对弱的水动力条件使得沙滩沉积细砂,金沙滩相对强的水动力条件使得其沉积较粗的中砂。所以,水动力的差异可能是造成夏家河子和金沙滩沉积粒径差异的一个重要原因,进而影响线虫群落结构及多样性。此外,水动力条件也会对海洋线虫的群落造成直接的影响。研究表明[50],线虫在水平方向上的不均匀分布是受环境因子的不均匀分布所控制,当然水动力引起的底栖动物的被动扩散[51]也会对其分布情况造成一定的影响。Armenteros等[12]认为,水动力机制控制线虫群落结构的多样性格局,低的水动力状态使得线虫的分散性差,从而导致线虫群落结构的不均匀分布。夏家河子水动力弱,线虫分散性差,其水平方向上海洋线虫群落结构及多样性不均匀,表现出显著的潮区差异;而水动力较强的金沙滩,水平方向上群落结构及多样性较为均一,潮区差异不显著。因此,水动力状态也是引起两处沙滩线虫群落水平分布的重要因素。
4.2 与以往研究的比较
与大连沙滩以往研究相比,本研究海洋线虫群落平均丰度较低。夏家河子海洋线虫平均丰度为(592.0±318.9)ind./(10 cm2),显著低于 2011 年 3 月夏家河子[30]海洋线虫的丰度 为(2 102.3±693.7)ind./(10 cm2),季节差异可能是丰度产生差异的主要原因。此外,本研究线虫群落优势属组成不同于以往研究。本研究中,夏家河子海洋线虫群落以Xyalidae为优势科,该科Daptonema属和Theristus属线虫丰度占总丰度的55%,而与杨丹[31]研究中的优势属后瘤线虫属(Metoncholaimus)、 微口线虫属(Terschellingia)、Neotonchoides、 Aconthonchus、矛咽线虫属(Dorylaimopsis)、 近色矛线虫属(Chromadorina)等均不相同。一方面,同一地区不同季节优势属不尽相同[28],本研究只涉及1个季度(2015年12月),而以往研究[31]涉及4个季度5个采样时刻(2011年9月及2012年5月、7月、9月、11月)。另一方面,采集的芯样深度和分选网筛孔径的选择也有不同:本研究采集的芯样为20 cm,选择孔径为31 μm的网筛进行小型底栖动物的分选,而杨丹[31]的研究采集的芯样为5 cm,采用了42 μm的网筛进行分选,因此,本文包含了更多以往研究[31]中没有分选到的线虫,特别是个体较小的种。Daptonema属和Theristus属线虫个体小(多数体长0.5~2 mm、体宽 20~50 μm)[35],生活周期短,对环境的适应能力很强,常见于各种海洋生境。在青岛太平湾第二海水浴场和石老人沙滩[27]、福建海坛岛长江澳沙滩[28],Daptonema属和Theristus属线虫也以优势属出现。本研究中,大连金沙滩冬季海洋线虫平均丰度为 (54.6±53.8) ind./(10 cm2), 海 洋 线 虫 优 势 科 为Oncholaimidae,该科Oncholaimus属线虫丰度占总丰度的56%。Lü等[52]和杨丹[31]分别在大连港石油管爆炸漏油事故发生后40 d和1 a,对受影响的大连星海海滨浴场海洋线虫群落进行研究,结果表明,耐石油烃的Marylynnia属线虫数量受影响而增多,石油烃通过有机碳、盐度和pH间接影响了海洋线虫群落结构。本研究的金沙滩与该沙滩位置相近,均可受漏油事故影响。但是,本研究没有发现Marylynnia属线虫,线虫群落种类组成与其差异较大。一方面,这与生境差异有关;另一方面,线虫优势属组成的差异与石油污染的清理及恢复有关。遗憾的是,未见金沙滩海洋线虫群落背景及受影响后的对比研究,无法对线虫群落对漏油事件的响应进行准确评价。大连沙滩线虫群落结构及多样性与以往研究的比较与分析仍有待深入研究。
5 结论
(1)两处研究沙滩海洋线虫丰度、群落结构及多样性存在显著差异。夏家河子海洋线虫丰度及多样性显著高于金沙滩,其以非选择型沉积食性线虫为主,而金沙滩则以杂食性或捕食性线虫为主。间隙水pH、沉积物有机质含量及中值粒径可能是引起海洋线虫群落结构及多样性差异的主要因子,而沉积物中值粒径对海洋线虫群落特征的影响最为突出。其次,水动力通过选择性沉积不同粒径的沉积物从而造成两处沙滩海洋线虫群落特征的差异。
(2)夏家河子沙滩海洋线虫种类组成及多样性指数存在显著的潮区差异,低潮带多样性水平较高,杂食或捕食性线虫比例高,pH和中值粒径可能为主要的影响因子;金沙滩海洋线虫群落特征及多样性水平在潮区间差异不显著,其环境因子的一致性决定了这一特征。水动力状态也会对研究沙滩的海洋线虫群落水平方向上的分布(如潮区分布)造成一定的影响。
(3)与大连沙滩以往研究相比,本研究夏家河子海洋线虫丰度和优势属与以往研究不同,季度、采样深度及分选方法可能是其主要原因。
