肝功能衰竭患者血清乳酸、苹果酸脱氢酶1水平变化及其与合并感染的关系
2021-09-01郭金石春霞邓威张璐懿陈倩龚作炯
郭金,石春霞,邓威,张璐懿,陈倩,龚作炯
武汉大学人民医院感染科,武汉430060
肝脏作为人体能量代谢(糖、脂质、蛋白质合成)的重要枢纽,在各种原因(病毒、酒精、药物等)导致肝细胞坏死,肝功能急剧恶化,出现LF时,可以观察到明显的能量代谢异常,常表现为高乳酸血症、低酮体、三羧酸循环和尿素循环抑制等特点[1-3]。肝功能衰竭(LF)可表现为意识障碍和凝血功能紊乱,是常见且致命的临床急症[4]。苹果酸脱氢酶1(MDH1)是一种胞质蛋白,可以利用NADH将苹果酸转化为草酰乙酸,在胞质的苹果酸—天冬氨酸穿梭、草酰乙酸还原中起重要作用[5-6]。MDH1的分布与能量代谢水平呈正相关,主要存在于心脏和骨骼肌中,但在肝脏中也有相当量的表达[7-8]。乳酸一度被用作揭示机体缺氧的指标,但越来越多的文献表明,在肿瘤细胞以及免疫细胞发生代谢重编程后,通过有氧糖酵解也会产生大量的乳酸[9]。文献[10]报道,在糖酵解加速的癌组织中MDH1活性及乳酸水平增加。LF患者由于免疫失调易合并感染[11],而LF和败血症时均伴有代谢亢进,糖酵解增强[12]。但目前针对乳酸和MDH1与LF能量代谢联系的研究较少。2019年3—10月,我们观察了LF患者血清乳酸、MDH1水平变化,并分析乳酸、MDH1与LF患者合并感染的关系。
1 资料与方法
1.1 临床资料 LF合并感染35例(合并组),男25例,女10例;年龄(49.2±13.8)岁。肝衰竭患者40例(衰竭组),男28例,女12例;年龄(50.0±14.0)岁。肝硬化患者40例(硬化组),男28例,女12例;年龄(53.6±10.8)岁。诊断标准:硬化组根据患者临床表现、病史、影像学、超声、实验室检查等诊断[13],衰竭组符合《肝衰竭诊治指南(2018年版)》[14],合并组诊断标准综合了肝衰竭指南与文献[15]。排除标准:①肝癌病例;②合并心、肺、脑、肾等重要脏器严重病变者;③合并其他恶性肿瘤病例;④合并妊娠病例。同期健康体检者20例(正常组),男12例,女8例;年龄(51.6±6.7)岁。体检健康者无肝脏相关疾病病史,无慢性病病史。4组一般资料无统计学差异,具有可比性。本研究经武汉大学人民医院伦理委员会批准通过,所有患者均签署知情同意书。
1.2 乳酸、MDH1和临床生化指标检测方法 采集入选对象血清标本,使用人MDH1酶联免疫试剂盒(武汉华美生物工程有限公司)检测MDH1,根据说明书向包被抗MDH1抗体的酶标板中依次加入标本或标准品以及试剂,用酶标仪在450 nm波长下测定吸光度(OD值),计算样本浓度;使用乳酸检测试剂盒(南京建成生物工程研究所有限公司)检测乳酸,严格按照说明书加入检测样本及试剂,酶标仪测定波长630 nm处OD值,计算相应样本浓度。CS5100全自动血凝分析仪(日本Sysmex)检测PTA、国际标准化比值(INR),XN-9000血细胞计数仪(日本Sys‑mex)检测红细胞计数(RBC)、白细胞计数(WBC)、中性粒细胞比例(N%)、血小板计数(PLT)、血红蛋白(Hb),ADVIA2400全自动生化分析仪(日本Sie‑mens)检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、总胆红素(TBiL),iCHROMA免疫荧光分析仪(韩国BodiTech)检测超敏C-反应蛋白(hs-CRP)。
1.3 统计学方法 采用SPSS25.0统计软件。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较使用LSD检验;非正态分布计量资料用中位数(四分位数间距)[M(Q)]表示,比较采用非参数检验。Pearson相关分析法分析血清乳酸、MDH1及临床生化指标的相关性。多因素Logistic回归分析法分析LF患者合并感染的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清乳酸、MDH1水平比较 血清乳酸、MDH1水平比较见表1。
表1 各组血清乳酸、MDH1水平比较(±s)
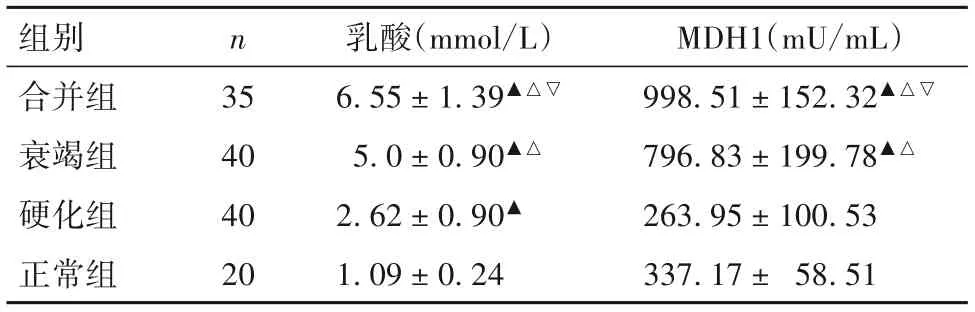
表1 各组血清乳酸、MDH1水平比较(±s)
注:与正常组比较,▲P<0.05;与硬化组比较,△P<0.05;与衰竭组比较,▽P<0.05。
组别合并组衰竭组硬化组正常组n 35 40 40 20乳酸(mmol/L)6.55±1.39▲△▽5.0±0.90▲△2.62±0.90▲1.09±0.24 MDH1(mU/mL)998.51±152.32▲△▽796.83±199.78▲△263.95±100.53 337.17± 58.51
2.2 各组PTA、INR、WBC、N%、RBC、Hb、PLT比较 PTA、INR、WBC、N%、RBC、Hb、PLT比 较见表2。
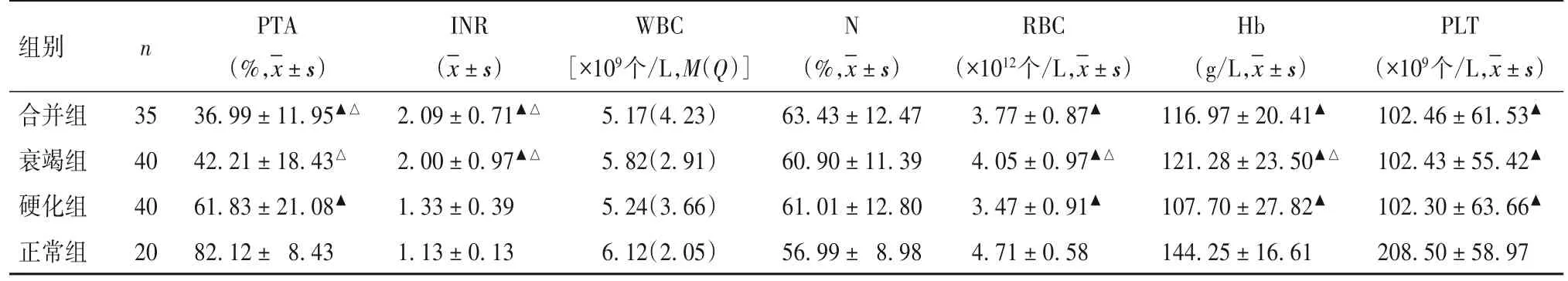
表2各组PTA、INR、WBC、N%、RBC、Hb、PLT比较
2.3 各组ALT、AST、ALB、TBiL、hs-CRP水平比较 ALT、AST、ALB、TBiL、hs-CRP比较见表3。

表3各组ALT、AST、ALB、TBiL、hs-CRP水平比较
2.4 血清乳酸、MDH1水平与临床生化指标的相关性 血清乳酸水平与MDH1(r=0.838)、TBiL(r=0.639)呈正相关,与PTA(r=-0.555)、ALB(r=-0.510)呈 负 相 关,P均<0.05;MDH1水 平 与TBiL(r=0.581)、AST(r=0.427)、ALT(r=0.421)呈正相关,与PTA(r=-0.562)、ALB(r=-0.436)呈负相关,P均<0.05;MDH1与 乳 酸 呈 正 相 关(r=0.838,P<0.05)。
2.5 LF合并感染危险因素分析结果 根据衰竭组及合并组乳酸、MDH1、ALT的中位数将连续型变量转化为分类变量,性别、年龄为哑变量,以LF是否合并感染为因变量(赋值0=未发生感染,1=合并感染),乳酸、MDH1为自变量,年龄、性别、ALT为协变量进行多因素Logistic回归分析,结果显示乳酸≥5.71 mmol/L、MDH1≥939.90 mU/mL是LF患者发生感染的危险因素,详见表4。

表4 LF合并感染多因素Logistic回归分析结果
3 讨论
LF是由各种原因导致的严重肝损害,伴有肝、肾、脑、凝血等多个系统功能衰竭,病死率高[16],目前主要通过肝脏合成、代谢、免疫等方面的指标评估LF患者肝功能损伤程度[17]。但现有的指标对于LF进展的评估仍存在一定的局限性,并且感染作为LF的常见合并症,其发生风险的判定对于临床诊断和治疗都至关重要。在合并感染的急性肝衰竭(ALF)患者中,30%的患者没有典型的发热和炎症指标(如WBC、CRP)升高表现[11],因而需要相关指标明确发生感染的风险,通过早期识别改善预后。
肝脏作为调节人体能量代谢的中心,占机体能量消耗的24%,LF患者肝细胞破坏量为80%~85%,表现出了更高的能量消耗水平[18]。正常情况下,细胞主要由线粒体氧化磷酸化供能,LF时出现线粒体功能障碍,可出现能量代谢紊乱(糖酵解亢进、蛋白质、脂肪、氨基酸分解代谢及脂肪酸β氧化抑制)[19]。类比癌细胞及固有免疫细胞的代谢重编程(Warburg效应),即通过增强糖酵解以快速生产能量,MDH1将草酰乙酸转化为苹果酸时伴随NAD+的产生,协同乳酸脱氢酶(LDH)促进糖酵解[10,20]。GAUDE等[21]发现,线粒体功能障碍时,MDH1也起到了辅助糖酵解的作用。MDH1表达基因敲除后,胞质NAD+/NADH比例下降90%,进一步印证了MDH1的辅助功能[22]。据报道[12,23-24],ALF患者内脏血流量并未有明显减少,发生严重肝损伤时,心输出量在48 h内可达峰值,外周血管阻力下降,肝血流增加5倍[25]。研究[26]显示,内脏循环异常可能导致血流分配不足和微循环障碍,部分组织灌注不足。但进一步实验却证明,LF时乳酸的产生主要来源于有氧糖酵解,乳酸水平与肝脏能量代谢状态有关。
本研究显示,乳酸和MDH1水平在各组依次为:合并组>衰竭组>硬化组>正常组,MDH1水平变化可能的机制包括:①LF时线粒体氧化磷酸化障碍、有氧糖酵解加速。因此,细胞内增加的糖酵解代谢可能导致MDH1的表达增加。②作为一种胞质蛋白,MDH1在门脉区组织损伤时释放入血,肝损伤时血清MDH1升高,这与SCHOMAKER等[27]的研究结果相符,他们还对比了肝损伤恢复期MDH1下降速度,提示基于其半衰期短的特性,可以更好的反映肝功能恢复情况。此外,肝酶如ALT等的释放可能与血流动力学变化密切相关,但MDH1的增加是否有此种机制的参与仍需进一步探讨[28]。YU等[29]发现,ACLF患者糖酵解抑制,可能与我们研究选取的患者LF临床类型和严重程度不同有关。因为随着肝细胞衰竭进展,糖酵解相关的基因(葡萄糖6-磷酸脱氢酶、丙酮酸脱氢酶磷酸酶催化亚基2、葡萄糖磷酸变位酶、葡萄糖-6磷酸酶催化亚基)表达下调,糖酵解亦减弱[20]。乳酸的变化可能与LF时糖酵解加速和糖异生减少有关[30]。同时由于肝脏是乳酸清除的主要部位(占全身的70%),肝细胞的大量破坏可能导致乳酸清除减少[26,30]。本研究还显示,乳酸和MDH1分别与反映肝功能异常的指标(PTA、TBiL、AST、ALB、ALT)以及TBiL、PTA、ALB水平具有明显相关性,提示乳酸和MDH1水平能够良好反应肝功能受损程度。此外多因素Logistic分析表明,乳酸≥5.71 mmol/L和MDH1≥939.90 mU/mL是LF患者发生感染的危险因素。这与许多研究[9]的结论一致,即败血症和内毒素能增加有氧糖酵解、产生乳酸是一致的。合并感染时Toll样受体诱导免疫和炎症反应,与配体(细菌成分和内源性配体)结合后引发细胞信号级联反应,最终调控细胞内转录。如脂多糖与巨噬细胞上的Toll样受体4结合后可促进能量代谢从氧化磷酸化向有氧糖酵解转化[9]。据报道[31],LF是否合并感染似乎并不能明显影响LF患者血液代谢物质水平,但研究[19]表明败血症相关的ACLF通过病原相关分子模式诱导全身炎症反应,表现为更强烈的糖酵解。
总之,LF患者血清乳酸、MDH1水平升高,血清乳酸≥5.71 mmol/L、MDH1≥939.90 mU/mL是LF患者发生感染的危险因素。因而可以密切监测患者血清乳酸、MDH1水平变化,积极采取对症治疗措施,以预防感染、改善LF患者预后。
