Wnt信号通路在疾病中的调控作用研究进展
2021-08-31施佳蕾乔丹丹何慧芬秦爱建
施佳蕾,乔丹丹,何 倩,何慧芬,秦爱建,3,钱 琨,3
(1.扬州大学 禽类预防医学教育部重点实验室,扬州 225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州 225009;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
1 Wnt信号通路
Wnt信 号通路是多细胞生物中高度保守的通路之一,其调控细胞生长、发育以及分化,在机体正常生长发育过程中起到十分重要的作用。Wnt信号通路可以概括为两种形式:Wnt/β-catenin经典途径和非经典Wnt信号通路(图1)。
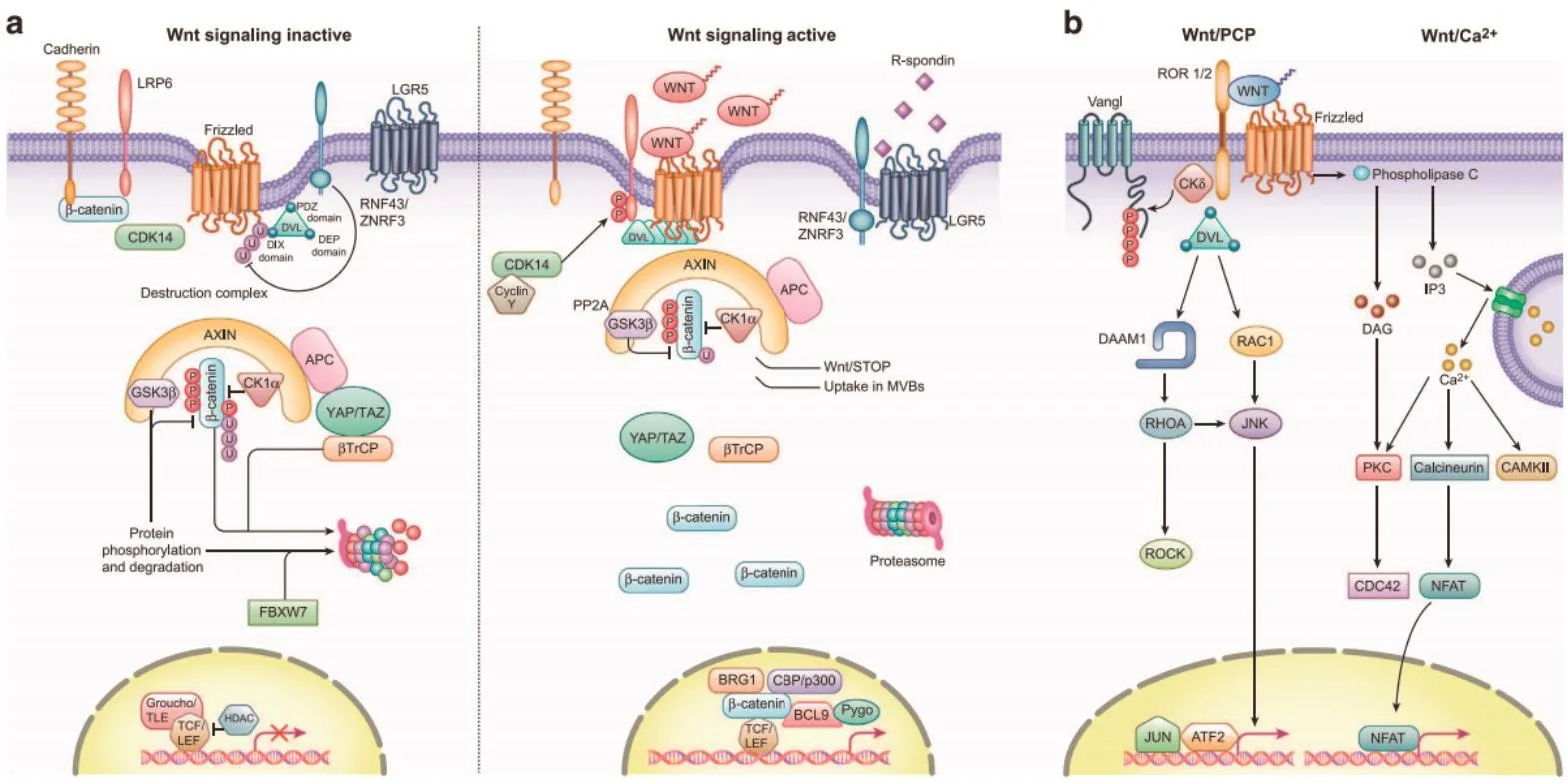
图1[1] 经典和非经典Wnt信号通路Fig.1 Overview of canonical and non-canonical Wnt signaling
Wnt/β-catenin经典途径由以下成员组成:β-连环蛋白(β-catenin)、Wnt配体蛋白、卷曲蛋白(frizzled,Fzd)、低密度脂蛋白受体相关蛋白5/6(low density lipo-protein receptor related protenin 5/6,LPR5/6)、散乱蛋白(dishevelled,Dvl)、细胞骨架轴蛋白(Axin)、腺瘤性结肠息肉蛋白(adenomatous polyposis coli,APC)、糖原合成激酶-3β(Glycogen syntase kinase 3β,GSK-3β),T细胞因子(T cell factor,TCF)/淋巴样增强因子(lymphoid enhanceing factor,LEF)等。非活化状态下,β-catenin在Axin/APC/GSK-3β组成的降解复合物的作用下发生磷酸化而被降解;当Wnt信号通路被激活时,Wnt配体蛋白与卷曲蛋白受体结合,激活散乱蛋白,阻止β-连环蛋白磷酸化和泛素化,从而β-连环蛋白在胞浆中积累,积累到一定程度即转入细胞核中,与LEF/TCF转录因子结合激活下游靶基因如c-Myc、Cyclin D1等基因表达[2-3]。近年来研究发现,W nt/β-catenin经典信号通路在干细胞自我更新、胚胎早期发育、器官形成、组织再生等生理过程中有至关重要的作用,与人类多种肿瘤疾病的发生和发展存在着密切联系,其发生基因突变或Wnt相关配体表达水平改变,从而导致癌症的发生、发展,如肝癌[4-5]、乳腺癌[1,6-7]、黑色素瘤[1,8-9]等。
与Wnt/经 典途径不同,非经典Wnt信号通路包含了许多不依赖β-catenin的途径,主要包括平 面细胞极性途径(Wnt/PCP)和Wnt/Ca2+途径。平面细胞极性途径由JNK介导,在组织和极性方面的作用保守。JNK是一种特异性磷酸化核内转录因子c-Jun的激酶。该途径通过Wnt5a或Wnt11与Fzd受体结合而激活,同时可能激活G蛋白和Dvl[10],活化后可导致细胞的非对称分布,细胞骨架重排,调控胚胎发育过程中的细胞迁移[11]。
Wnt/Ca2+途径的活化过程是由Wnt配体与Fzd受体结合激活G蛋白后激活磷脂酶C(phospholise C,PLC),PLC水解膜磷脂,从而生成第二信使二脂酰甘油(diacylglycerol,DAG)和三磷酸肌醇(inositol trisphosphate,IP3),DAG激活蛋白激酶C,IP3诱导Ca2+从内质网释放,导致细胞中Ca2+浓度升高[12]。目前研究表明,细胞内活化T细胞核因子(nuclear factor of activated T-cells,NFAT)和Nemo样激酶(nemo-like kinase)是两个主要的下游效应分子。Calpain 2是钙依赖性的细胞内半胱氨酸蛋白酶家族的成员之一,经研究发现其通过W nt/Ca2+途径参与调节中胚层迁移、中胚层和神经会聚延伸,被确认为Wnt/Ca2+途径新的一员[13]。近年来研究发现,Wnt/Ca2+途径与造血干细胞的衰老、破骨细胞的分化以及某些癌症的发展有关[14-15]。Farrera等[16]发现Wnt5A在鸡胚软骨分化过程中促进Ca2+的释放,证实Wnt/Ca2+途径在家禽软骨分化过程中也起到一定的作用。
2 Wnt信号通路与癌症
2.1 结直肠癌结直肠癌(colorectal cancer,CRC)是第二大常见的癌症,且发病趋势呈年轻化[17]。调节肠道上皮细胞的生长发育是Wnt信号通路重要的功能之一,Wnt信号通路的异常调节与结直肠癌的发生与发展密切相关。APC和Axin 2是Wnt信号通路中的成员,二者的异常表达在结直肠癌的发展过程中较为突出,可作为检测早期结直肠癌的标志物[18]。哺乳动物携带两种APC基因,分别为APC和APC2。APC和APC2有相似的结构,但APC与β- catenin结合更有亲和力[19]。在大多数结直肠癌肿瘤中,APC的两个等位基因都发生突变,胚系突变大多发生于第15外显子5'处的密码子1055和1309之间的区域,而体细胞突变大多发生于包含密码子1286和1513的突变密集区中。95%的突变是移码和无义突变,突变后缺失了形成降 解位点的5个氨基酸,导致无 法正常泛素化和降解[20]。APC功能的丧失导致Wnt/β-catenin信号的活化被认为是CRC肿瘤发生的主要驱动力之一,很多研究也证明了这一观点[1]。
2.2 黑色素瘤黑色素瘤(melanoma)是由皮肤和其他器官黑素细胞产生的肿瘤,而Wnt信号通路参与各个器官的形成和发展,所以Wnt各个配体的失调可导致黑色素瘤的发生。小眼症相关转录因子(microphthalmia associated transcription factor,MITF)可以调节黑素细胞的分化,在黑色素瘤的发展中起到重要作用[21]。而MITF的表达又与β-catenin有关。β-catenin入核后,与LEF/TCF结合,激活MITF调控元件,表达MITF并且激活多个基因的转录,包括CDK2、C CNB1和CCND1[22]。高水平表达的MITF可促进黑素细胞分化和增殖[23]。对此,Anna等[24]已经描述得很全面。
2.3 前列腺癌前列腺癌(prostate cancer,P Ca)是美国发病人数第一的癌症[25],Wnt信号通路是PCa发生发展的重要通路,由Wnt配体蛋白与Fzd受体相结合,激活下游靶基因。Wnt1在前列腺细胞的增殖、迁移、细胞命运以及干细胞更新中起到一定的作用[26]。Wnt5a是非典型Wnt信号通路的一个重要蛋白,在PCa中通过Wnt/Ca2+/CaMKⅡ通路调节细胞骨架,与Fzd2结合,诱导上皮细胞-间充质转化,与PCa的代谢转化、侵袭和生化 复发密切联系[27]。研究发现,Wnt3、Wnt3a、Wnt5a等在PCa细胞中都高表达[28-30]。Wnt6和Fzd7在PCa中低表达,这可能预示着二者在PCa的发展进程中起到抑癌作用[31]。PCa是一种雄激素依赖性疾病,在依赖雄激 素的PCa细胞中,Wnt信号通路受到雄激素抑制,Wnt5a和LEF1在低级别PCa中发生下调,在转移性PCa中反而上调[32],这表示Wnt信号通路在PCa的发展过程中发挥重要的作用。
前列腺癌的形成有多种多样的原因,Wnt信号通路与其他通路相互影响就是导致PCa形成的因素之一,如PI3K-AKT-mTOR通路与Wnt信号通路之间不仅由GSK-3β和TSC1:TSC2复合物介导进行相互调控,还通过Hippo通路相互作用,促使PCa的发生[33]。
2.4 肝癌肝癌包括肝细胞癌(hepatocellular carcinoma,HCC)和胆管癌(cholangiocarcinoma,CCA)。Wnt信号通路是肝癌发生的关键通路,其中编码β-catenin的C T NNB1基因被认为是原发性肝癌中最常见的突变基因,在肝癌中可普遍观察到CTNNB1错义突变或缺失。在人类和小鼠正常的肝脏中,β-catenin的缺失导致p- mTOR-S2448无法正常表达,而p-mTOR-S2448位于肝脏中心的肝细胞,与肝细胞的正常生长息息相关,致使肝癌形成。在HCC患者的外显子测序中,发现CTNNB1与APOB、ALB、HNF1A或HNF4A协同突变[34]。
沉默调节蛋白1(s irtuin 1,SIRT1)是一种依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的Ⅲ类蛋白去乙酰化酶,在多种癌症中都过表达,有研究发现,β-catenin升高的水平与SIRT1表达的水平密切相关,SIRT1在肝细胞中通过去乙酰化来调节β-catenin的稳定性,同时SIRT1去乙酰化有促进β-catenin核易位的作用,SIRT1和β-catenin共同参与肝细胞的自我更新和肿瘤发生[35]。
此外,也可能 与其他致癌的信号通路协作,如MET、AKT等[36]。
2.5 肺癌肺癌是世界上最常见的恶性肿瘤之一,在临床上分为小细胞肺癌和非小细胞肺癌(nonsmall-cell lung cancer,NSCLC),非小细胞肺癌约占所有肺癌的80%。Wnt信号通路的各个组成部分在肺癌的发生、发展过程中发挥一定的作用。Wnt 1和Wnt2在NSCLC细胞中过表达,抑制它们会诱导细胞凋亡,而中和这两者可以阻碍肿瘤生长[37]。散乱蛋白(dishevelled,Dvl)是位于Fzd受体下游、β-catenin上游的Wnt信号通路正向调节因子。抑制Dvl1、Dvl2、Dvl3能减少β-catenin的表达,阻碍依赖TCF的转录和抑制NSCLC细胞系的生长[38]。而作为Wnt信号通路的关键因子,β-catenin和肿瘤抑制因子APC的突变在肺癌中很少见[39-40]。
近年来,非编码RNA在肺癌中作用的研究日益受到关注。作为一种新发现的非编码RNA,环状RNA(circRNA)如今是癌症领域中的一个研究热点。有研究发现,hsa_circ_001569能够促进结直肠癌细胞的增殖和侵袭,在肺癌中却通过抑制miR-378的表达抑制Wnt信号通路活化,进而抑制肿瘤细胞的增殖,诱导肺癌细胞的凋亡[41]。
2.6 其他癌症目前人们对Wnt信号在白血病中作用的认识越来越多。急性髓系白血病(acute myeloid leukaemia,AML)是成人最常见的急性白血病类型,其特点是染色体频繁易位。很多AML病例中都发现了Wnt 信号通路成分如WNT1、WNT2b和LEF1的异常表达[42]。Wnt/β-catenin通路通过多种机制参与AML发病机制,如染色体易位产物PML/RARα、AML1/ETO和PLZF1/RARα等调控Wnt信号通路相关基因[43],或Wnt拮抗剂甲基化激活Wnt信号通路等[44]。
乳腺癌是一种女性常发恶性肿瘤,经典Wnt 信号通路在三阴性乳腺癌的发生和发展中的作用已被深入研究[6-7]。在乳腺癌中,β-catenin表达水平升高,但检测不到Wnt5a的表达。而Wnt5a在正常乳腺中的缺失可能引起Wnt信号通路的活化,导致乳腺肿瘤的发生[45]。
甲状腺癌是最常见的甲状腺恶性肿瘤,Wnt信号通路中的关键组分β-catenin和Axin在甲状腺癌中突变率很高[46]。此外,过表达Wnt1和抑制GSK-3β会导致甲状腺细胞增殖,Wnt 5a与其受体Ror2的表达与初期甲状腺癌的发展有关[47],其中Wnt5a作为肿瘤抑制因子抑制甲状腺肿瘤的发生[48]。
3 Wnt信号通路与病毒感染
世界上 20%的癌症是由病毒引起的。Wnt信号通路作为调节细胞生长、分化、凋亡、细胞命运、调节胚胎发育、维持组织和机体稳态的重要途径,不仅在癌症的发展进程中起重要作用,在病毒感染机体的情况下也与病情的发生发展有着不可或缺的联系。
人类免疫缺陷病毒(Human immunodeficiency virus,HIV)是一种危害极大的病毒。Kumar等[49]的研究证实,Wnt信号通路中的TCF-4通过与HIV长末端重复(long terminal repeat,LTR)形成多蛋白复合物,与Tat在细胞质与细胞核中形成稳定的复合物,也可能与SP-1相互作用,抑制其反式激活HIV LTR的活性,从而抑制HIV的复制。
肝癌主要分为肝细胞癌和胆管细胞癌,肝细胞癌占多数。乙型肝炎病毒(Hepatitis B virus,HBV)能导致肝硬化,与肝癌的发生密切相关。HBV前核心蛋白p22是TCF/β-catenin转录的激活剂,在体内活化Wnt靶基因启动子报告基因,促进TCF/β-catenin靶基因的表达[50]。而HBV的表面膜蛋白preS1则通过抑制β-catenin的磷酸化,激活Wnt信号通路,促进肝细胞癌化。在HepG2.2.15 HBV相关细胞系中,TLR4能够刺激β-catenin表达,促进肿瘤细胞的增殖和侵袭,这表明TLR4和β-catenin都有可能成为治疗HBV相关HCC的靶点[51]。
丙型肝炎病毒(H epatitis C virus,HCV)是肝细胞癌(hepatocellular carcinoma,HCC)的主要病原之一。HCV核心蛋白参与了与HCV相关疾病的发展,包括慢性肝炎、脂肪肝、和HCC,Wnt信号通路与HCC的发生和进行息息相关。Liu等[52]报道指出,HCV核心蛋白可以提高依赖TCF-4转录的活性,从而诱导β-catenin在细胞浆积累后入核。在核心蛋白感染后,Wnt3、Fzd6、Fzd7、Wnt2、Wnt 3a、Wnt 8b、Wnt 10a、Wnt 10b、Fzd1、Fzd2、Fzd5、Fzd9、LRP5和LPR6都有所上调,而Wnt1、Wnt8a和Fzd8都下 调则表明Wnt1、Wnt8a和Fzd8可能不参与经典Wnt信号通路的活化。这些发现说明了核心蛋白通过调控Wnt/β-catenin通路上游的分 子来激活Wnt信号通 路。同时,SFRP1超甲基化可以诱导Wnt信号通路蛋白的表达,下调DKK1、SFRP3和SFRP5[53]。但HCV NS5A蛋白 调控Wnt信号通路的方式与核心蛋白不同,NS5A通过与PI3K p 85的SH3区域结合活化PI3K,这直接刺激了β-catenin的表达,而NS5A的表达使GSK-3β失活,β-catenin降解复合物失效,导致β-catenin积累,促进依赖β-catenin的转录[54-5 5]。
流感病毒是单链负股RNA病毒,人流感病毒分为甲、乙、丙三型。甲型流感病毒能引起世界范围的大流行,导致重大的经济损失。在流感病毒H1N1 A/PR/8/34感染小鼠的肺上皮细胞实验中,Wnt3a激活Wnt信号通路,增强流感病毒的复制,而Wnt信号通路抑 制剂iCRT14抑制 病毒的复制和病毒基因表达,降低病毒滴度。到目前为止,Wnt信号 通路对流感病毒感染后的作用机制尚不清晰[56]。
疱疹病毒是一类有囊膜的DNA病毒,潜伏于祖细胞中,而Wnt信号通路对祖细胞的维持和分化起到重要作用。在单纯疱疹病毒(Herpes simplex virus 1,HSV1)感染的过程中,HSV1提高β-catenin表达水平约4倍,而iCRT14将HSV1的滴度降低约10倍。VP16作为感染后期表达的病毒调节蛋白,提高了β-catenin的转录水平和表达水平[57]。此外,敲除Axin会减少HSV-1的复制,这表明Axin有促进HSV-1复制的作用[58]。疱疹病毒科的另一种病毒,EB病毒,是人类最常见的致病病毒之一。EB病毒的潜伏膜蛋白1(latent membrane protein 1,LMP1)通过抑制在B淋巴细胞中SIAH1的表达,同时上调β-catenin的表达,导致β-ca tenin在胞浆中积累,上皮细胞的增生[53]。而LMP2A以依赖PI3K的方式激活Akt,Akt的下游靶点GSK-3β磷酸化 失活,导致β-catenin在胞浆中积累,然后发 生核易位,在细胞核中,激活T细胞因子的报告 因子,LMP2A共表达增强了这一过程。有研究发现,在端粒永生化的人类包皮角质细胞中感染EBV,β-catenin会发生聚集[59]。在LMP2A ΔPY突变体中,随着上皮细胞的分化,β-catenin的表达水平和核易位会减少[56]。
4 Wnt信号通路与神经系统疾病
Wnt信号通路在胚胎的神经系统发育中有明确的作用[60],在中枢神经系统中,Wnt刺激成年海马神经发生,促进突触的建立,增加神经元的放电活动,增强神经元的可塑性和神经传递[61-62],故Wnt信号的失调与神经退行性疾病有密切联系,如阿尔兹海默症(Alzheimer’s disease,AD)。AD中认知功能的失常与大 脑葡萄糖代谢的失调有关,Wnt信号通路参与大脑调控葡萄糖代谢的,在AD的发生发展中活性下降[63-64]。有研究证明Wnt信号通路的活化能够刺激葡萄糖代谢,这一过程有助于提高AD模型小鼠的认知能力[64]。众所周知,β-淀粉样蛋白(amyloid-β,Aβ)的沉积和tau 的磷酸化是AD的病理学特征。有研究表明,Wnt信号通路能够减少t au磷酸化以及Aβ的形成,防止细胞凋亡[65]。穿心莲内酯(andrographolide,ANDRO)是Wnt信号通路的激活剂,在AD模型小鼠中能够提高学 习、记忆能力,恢复突触传递,减少tau磷酸化和Aβ的沉积,这也侧面印证了Wnt信号通路在AD中的 保护作用[66]。Wnt信号通路在家族性阿尔兹海默症和散发性阿尔兹海默症也起到一定的保护作用。早老素1(presenilin 1,PS1)的突变抑制了Wnt信号通路,提高GSK-3β的活性和tau的超磷酸化,促进β-catenin降解,抑制共转录因子TCF/β-catenin的转录活性。在转基因AD小鼠模型中,Wnt信号通路的丧失加剧淀粉样蛋白的沉积[66]。
精神分裂症(schizophrenia,SCZ)是最常见的一种 重症精神疾病,β-catenin、Wnt1和GSK-3β都在SCZ患者中发现异常的表达,Wnt信号通路拮抗剂DKK4、sFRP1和Fzd3的分泌都增加了SCZ的发生率。SCZ中Wnt信号通路中受体FZD7和下游基因NFATC3的表达都显著增加,且非经典Wnt信号通路的作用在SCZ中占优势。非经典Wnt信号通路中Wnt5a可能激活NFAT活性,导致与SCZ高度相关的炎症和免疫细胞激活,导致中枢神经系统神经细胞发生凋亡[67]。
5 Wnt信号通路与自身免疫疾病
风湿性关节炎(rheumatoid arthritis,RA)是一种慢性炎症疾病,肿瘤坏死因子α(tumor necrosis factor α,TNFα)和白介素6(interleukin-6,IL-6)在RA炎症发展过程中有十分重 要的作用。这一过程部分是由于DKK-1的诱导,DKK- 1表达水平升高,抑制Wnt信号通路的活化,同时促进滑膜血管生成[68-69]。与健康人群相比,RA患者关节的滑膜中Wnt 和Fzd基因表达更高[70]。不依赖的Wnt信号通路也与RA的 发展有关,在RA患者的滑膜细胞中检测出高水平的Wnt5a[71]。
6 Wnt信号通路与炎症
炎症是机体对于外界刺激的一种防御反应,Wnt信号通路发生异常与神 经炎症、癌症炎症和代谢性炎症等慢性炎症的发展有关。在巨噬细胞中,Wnt3a可以减少促炎细胞因子的产生,抑制炎症的发展。进一步研究发现,Wnt3a通过激活Wnt/β-catenin通路减少TNF-α的释放,从而发挥抗炎作用[72]。小胶质细胞是神经炎症的主要调控因子,Wnt信号通路的活化能够激活小胶质细胞,使其处于促炎状态,调控阿尔兹海默症的发展[73]。
Wnt信号通路还可以通过与其他炎症途径相互作用参与炎症发展,如NF-κB信号通路、MAPK信号通路、AKT信号通路、STAT信号通路。在结肠炎发展过程中,细胞因子可对Wnt信号通路进行调控,如TNF-α可通过AKT通路活化β-catenin,IFN-γ通过DKK1抑制Wnt/β-catenin 通路,IL-1β通过NF-κB通路活化Wnt/β-catenin通路等[74]。CD28能够通过与PI3K结合激活AKT通路,导致GSK-3β的磷酸化和失活,使β-catenin积聚[75]。也有大量的研究表明,Wnt配体可直接调控细胞因子,如Wnt1可以诱导IL-6和IL-8的产生,Wnt2可以抑制细菌产生IL-8,Wnt3a除了可以诱导IL-6和IL-8的产生外,还可以诱导产生TGF-β[74]。
此外,Wnt信号通路参与炎症过程中免疫反应的调节。β-catenin/TCF-1复合物能够通过激活GATA3的转录,促进Th2的分化[76]。选择性缺失Wnt10的屋尘螨(house dust mites,HDM)致敏小鼠更容易发生炎症,且Th2的反应显著增加。进一步的研究表明,HDM致敏小鼠Wnt10的缺失主要增强效应T细胞的反应,而对调节性T细胞影响不大,这表明在炎症过程中Wnt信号通路可能主要作用于Th2。但也有证据表明,Wnt信号通路可以通过减少调节性T细胞介导的抑制直接影响调节性T细胞的功能[77]。
7 动物研究领域中的Wnt信号通路
我国畜禽养殖业发展迅速,畜禽养殖量连续多年保持世界第一,然而由于饲养管理不良、抗生素滥用、免疫程序不当等因素,各种动物疫病始终影响着畜禽的健康生长,严重损害经济效益。探究Wnt信号通路在动物疫病中所起的作用有利于更加深入、全面地了解动物疫病的致病机制,为动物疫病的防控提供新的思路。
7.1 Wnt信号通路与家禽疫病
7.1.1 禽流感 禽流感(avian influenza,AI)又称鸡瘟,是由属于A型流感病毒的禽流感病毒(Avian influenza virus,AIV)引起的急性烈性传染病,可引起呼吸系统疾病和产蛋量下降,主要流行于家禽,对人类健康也有极大威胁。在家禽中,CEF感染AIV H5N1毒株后与未感染组相比,β-catenin的mRNA表达水平在感染初期十分显著,但随着感染时间的增加,β-catenin的mRNA水平逐渐降低,这表明AIV可能在感染初期促进β-catenin转录,而在后期抑制其表达[78]。在哺乳动物中,人核仁磷酸化蛋白1(nucleolar and coiled-body phosphoprotein 1,NOLC1)是禽流感病毒NS1蛋白的受体[79]。陈思瑶等[80]研究发现NS1与NOLC1相互作用能够促进AIV的复制和细胞增殖,增加β-catenin和cyclin D1的mRNA表达水平,这提示了Wnt信号通路可能参与AIV对细胞增殖的调控。
肺损伤是AI的临床表现之一,间充质干细胞(mesenchymal stromal cells,MSCs)表现出治疗肺损伤的潜力,如何调控MSCs的分化方向,防止肺纤维化是治疗肺损伤的关键。近年来,有多个研究团队报道Wnt信号通路有诱导肺纤维化的作用。李燕等[81]通过加入Wnt信号通路抑制剂DKK1抑制该通路活化,成功阻止了MSCs向成纤维细胞分化,证明Wnt信号通路可能成为治疗AIV的靶标,为将来在临床上应用MSCs治疗AIV提供新的理论依据。
7.1.2 新城疫 新城疫,俗称“亚洲鸡瘟”,是由新城疫病毒(Newcastle disease virus,NDV)感染引起的。NDV是一种已经被广泛研究的溶瘤病毒,但NDV与Wnt/β-catenin信号通路的关系尚不明晰。MMP-7是Wnt信号通路的关键靶点,在细胞增殖和肿瘤发生中起重要作用。Morla等[82]报道指出,在NDV感染后,MMP-7和β-catenin蛋白表达量都下调,β-catenin调控的基因如c-Myc、Cyclin D1的表达水平也下降。NDV感染后p-Akt和p-GSK-3β的表达水平随感染时间的增加逐渐下降,细胞质和细胞核中β-catenin的表达量下降,证明了下调p-Akt和p-GSK-3β的表达量可能促进β-catenin降解,降低β-catenin在细胞质和细胞核里的表达水平,从而使Wnt信号通路失调。
此外,β-catenin可能与NDV增殖有关。锂作为GSK-3β的抑制剂,能够在感染早期抑制NDV的复制,这可能是通过抑制GSK-3β活性,增加β-catenin的表达,从而激活Wnt/β-catenin信号通路实现的[83]。
7.1.3 禽白血病 J亚群禽白血病病毒(Avian leukosis virus subgroup J,ALV-J)属于C型反转录病毒,能够引起免疫抑制和各内脏组织恶性肿瘤,影响鸡群生产性能,给世界家禽养殖业带来巨大的经济损失。Feng等[84]研究发现,Wnt/β-catenin信号通路与AL V-J致病过程有关。研究数据表明,ALV-J感染CEF细胞6 h后,蛋白表达显著降低,120 h后 细胞核中的β-catenin蛋白表达量也下降,表明ALV-J感染可能会抑制Wnt信号通路。为了探究ALV-J导致的生长迟缓与Wnt信号通路的关系,Feng等[84]还检测了感染ALV-J的鸡肌肉中β-catenin的含量,发现β-catenin蛋白的表达水平显著下降,同时Axin2、CyclinD1、TCF4和LEF1表达量明显降低,而c-Myc的表达量显著上升,由此表明c-Myc可能受到Wnt信号通路和ALV-J病毒双向调节。
与Feng等[84]的研究不同,程晓薇等[85]用低剂量的ALV-J感染CEF细胞后,发现Wnt信号通路下游基因的表达的确有所下降,而高剂量的ALV-J感染CEF细胞后则能够活化Wnt信号通路。这些有差异的结果还有待进一步的研究来阐明。研究还发现抑制β-catenin蛋白的表达后,ALV-J病毒的复制也受到明显抑制,这表明β-catenin可能有促进ALV-J病毒复制的作用,Wnt信号通路与ALV-J病毒复制有关[23]。
7.1.4 鸡白痢 鸡白痢是由鸡白痢沙门菌引起的细菌性传染病,能够破坏肠上皮细胞,引起严重的腹泻,导致雏鸡较高的发病率和死亡率。肠道黏膜上皮不仅是吸收营养物质的场所,还是保护机体免受病 原微生物入侵的第一道免疫屏障[86]。鸡白痢沙门菌能 附植于肠道黏膜,破坏肠黏膜屏障,使肠道免疫受损,从而侵入机体,引发鸡白痢。
肠道干细胞对维持肠道上皮内稳态十分重要,鸡白痢沙门菌感染后,肠道干细胞的标志基因Lgr5和Bmi1的表达量增加,且Wnt3和Axin2的表达水平显著升高,表明鸡白痢沙门菌可能通过Wnt信号通路活化肠道干细胞巢,调节肠道干细胞的增殖,使肠道上皮的内稳态失衡,促进鸡的肠隐窝增生,引起腹泻[87]。这提示了Wnt/β-catenin信号通路在鸡白痢沙门菌的致病过程中发挥着重要作用,未来有可能通过Wnt/β-catenin信号通路调控肠道干细胞的增殖保护肠道黏膜屏障,从而达到鸡白痢的防控效果。
7.2 Wnt信号通路与家畜疫病
7.2.1 猪繁殖与呼吸障碍综合征 猪繁殖与呼吸障碍综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)能导致生猪生长发育迟缓、呼吸困难和繁殖障碍,即猪繁殖与呼吸综合征,也称“猪蓝耳病”,给全世界生猪产业造成严重的危害。Wang等[88]报道指出,PRRSV感染能够诱导Wnt/β-catenin信号通路活化,下游基因cyclinD1和c-Myc等基因转录水平以及细胞核内β-catenin的表达水平都有所升高,但的总量没有明显变化。通过验证PRR SV感染是否增加β-catenin异位表达,证明了PRRSV有促进β-catenin向细胞核内转移的作用。Wnt3a能抑制PRRSV的复制,且呈剂量依赖性。此外,PRRSV诱导产生的β-catenin可与NF-κB结合,激活先天免疫途径以抑制PRRSV的复制。
Hao等[89]研究发现,LiCl作为Wnt信号通路的激活剂能够抑制PRRSV复制。在LiCl处理的感染PRRSV的细胞中,β-catenin和下游基因c-Myc的表达水平高于未处理过组,同时LiCl能够诱导β-catenin的核易位以及TCF/LEF的转录,这提示Wnt/β-catenin信号通路在LiCl对PRRSV的抗病毒作用中扮演着十分关键的角色。
7.2.2 猪断奶后多系统衰竭综合征 猪断奶后多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)主要由猪圆环病毒2型(Porcine circovirus type 2,PCV2)感染引起,但单独感染PCV2很难引起典型的PMWS临床症状[90]。类猪圆环病毒P1首次发现于2007年从临床上患有PMWS的病猪上分离得到,与PMWS的主要致病病原PCV2高度同源,能引起类似PMWS的症状,且有广泛的宿主谱[91]。
在体内实验中,P1能够降低Wnt信号通路下游组分的表达水平。P1感染小猪后,Wnt信号通路相关分子MMP-2、MMP-7、MMP-9以及下游基因c-Myc和cyclin D1的mRNA水平在肾脏和肝脏中都明显降低,DKK-1的mRNA水平在肺脏和脾脏中显著升高,但在淋巴结和肝脏中显著降低,这提示DKK-1在Wnt信号通路中可能有不同的作用;在体外实验中,感染P1的ST细胞MMP2的转录水平和β-catenin的表达量明显降低,同时P1的结构蛋白VP1阻止β-catenin进入细胞核,抑制TCF/LEF的活性。体内和体外实验结果证明,P1具有抑制Wnt信号通路活化的作用且P1的感染可能与Wnt信号通路的下调有关[92]。
7.2.3 牛痘 牛痘是由牛痘病毒引起的一种急性传染病,牛痘病毒对消灭天花疾病有至关重要的作用。与新城疫病毒相似,牛痘病毒也作为溶瘤病毒用以开发治疗癌症。牛痘病毒编码多种抑制NF-κB信号通路的蛋白,如A49。为了探明A49能否影响Wnt信号通路,Maluquer等[93]将不表达A49的突变株(vDA49)和表达A49的回复突变株(vA49rev)感染THP-1细胞后发现,A49的表达会引起β-catenin的积累。进一步的实验证明,A49通过增加β-catenin的表达水平活化Wnt信号通路。
E3泛素连接酶β-TrCP是A49的靶点,能够泛素化β-catenin转录活化因子。为了确定A49对Wnt信号通路的作用靶点是β-TrCP,Maluquer等[93]使用了N端延伸能够与β-TrCP结合的A49突变株,并发现该突变株与β-TrCP结合后影响β-catenin的降解,导致β-catenin的积累,从而激活Wnt信号通路,证实A49与β-TrCP的结合是活化Wnt信号通路的方式,A49可能是牛痘病毒调控Wnt信号通路的一个关键蛋白。
7.2.4 牛副流行性感冒 牛副流行性感冒是一种牛急性呼吸道传 染病,由牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV3)引起。在BPIV3致病过程中,Wnt信号 通路关键分子β-catenin发生显著变化。BPIV3感染MDBK细胞后,β-catenin的mRNA表达水平随感染时间升高,但蛋白表达水平随感染时间下降,这表明BPIV3可干扰β-catenin的翻译[94]。
BPIV3和β-catenin的影响是相互的,Du等[94]通过过表达β-catenin,发现BPIV3的病毒滴度有所降低,BPIV3的复制受到抑制。进一步的研究指出,GSK-3β的抑制剂LiCl能够诱导β-catenin的表达,促进β-catenin在细胞核聚集,进一步提高IFN-β和下游抗病毒基因OSA1的表达水平,从而抑制BPIV3在感染细胞内的复制,提示了β-catenin可能成为抑制BPIV3的重要分子。
7.2.5 牛传染性鼻气管炎 牛传染性鼻气管炎是由牛疱疹病毒1型(Bovine herpesvirus 1,BoHV-1)引起的高度接触性传染病。BoHV-1可感染三叉神经元并能终身潜伏,受到刺激因素则会激活,导致感染牛发病。BoHV-1在潜伏期表达潜伏期相关RNA(latency-related,LR-RNA),LR-RNA编码ORF2蛋白,该蛋白具有抑制细胞凋亡的作用。在BoHV-1潜伏期中,在三叉神经元能够检测到β-catenin和MAML1(mastermind-like protein 1,β-catenin的一种共活化剂)的稳定表达,但用地塞米松处理使BoHV-1活化后,无法检测到β-catenin和MAML1的表达。进一步研究发现,ORF2能够稳定MAML1的表达水平进而增加β-catenin的表达[95]。与Wnt信号通路相关的两种激酶Akt3和BMPR2也有相似的现象,在潜伏期中ORF2还能够与Akt3相互作用并增强其活性[96]。
此外,BoHV-1活化后可诱导编码Wnt信号通路拮抗剂和依赖β-catenin转录因子抑制剂的表达。Akt3和BMPR2能够促进神经发生和细胞存活,而这两个功能对维持BoHV-1在三叉神经元的潜伏十分重要,故可以推测ORF2、β-catenin、MAML1、Akt3和BMPR2都参与对BoHV-1潜伏期的调控,且Wnt信号通路在此过程中发挥重要作用[96]。Zhao等[97]的报道进一步证明了ORF2和Wnt/β-catenin信号通路参与调控BoHV-1潜伏期的维持。可见,Wnt信号通路与BoHV-1潜伏和激活状态的调控有着不可或缺的联系。
8 针对疾病中Wnt信号通路的治疗
Wnt信号通路在疾病发展进程中的调控是十分复杂的,Wnt配体、FZD受体、TCF/LEF以及mRNA在生命活动过程中都有可能发生异常的调控,此外,Wnt信号通路还会与其他信号通路相互作用,形成繁杂的交叉网络[98-99],因此,以Wnt信号通路作为治疗疾病的靶点可能会引起一 定的副作用,但鉴于Wnt信号通路治疗疾病存在的巨大潜力,人们尝试了很多抑制剂靶向抑制Wnt信号通路。
目前通过靶向Wn t信号通路治疗癌症趋向于增加药物的特异性,以及与其他癌症药物的联合治疗,可以减少副作用并提高疗效。Kim等[100]较为详细的综述了数十种靶向药物和具有潜在靶向Wnt信号通路的药物,包括它 们的作用机制和相关的临床试验。
多种小分子抑制剂也能够通过影响Wnt信号通路起到治疗作用。PRI- 724能够抑制cAMP反应元 件结合蛋白(cAMP-response element-binding protein,CREB)结合β-catenin,从而阻断依赖Wnt/β-catenin促生长和促生存基因的表达。PRI-724在体外实验中能够选择性抑制多种癌细胞株的增殖作用,并在动物实验中显著抑制肿瘤生长,可用于治疗前列腺癌、结直肠癌和急性、慢性髓性白血病[101]。在人类间叶干细胞中,SM04755降低了Wnt信号通路的活性,抑制降解酶和促 炎症因子的表达。CDC样激酶2(CDC-like kinase 2,CLK2)和双特异性酪氨酸磷酸化调节激酶1A(dual-specificity tyrosine phosphorylation-regulated kinase 1A,DYRK1A)是Wnt信号通路新的靶点[102-103],SM04755通过抑制CLK2和DYRK1A的活性,从而抑制Wnt信号通路,减少炎症发生[104]。
总之,对于Wnt信号通路抑制剂在疾病中的作用机制和疗效尚在探索之中,随着我们对Wnt信号通路在各种疾病中所起作用的理解的加深,针对Wnt信号通路的药物在相关疾病治疗的效果和可能有的副作用都会更加清晰。
9 展望
随着科学技术的发展,我们能够用来了解机体中各种分子相互作用机制的方法越来越多,对Wnt信号通路在生命活动过程中的调节机制的理解也越来越深刻。虽然目前与Wnt信号通路相关的多数问题已经有了答案,但还有很多谜团尚待解开。以下问题只是Wnt信号通路未解之谜的一部分,希望能对未来的研究有所启发。
1、Wnt信号的进化起源是什么?Wnt信号通路存在于所有后生动物,在后生动物之前是否存在Wnt信号通路相关的基因?
2、Wnt信号发生在细胞的什么地方?Wnt信号发生的亚细胞定位仍然未知。
3、稳定形式的β-catenin是如何进入细胞核的?是主动转运吗?
4、在不同类型的细胞中,有多少基因组受Wnt控制?
5、很多针对 Wnt信号通路的靶向药物正在开发,该如何正确并有效地利用该通路对各类疾病进行治疗和干预?
