免疫检查点抑制剂在食管癌新辅助治疗中的应用进展*
2021-08-31杨媛媛孟祥瑞路遥许孟丽王峰
杨媛媛 孟祥瑞 路遥 许孟丽 王峰
食管癌主要包含食管鳞癌及食管腺癌,其侵袭性高,预后较差[1]。2020年全球癌症统计报告显示,全球食管癌新增确诊人数约为60.4 万,新增死亡人数约为54.4 万,而中国在全球新增确诊和新增死亡人数中占比超过50%[2]。食管癌治疗方式的选择主要取决于病理类型、疾病分期等,包括手术、放疗、化疗、靶向治疗以及免疫治疗等在内的单一或联合治疗[3]。手术切除主要应用于局部食管癌患者,同时可在术前及术后联合放疗、药物治疗等[4]。其中,术前新辅助治疗可以缩小肿瘤,使病理分期降级[5]。近年来,随着免疫治疗的不断前移,很多学者都在探索术前免疫治疗联合化疗或者放化疗是否可以带来更好的疗效。本文对免疫检查点抑制剂在食管癌新辅助治疗中的临床研究综述如下。
1 免疫检查点抑制剂
活化的T 细胞表面具有免疫检查点,它们有调节免疫激活度、防止自身免疫反应发生的作用[6]。肿瘤细胞借助这种特性来逃避T 细胞攻击,其通过表达PD-L1 等可被免疫细胞所识别的配体来激活免疫检查点[7],使抗原不能被提呈至T 细胞,从而关闭T 细胞反应[8]。迄今为止,已发现许多免疫检查点,包括PD-1、CTLA-4、LAG3、TIM3、TIGIT 和BTLA 等[9]。由于免疫检查点主要由配体-受体相互作用驱动,因而易被抗体阻断或被重组形式的配体或受体调节[10]。临床常见的免疫检查点抑制剂主要是PD-1/PD-L1 抑制剂和CTLA-4 抑制剂,见表1。目前食管癌新辅助免疫治疗主要应用PD-1/PD-L1 抑制剂。PD-1/PD-L1 抑制剂在食管癌患者的治疗中显示出良好的疗效,逐渐从后线推进到二线、一线乃至围手术期,治疗方案也由单药转为联合治疗。2021年CSCO 指南已经将帕博利珠单抗/纳武利尤单抗/卡瑞利珠单抗联合化疗列为晚期食管癌一线治疗的Ⅱ级推荐。
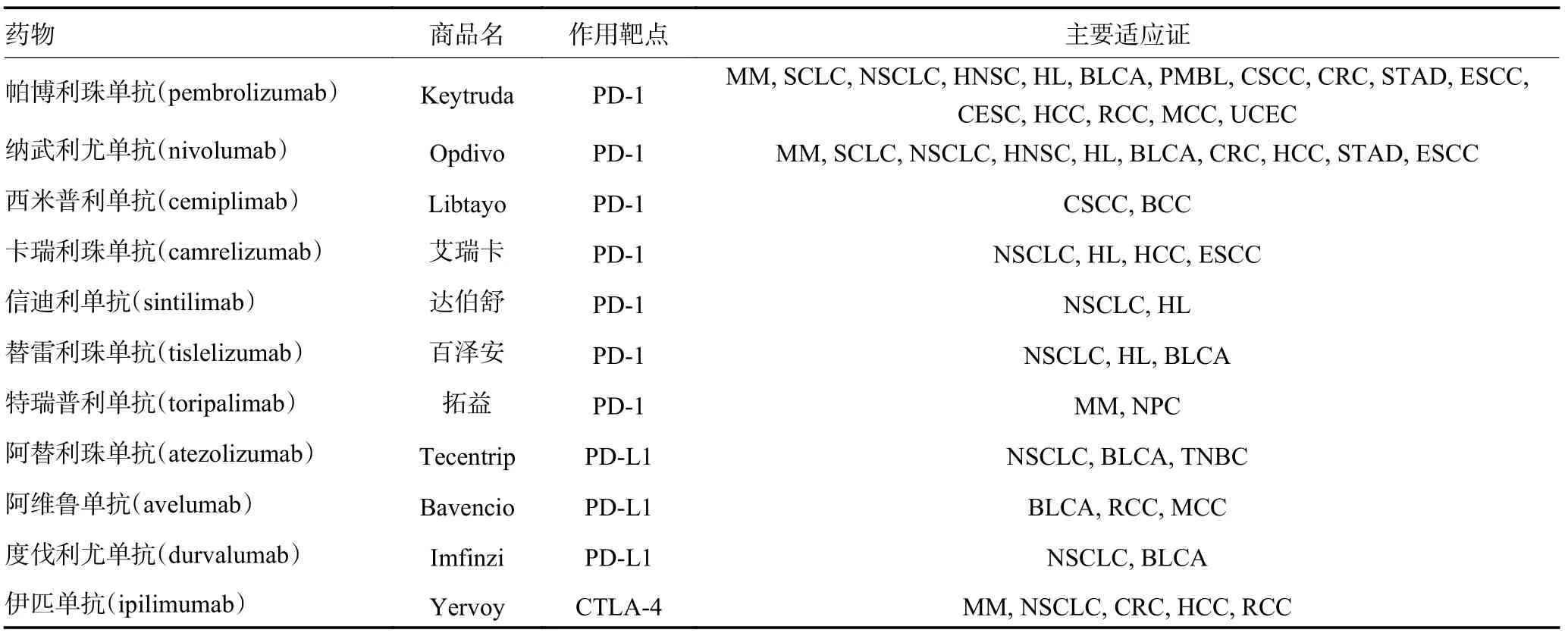
表1 常用的PD-1/PD-L1 抑制剂和CTLA-4 抑制剂
手术前肿瘤本身未被清除,体内肿瘤抗原载量较高,术前使用免疫治疗激活免疫系统,利用高水平的内源性肿瘤抗原增强肿瘤特异性T 细胞的活性,使其扩散到全身,缩小肿瘤并清除微转移病灶,降低术后复发几率[11]。
临床前研究已经证实了这一推论,Liu 等[12]在乳腺癌小鼠原发性肿瘤切除前(新辅助)或术后(辅助),给予抗PD-1 抗体或抗PD-L1 抗体联合抗CD137 抗体进行治疗。新辅助免疫治疗的小鼠相比辅助免疫治疗的小鼠生存率显著提高,且生存率的提高与其外周血和器官中出现更多的肿瘤特异性CD8+T 细胞有关。以PD-1/PD-L1 抑制剂新辅助治疗为例,抗肿瘤T 细胞免疫反应的增强机制可能有二:一是肿瘤微环境中已经存在的肿瘤特异性T 细胞可被PD-1/PD-L1 抑制剂增加;二是具有肿瘤特异性抗原的树突状细胞转移到引流淋巴结,并将特异性抗原提呈至CD8+T 细胞。活化的T 细胞流经淋巴管、血液系统,最终进入组织发挥作用[13-14]。
2 新辅助免疫治疗联合放化疗
2.1 帕博利珠单抗联合放化疗
2019年ESMO 会议报道了一项新辅助帕博利珠单抗(pembrolizumab)联合同步放化疗+手术+免疫维持治疗局部晚期食管鳞癌的Ⅱ期临床试验,主要终点是原发肿瘤的病理完全缓解率(pCR)[15]。研究共入组28例Ⅰb~Ⅲ期食管鳞癌患者,术前接受约5 周新辅助治疗:化疗(紫杉醇+卡铂,qw),放疗(44.1Gy,21 次),帕博利珠单抗(200mg,q3w)。其中26例接受了手术,术后予以帕博利珠单抗(200mg,q2w)维持治疗2年。研究结果显示,pCR 率为46.1%,总生存期(OS)为6、12、18、24 个月的比例分别为89.3%、82.1%、73.1%、65.2%。与非pCR 组(n=14)相比,pCR 组(n=12)无病生存期(DFS)趋势更好,即pCR 与更好的生存相关。最常见的治疗相关不良事件(TRAEs)为中性粒细胞减少(50.0%)和肝酶升高(30.8%),术后有2例患者因严重肺损伤而死亡。
此外,2020年上海交通大学李鹤成教授团队牵头开展新辅助帕博利珠单抗联合同步放化疗(紫杉醇及卡铂)治疗局部进展期食管鳞癌的Ib 期临床研究(PALACE-1),并发表了其结果[16]。PALACE-1 研究主要研究终点是安全性,共筛选入组20例患者,术前接受5 周新辅助治疗,其中18例完成了根治性手术,pCR 率为55.6%。20例患者均出现不同程度的治疗相关的不良事件(treatment-related adverse events,TRAEs),65%出现3 级或以上不良反应。常见TRAEs包括淋巴细胞减少(100%)、白细胞减少(100%)、贫血(80%)、食管炎(55%)、脱发(55%)和乏力(55%),其疗效有待样本量更大的临床试验来验证。多中心、单臂的PALACE-2 研究已于2020年5月开始,计划入组143例患者,主要终点是pCR 率,旨在进一步确定该方案的有效性。
2.2 纳武利尤单抗联合放化疗
小样本临床试验已经证实新辅助纳武利尤单抗(nivolumab)联合放化疗在Ⅱ期或Ⅲ期食管癌/食管胃结合部癌患者中的安全性与可行性[17]。该试验入组患者16例,先给予纳武利尤单抗诱导2 个周期,再予以标准的放疗联合卡铂及紫杉醇治疗,在同步放化疗的第1、3、5 周予以3 个周期的纳武利尤单抗。其中,10例腺癌患者行根治手术且pCR 率为40%。该方案不良反应可接受,包括3 级类固醇皮炎和3 级肝炎各1例。研究结果肯定了该方案的可行性和有效性,但还需在更大样本量的临床试验中证实。
2.3 阿替利珠单抗联合放化疗
CROSS 研究证实了新辅助放化疗后手术相较于仅行手术在食管癌治疗中的优越性,然而可切除食管腺癌患者的五年生存率仅为43%[18]。为改善这一结果,研究人员设计了PERFECT 研究,该研究是一项单臂Ⅱ期临床研究,即在CROSS 方案术前标准放化疗的基础上加用阿替利珠单抗(atezolizumab)治疗局部晚期食管腺癌患者[19]。研究入组39例患者,其中24例患者全部完成治疗方案,7例未全部完成新辅助治疗,原因包括不良反应及病情进展。迄今为止,31例患者中有15例出现3~4 级不良反应,23例已行手术切除的患者pCR 率达到39%,相比CROSS 研究中的23%有显著提升,目前该试验还在进行中,未来会有更完善的结果显现。
2.4 阿维鲁单抗联合放化疗
2019年ASCO 大会上报道了新辅助阿维鲁单抗(avelumab)联合卡铂及紫杉醇在可切除的食管癌/食管胃交界处癌中的研究结果,该试验分两部分,第一部分有6例患者进行安全性评估,第二部分将另外入组18例[20]。目前试验第一部分已完成,入组6例腺癌患者术前先行标准放化疗治疗,从第29 天开始行3 个周期阿维鲁单抗治疗(q2w),术后行6 个周期免疫维持治疗。研究入组的6例患者中,有2例YPT0N0、2例YPT1N0、1例YPT2N0和1例YPT3N1。TRAEs包括:2 级免疫相关甲状腺功能减退(1/6),3 级中性粒细胞减少(1/6),3 级或4 级可逆性淋巴细胞减少(6/6)。该方案不良反应可接受,安全性及耐受性良好,然而该试验的样本量较小,需要后续进一步验证。
3 新辅助免疫治疗联合化疗
3.1 卡瑞利珠单抗联合化疗
2020年ESMO 会议报道了NICE 研究结果,该研究评估了新辅助卡瑞利珠单抗(camrelizumab)联合白蛋白结合型紫杉醇及卡铂在局部晚期胸段食管鳞癌患者中的疗效[21]。2021年ASCO 会议上NICE 研究更新了数据,纳入的60例患者中55例(91.7%)完整接受了2 个周期的新辅助治疗,4例患者因不耐受(3例)和退出(1例)未接受完整的新辅助治疗,1例在第2 个周期的新辅助治疗期间因肺炎死亡。47例手术患者中,其中7例因TRAEs 延迟手术,20例(42.5%)达到pCR。3~5 级TRAEs 发生率为53.3%,包括淋巴细胞减少(50%)、血小板减少(10%)、肺炎(5%)和甲状腺功能障碍(3.3%)等。该研究初步结果良好,将继续进行Ⅱ期及Ⅲ期研究以证实生存改善。
2021年ASCO GI 会议上报道了一项卡瑞利珠单抗联合化疗新辅助治疗局部晚期食管鳞癌的单臂、Ⅱ期临床研究[22]。在新辅助治疗方案中,该研究采取了1 个周期的卡瑞利珠单抗单药诱导,后续行2 个周期的卡瑞利珠单抗联合多西他赛和奈达铂治疗,然后4~6 周内进行手术。截至2020年12月5日,共入组患者33例,22例接受了手术,R0 切除率达100%,其中15例患者达到了主要病理缓解(mPR),mPR 率高达68.2%,7例(31.8%)达到了pCR,18例(81.8%)实现TNM 分期降低。无3 级及以上TRAEs,常见的TRAEs 有白细胞减少、中性粒细胞减少、贫血、低白蛋白血症、便血、疲劳和甲状腺功能障碍。该研究提示新辅助卡瑞利珠单抗联合化疗后手术治疗局部晚期食管鳞癌患者具有良好的降期效果和mPR,且耐受性良好,其疗效和安全性可在后续试验中进一步探究。
3.2 信迪利单抗联合化疗
KEEP-G 03 研究旨在评估信迪利单抗(sintilimab)联合三药化疗(脂质体紫杉醇+顺铂+替吉奥)新辅助治疗可切除食管鳞癌的可行性和安全性[23]。15例患者已完成手术,术前行2 个周期新辅助治疗,pCR 率达26.7%,mPR 率达53.3%。6例(35.3%)患者出现3 级或4 级TRAEs,例如贫血、白细胞减少及中性粒细胞减少,未发生5 级不良事件。
3.3 特瑞普利单抗联合化疗
2020年ESMO 会议报道了一项特瑞普利单抗(toripalimab)联合化疗(白蛋白结合型紫杉醇和替吉奥)新辅助治疗食管鳞癌的单臂临床试验[24]。该研究在术前给予特瑞普利单抗联合化疗2 个周期,术后相同方案给予2 个周期,再予以特瑞普利单抗维持治疗6 个月。截止到该研究的中期分析时间,共入组24例患者,18例已行手术切除,mPR 率为50%,pCR 率约为16.7%,术后83%的患者出现了降期。该试验3 级及以上TRAEs 的发生率较低,暂未出现免疫相关性肺炎或肝肾损伤等重度不良反应。免疫检查点抑制剂在食管癌新辅助治疗中的相关研究见表2。

表2 免疫检查点抑制剂在食管癌新辅助治疗中的相关研究
4 新辅助免疫治疗分子标志物
随着新辅助免疫治疗的开展,如何筛选获益人群逐渐成为研究热点。目前临床使用的免疫治疗预测指标包括PD-L1、肿瘤突变负荷(TMB)、错配修复蛋白缺失突变(dMMR) 或微卫星高度不稳定(MSI-H)。其他预测指标还有特异基因如EGFR 等的变异、EB病毒、血浆循环肿瘤细胞DNA(ctDNA)、CD8+T 细胞及免疫因子如γ-干扰素等[25-26]。在食管癌中,有研究发现11q13 的扩增是PD-1 抑制剂疗效的负性预测因子,而PD-L1、TMB 与PD-1 抑制剂疗效无关[27]。最近,Park 等[25]文章提到,对于胃、食管癌而言,除dMMR/MSI-H 之外,其他生物标志物均不高度敏感或特异,因此还需寻找更稳定的食管癌免疫治疗标志物。在晚期肿瘤中已经证实的预测因子能否应用于围手术期的治疗仍需验证。目前食管癌新辅助免疫治疗临床试验中,尚无确切的分子标志物用于筛选可能获益的人群,研究主要集中在PD-L1、TMB、EGFR、CD8+T 细胞等。这些研究在寻找分子标志物的同时,亦可为设计Ⅲ期临床试验提供思路。
5 总结与展望
免疫检查点抑制剂的出现为食管癌新辅助治疗注入了新的活力,也带来了一些困惑。上述研究中,新辅助免疫治疗展现出了良好的pCR 率、安全性、可行性以及无手术延迟等获益潜力,证明新辅助免疫疗法极具前景。但与CROSS 研究[18]和NEOCRTEC5010研究[28]中新辅助放化疗的pCR 率(分别为49%和43.5%)对比可以发现,新辅助免疫治疗联合放化疗或化疗的疗效报道不一,部分研究并未显示出超越同步放化疗的结果。安全性方面,目前大多数研究结果显示新辅助免疫治疗安全性良好,常见的TRAEs 有白细胞减少、中性粒细胞减少、肝功能异常等,且较高级别的不良反应发生率较低。大多数患者可通过治疗缓解TRAEs,但随着入组病例数量增多,已出现延迟手术的情况。考虑到现有临床数据大多数仅为中期结果或来自于小样本临床试验,其结果还需在更大样本量的多中心临床试验中进一步验证。
此外,国外食管癌患者多为腺癌,研究多为新辅助免疫治疗联合放化疗;而国内患者多为鳞癌,研究多为新辅助免疫治疗联合化疗。从既往临床数据来看,新辅助放化疗可使鳞癌和腺癌患者获益,而新辅助化疗对腺癌患者效果更好。但我国研究机构多开展新辅助免疫治疗联合化疗后行手术的相关研究,可能因为新辅助放化疗术后出现并发症的概率及死亡率高于新辅助化疗[29-30]。另外,食管鳞癌患者对紫杉醇+铂的方案反应率很高,仅做术前化疗效果也较好。相信未来将会出现更多关于新辅助免疫治疗联合放化疗或化疗的随机对照研究,以确定更好的治疗模式。
目前免疫治疗还有许多问题亟待探索。第一,新辅助免疫治疗联合方案的时机与疗程如何选择[31]。不同药物、剂量、用法都可能导致不同的结果。2~3 个周期的新辅助免疫治疗联合化疗或者放化疗是否足够,率先使用免疫检查点抑制剂诱导能否增加获益,免疫治疗如何与其他治疗联合以及术前免疫治疗的患者术后是否需要继续应用免疫治疗维持等。第二,假性进展与超进展均可能导致患者手术时机延迟[32]。为及时明确免疫治疗是否真正有效,继续下一步治疗,寻找有效的影像学诊断方法、组织学检查方法鉴别假性进展与超进展至关重要[33]。第三,评价治疗疗效的方法需要更加全面完整、标准化。病理学评估中对肿瘤大小的测定、对肿瘤边界的界定等都需要进一步规范[34]。除了影像学的评估,也可纳入更丰富的检查方法,如T 淋巴细胞亚群检测、TMB 等[35]。第四,探索稳定可靠的生物标志物以筛选新辅助免疫疗法获益人群[36]。未来免疫治疗的生物标志物应进一步完善,以全面评估患者的肿瘤免疫微环境。此外,免疫治疗的生物标志物能否预测联合用药的疗效仍待考究。这些问题为我们提供了丰富的亚组临床研究设计思路,目前更大型的临床试验也将对这些问题进行更深入的研究,以期为精准、规范应用新辅助免疫治疗提供依据,提高患者生存质量,改善疾病预后。
