原发性食管小细胞癌分子机制及治疗进展*
2021-08-31杜庆武庞青松王平
杜庆武 庞青松 王平
原发性食管小细胞癌(primary small cell carcinoma of the esophagus,PSCCE)是食管癌中最为独特的类型之一。1952年英国病理学家McKeown 首次描述了这种高级别食管燕麦细胞神经内分泌肿瘤,迄今,已经有近4 000例有关PSCCE 的文献报道[1]。PSCCE 在同期食管癌中的比例为0.5%~2.4%,在我国这一比例约为1.26%,且呈逐年上升趋势,男女比例约为2.40∶1,以胸中段为主[2-3]。PSCCE 在组织学特征和生物学行为上与小细胞肺癌(small cell lung cancer,SCLC)有诸多相似之处,因此在治疗上PSCCE 多参考SCLC 的治疗模式,但疗效始终差强人意。国内一项研究[4]在肿瘤突变频谱和体细胞拷贝数变异水平上对比分析发现,与SCLC 相比,PSCCE 更接近食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和头颈部鳞状细胞癌,提示食管来源和肺来源的小细胞癌具有不同的生物学背景,不同部位的小细胞癌的异质性导致两者不能被作为同一类型诊治。PSCCE 发病机制、治疗模式存有争议,国内外研究大量涌现。基于此,本文对近年来PSCCE 的进展进行综述,为更好地理解PSCCE 的发病机制以及在临床工作中采取更佳的治疗策略提供见解。
1 肿瘤发生发展的分子机制
PSCCE 的发生是一个多因素、多基因、多阶段的过程,具体机制有待进一步探索(图1)。
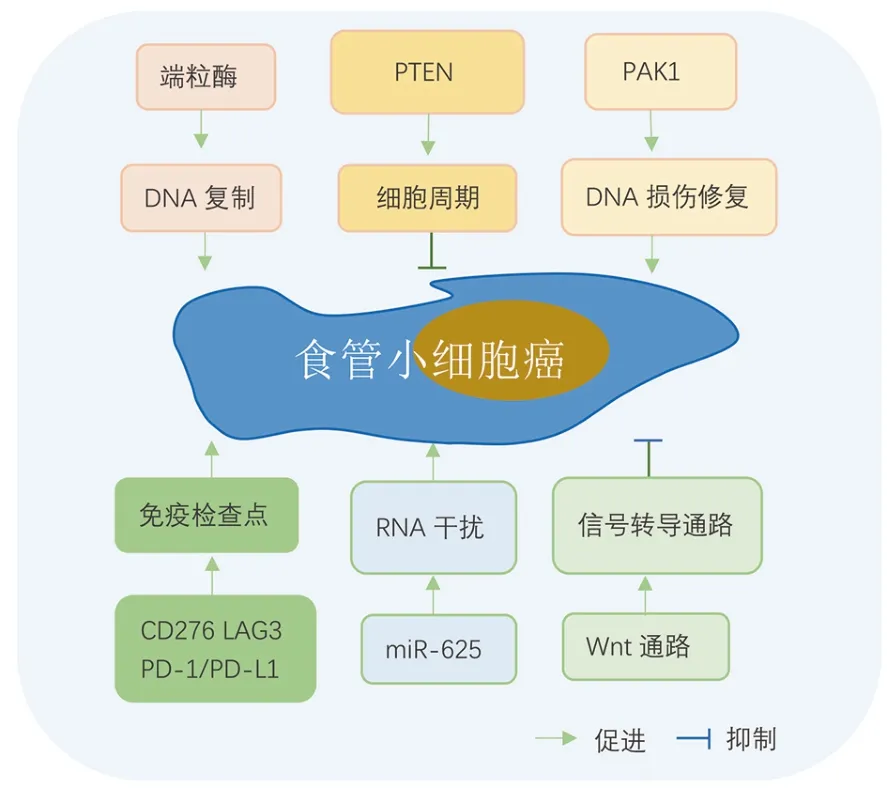
图1 PSCCE 发生发展的分子机制
1.1 DNA 复制与RNA 干扰
2001年Chow 等[5]发现端粒酶活性升高导致了PSCCE 的高增殖能力。Okumura 等[6]发现PSCCE治疗后进展与微小RNA-625(microRNA-625,miR-625)显著相关,且体外实验进一步证实miR-625 的敲低导致肿瘤细胞的侵袭能力显著降低。
1.2 细胞周期与起源
PTEN 是人体常见的抑癌基因之一,通过抑制PI3K-AKT 信号途径促使细胞停滞在G1期或直接诱导肿瘤细胞凋亡。Zhang 等[7]检测了EGFR、KRAS、PIK3CA 和PTEN 等基因的突变情况,发现PTEN 基因突变是中国PSCCE 人群中相对常见的分子事件(36.84%,14/38),显著高于ESCC(3.03%),而且PTEN的功能状态对肿瘤免疫微环境也会产生影响。在小鼠结肠癌模型中,PTEN 缺失导致PD-L1 表达上调,免疫抑制性细胞因子释放增加,导致T 细胞浸润减少,免疫治疗疗效减弱[8]。而在PSCCE 中,PTEN 的功能值得进一步挖掘,但目前尚无针对PTEN 的靶向药物上市,治疗方向主要针对其下游PI3K/AKT信号通路,但PTEN 仍可能成为未来PSCCE 治疗的重要靶点之一。EGFR 在PSCCE 中的突变概率很低(2.63%,1/38),对于EGFR-L858R 突变的患者,吉非替尼等靶向治疗药物值得优先考虑。SOX2 是一种维持肿瘤干细胞多能性的转录因子,有研究表明[9],在PSCCE 和SCLC 以及胚胎食管组织中都存在SOX2 基因的过表达和抑癌基因Rb1 的降低,而在低分化鳞癌中则刚好相反,提示PSCCE 可能来源于胚胎干细胞,且Rb1 基因的突变是PSCCE 发生的早期分子改变之一,SOX2在多潜能干细胞神经内分泌分化过程中起着关键作用。
1.3 DNA 损伤修复
DNA 损伤修复途径是机体抑制肿瘤形成的早期防御机制之一,但该途径的过度激活同时降低了肿瘤的放化疗敏感性。有研究发现[10],PSCCE 中p21 活化激酶1(p21-activated kinase 1, PAK1)过表达(22/34,64.7%),且与DNA 损伤标志物γH2AX 正相关(P=0.027),提示PAK1 可能参与了PSCCE 的DNA损伤/修复过程,促进肿瘤细胞的侵袭及转移。且PAK1 的过度激活与肿瘤位置(胸中段为主,P=0.011)、淋巴结转移(P=0.026)、总生存期(overall survival,OS)(P=0.032)密切相关,在23例淋巴结转移阳性的患者中,18例(78.3%)呈现出PAK1 过表达的状态,且PAK1 过度激活患者的OS 也会显著降低。作为一种促进肿瘤发生、治疗抵抗的蛋白激酶,PAK1 除了用于协助诊断、预测预后和疗效监测,更重要的是可以作为未来PSCCE 治疗的直接靶点。
1.4 基因图谱与细胞信号转导通路
国内一项研究[4]首次构建了完整的PSCCE 基因组图谱,揭示其基因组水平的改变。PSCCE 的突变谱以胞嘧啶和胸腺嘧啶的置换或鸟嘌呤与腺嘌呤的置换为主,该研究发现8 个高频突变基因,总结了3 个肿瘤突变特征,其中TP53、RB1 以及NOTCH 家族的突变在PSCCE 以及SCLC 中均广泛存在,但PDE3A、CBLN3、PTPRM 3 个突变基因未曾在食管癌中有过报道,提示这3 个基因的突变可能是PSCCE 发生发展过程中相对特异性的分子改变,但目前尚无进一步的研究报道。PSCCE 表现出较高的拷贝数变异负荷,单个基因组的中位数达27.9%,显著扩增的区域包括1p34.2、3q26.32、8q24.21,包含常见的基因如MYCL1、PIK3CA、MYC 等。96.4% 的患者存在Wnt 途径成分的体细胞改变,研究证实了该通路的显著激活是SCCE 的重要分子事件,且与不良的预后相关,具有NOTCH 信号通路突变患者的中位OS 显著低于未突变的患者(14.5 个月vs.23 个月),提示NOTCH 家族的突变是PSCCE 预后不良的生物标记物之一。
1.5 肿瘤免疫微环境
PSCCE 的肿瘤微环境呈现相对抑制的状态,且LAG-3、TIGIT 等免疫检查点上调,M2 型巨噬细胞浸润增多,这对肿瘤细胞逃逸免疫监视、促进PSCCE 的发生发展起到重要作用。有研究[11]在转录组学水平上探索PSCCE 的免疫微环境,发现大多数PSCCE 肿瘤微环境中白细胞浸润相对较少,且相对于食管鳞状细胞癌、食管腺癌、胃癌、头颈部鳞状细胞癌,PSCCE肿瘤中浸润的白细胞含有更多的M2 巨噬细胞和自然杀伤细胞。相对于食管腺癌、胃癌,PSCCE 肿瘤中浸润的调节性T 细胞(regulatory T cell,Treg 细胞)相对较少,另外,97%(29/30)的患者表现出高水平的CD8+T 细胞浸润。PSCCE 的免疫微环境与SCLC 更为相似,M2 型巨噬细胞通过抑制肿瘤微环境中的T细胞,导致PSCCE 中白细胞浸润水平降低,而靶向M2 型巨噬细胞可能是逆转肿瘤中白细胞浸润水平低的有效方法。纤维蛋白原样蛋白1(fibrinogen-like protein 1,FGL1),是免疫检查点LAG3 的配体之一,在白细胞中度浸润的肿瘤组织中显著上调,FGL1-LAG3 可能是PSCCE 免疫抑制的内在机制之一。除此之外,44.1%(26/59)的PSCCE 患者PD-L1 表达阳性,CD276、TIM-3、VEGFB 等也有不同程度的激活。
近期,一项研究[12]发现,免疫检查点受体TIGIT及其配体CD155 在PSCCE 中广泛上调(58.8%和56.1%),且与远处转移、Ki-67 指数、预后显著相关。CD155 和TIGIT 高表达的患者OS 明显较短(CD155:15.0 个月vs.24.0 个月,TIGIT:15 个月vs.26 个月),且CD155 和TIGIT 双阳性的患者预后最差(中位OS:14.0 个月),双阴性者预后最好(中位OS:27.0 个月)。
2 临床表现
PSCCE 的中位发病年龄为59~60 岁,男女比例约为2.6︰1,且伴随地区差异略有不同。由于该病侵袭性较高,诊断前症状持续时间比其他类型食管癌短,平均为1 个月[1,3,13],与小细胞肺癌不同的是,其肝转移多见,脑转移少见[2]。
3 诊断
PSCCE 细胞形态与SCLC 相似,但因胃镜取材量少,且常有混合细胞类型存在,误诊率很高,147例术后确诊为PSCCE 的患者中,术前病理活检确诊正确率仅为40.8%(60/147),被误诊最多的是ESCC 和低分化癌[3]。
常用的神经内分泌标记物有Syn、NSE、CgA,其中Syn 敏感性最高,而Ki-67 标记指数常用来评价肿瘤细胞的增殖能力,Ki-67>20%对于区分小细胞癌与典型类癌和非典型类癌很有帮助,在PSCCE 中Ki-67 常在50%以上[14]。
4 预后
PSCCE-LD (局限期病变) 的中位生存期(median survival time,MST)可达21 个月,而PSCCE-ED (进展期病变) 为6~12 个月[1,15]。而病灶长度、浸润深度、肿瘤分期、治疗模式等与OS 密切相关。与淋巴瘤、膀胱癌、肺癌不同的是,Ki-67>50%的PSCCE 患者预后更好,可能是因为Ki-67 高表达者有较高的放化疗敏感性,更能从治疗中获益[16]。
TTF-1、NSE、Syn 和CgA 四种免疫标记均为阴性的PSCCE 患者预后最差,MST 为6.1 个月,显著低于有一种标记物阳性者的15.3 个月(P=0.002)[17]。
也有研究发现载脂蛋白A-1/载脂蛋白B 比值、外周血中性粒细胞/淋巴细胞、以及血小板/淋巴细胞比值也是PSCCE 预后的独立因素[18-20]。
5 治疗
由于样本量的限制,既往研究多基于VALSG 分期对PSCCE 的最佳治疗模式进行探索(表1)。张唐娟等[3]对241例PSCCE 患者进行VALSG 分期,结果显示LD 组患者的预后显著优于ED 组(P=0.003),且以手术为主的LD 患者MST 达到27.7 个月,明显高于非手术组的16.2 个月(P=0.007),推荐以手术为主的治疗模式。然而手术创伤较大,大多数患者的生存质量需要9~12 个月才恢复到术前水平[21]。Jeene 等[22]认为放疗总剂量达45~50 Gy 时肿瘤局部病灶也能得到良好的控制,局部复发率仅为21%(5/24),治疗失败最常见的原因是远处转移(45%,23/51)。也有研究认为化疗是全期PSCCE 治疗的基础,以铂类为基础的化疗方案能明显提高生存,并推荐化疗周期数≥4[23-24]。总体上,PSCCE 单一疗法疗效较差,倡导多学科的综合治疗模式。
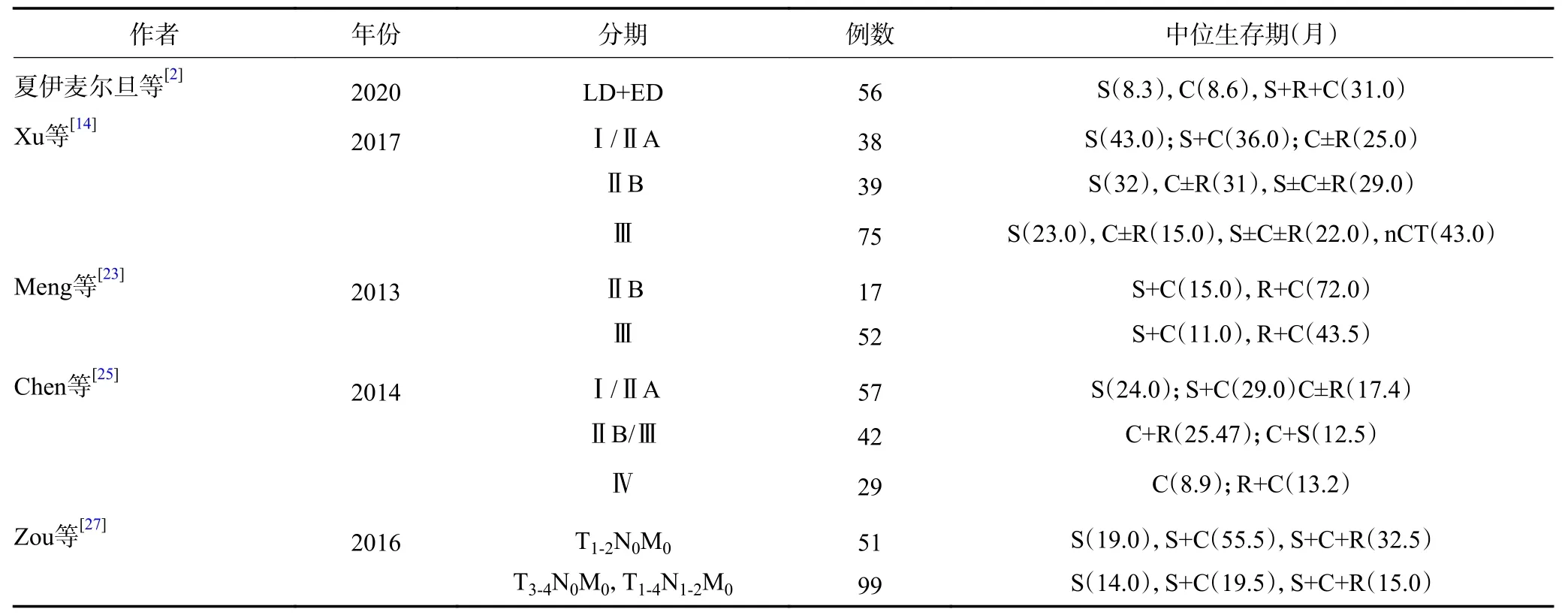
表1 部分PSCCE 治疗方式的回顾性研究
来自美国SEER 数据库的大型回顾性研究分析了387例PSCCE 患者的生存预后情况,结果表明PSCCE 是一种侵袭性高、预后差的疾病,但其较差的预后并不能独立于疾病的临床分期之外,应当根据患者的临床分期提供多种模式的治疗方案,而非仅依靠组织学类型[26]。下面在TNM 分期的基础上总结PSCCE 不同分期的最适治疗方式。
5.1 Ⅰ/ⅡA 期
对于pTis-T1aN0期的ESCC 患者,推荐内镜下黏膜切除术,然而,目前对于早期PSCCE 患者尚无内镜治疗的研究。对于Ⅰ/ⅡA 期患者,Chen 等[25]的研究结果表明,与非手术治疗相比,手术明显提高了PSCCE患者的MST(29 个月vs.17.4 个月,P=0.082),认为早期食管癌应考虑手术治疗。Xiao 等[13]认为手术仅能使T1-4aN0M0的患者获益,对于更高分期的患者放化疗表现出更明显的优势。Xu 等[14]的研究结果显示,单独手术治疗优于非手术治疗(P=0.031),且术后放化疗并未进一步提高患者的总生存期,这与Zou 等[27]的研究结果一致。总的来说,手术被视为Ⅰ/ⅡA 期患者的主要治疗方式。
5.2 ⅡB/Ⅲ期
对于ⅡB/Ⅲ期PSCCE 患者的最佳治疗模式尚存在争议。Meng 等[23]比较了127例手术联合化疗和放疗联合化疗的PSCCE-LD 的生存情况,结果表明放化疗联合使患者明显获益(P<0.05),尤其是对于ⅡB 期、Ⅲ期以及N 阳性的患者,放疗是更佳的局部治疗方式,推荐联合放化疗作为PSCCE-LD的一线治疗。Chen等[25]认为对于ⅡB 期及以上的PSCCE 患者手术并未进一步提高患者OS(11.3 个月vs.12.5 个月),主张采用放化疗联合的治疗方式。Xu 等[14]发现单独手术、手术+辅助治疗、非手术治疗三组患者OS 不具有统计学差异,但新辅助治疗比单独手术或非手术治疗明显延长了Ⅲ期PSCCE 患者的OS(P<0.05),无进展生存期也优于单独接受手术的患者(P<0.031)。国内一项随机对照Ⅲ期临床试验NEOCRTEC5010[28]研究结果显示,对于局部晚期PSCCE 患者,新辅助放化疗可显著降低局部和远处进展,并延长患者OS(100.1 个月vs.66.5 个月),为患者带来更大获益。然而PSCCE 新辅助治疗的病例报道较少,具体疗效有必要进一步探索。
5.3 Ⅳ期
Okuma 等[29]采用伊立替康+顺铂的方案一线治疗晚期PSCCE 患者,MST 达到12.6 个月。Chen 等[25]的研究结果表明,化疗能够提高患者的OS(12.5 个月vs.4.0 个月,P<0.001),而联合放疗能进一步使患者获益(13.2 个月vs.8.9 个月,P=0.014)。Wong 等[30]的研究显示即使采用化疗或放化疗联合的治疗方式,PSCCE-ED 患者的预后仍然较差(中位OS:7~8.5 个月)。精准医学时代的到来,探索新的治疗方式很有必要。
5.4 新兴治疗
肿瘤是免疫逃逸的结果。免疫检查点抑制剂PD-1/PD-L1 为代表的免疫治疗的成功,为食管癌的治疗带来新的希望。KEYNOTE-181、ATTRACTION-3、ESCORT 三大研究阳性结果,奠定了免疫治疗在食管癌二线治疗中的地位,同时推动免疫治疗进军食管癌一线治疗[31-32]。44.1%的PSCCE 患者PD-L1 表达阳性,肿瘤突变负荷为3.64 个突变/Mb,抗PD-1 治疗的客观缓解率预测值为13.2%(95%CI:11.8~15.7),关于免疫检查点的多项研究为PSCCE 的免疫治疗的可能性和有效性提供有力依据,免疫检查点抑制剂等新兴疗法对PSCCE 患者可能同样有效[11]。虽然近年来食管癌的靶向治疗发展缓慢,但PTEN、PAK1 以及PDE3A、PTPRM3 等新兴位点可能会为PSCCE 的靶向治疗提供巨大潜力,未来免疫治疗、靶向治疗以及与其他治疗方式的联合或会为PSCCE 患者带来新的曙光,而寻找精准人群仍是未来持续探索的方向。
6 总结
PSCCE 侵袭性高,预后差,早期诊断尤为重要。越来越多的研究开始着重于PSCCE 分子水平的改变,以优化早期诊断、评估预后、精准治疗。PSCCE 应当根据不同分期制定最适合的治疗策略,对于早期患者推荐手术治疗,而局部晚期甚至广泛期首选联合放化疗,新辅助治疗的疗效尚缺乏大型临床研究进一步证实。同时二代基因测序、免疫治疗、靶向治疗的兴起,终将推动PSCCE 的治疗走向精准医学的道路。
