FGFR2基因异常甲基化在镍暴露与非综合征唇腭裂关联中的作用
2021-08-31潘亚权倪文丽杨文蕾靳蕾李智文任爱国王琳琳
潘亚权 倪文丽 杨文蕾 靳蕾 李智文 任爱国 王琳琳
中国唇腭裂的发病率约为1.4/1 000[1]。以是否伴有其它先天畸形为标准,唇腭裂可分为综合征唇腭裂和非综合征唇腭裂,其中不伴有其它先天畸形的非综合征唇腭裂约占70%[2]。非综合征唇腭裂的病因复杂,普遍被认为受遗传和环境等多种因素影响。环境因素如吸烟、饮酒、叶酸缺乏等[3],与非综合征唇腭裂发生风险增加有关。本课题组前期研究发现,胎儿脐带镉、铅、镍浓度与唇腭裂发生风险增加存在显著的剂量反应关系[4],提示环境金属暴露与唇腭裂发生存在联系,但其致畸机制尚不清楚。
镍广泛存在于水、土壤和空气等环境中,是一种潜在的免疫调节剂和免疫毒性剂[5],有生殖毒性和发育毒性,会导致不育、流产和出生缺陷等[6]。环境颗粒物中的金属镍暴露与DNA甲基化改变有关[7]。已有研究发现,多种出生缺陷,包括唇腭裂、神经管缺陷、先天性心脏病等与DNA甲基化异常相关[8-10]。外部环境对DNA甲基化的影响会影响哺乳动物的发育,造成胎儿对疾病的易感性[11]。FGFR2是成纤维细胞生长因子的受体,其介导的FGF信号通路受损可能导致了3~5%的非综合征唇腭裂的发生[12]。本研究旨在探讨FGFR2基因在母体孕期镍暴露与胎儿非综合征唇腭裂发生风险的关联中发挥的作用。
对象和方法
一、研究对象
1.研究人群来自于本项目组于2002年开始在山西省的平定、昔阳、太谷、泽州和寿阳县进行的以人群为基础的重大体表出生缺陷监测系统。病例纳入条件:产前终止妊娠或分娩时诊断为非综合征唇腭裂并采集有脐带血标本的患儿。对照纳入条件:匹配胎儿性别和母亲孕周,并采集有脐带血标本的无出生缺陷健康胎儿或新生儿。排除标准:病例或对照母亲的调查问卷缺失;病例或对照母亲患有慢性疾病,严重的妊娠并发症或最近一个月内服用过敏感药物。本项目已通过北京大学生物医学伦理委员会的伦理审查。所有纳入对象均已签署书面知情同意书。
2.调查问卷和生物样本:由经过统一培训的调查员使用结构式问卷调查表,对病例和对照组胎儿母亲进行面对面问卷调查。调查完毕的纸质问卷由专人负责运回项目组,采用Epidata 3.0软件,双人录入并专人核对。产科医生在孕妇终止妊娠或分娩时收集脐带组织和脐带血标本。项目组人员定期前往现场把标本转运回实验室,运送过程使用干冰保持低温条件,运达后将脐带组织置于-30 ℃冰箱保存,将脐带血置于-80 ℃冰箱保存。
二、研究方法
1.研究设计:本研究采用两阶段病例对照研究设计,在第一阶段,选取10例非综合征唇腭裂病例和10例性别(一致)、孕周(±2周)相匹配的无先天畸形对照,通过甲基化芯片平台(Illumina 850K),检测脐带血细胞全基因组甲基化水平。在USCS网站(https://genome.ucsc.edu/index.html)查找FGFR2基因甲基化岛位置信息,在PubMed-Gene数据库查找FGFR2甲基化岛片段序列,通过引物设计网站(http://www.epidesigner.com/),在线设计PCR引物。正向引物为:5′-aggaagagag TGGAAGTTTTGTTTTTGTTATTTTT-3′;反向引物为:5′-cagtaatacgactcactatagggagaaggct CAACAATACCA CCCCTAACCAT-3′。
在第二阶段,扩大人群,共纳入24例非综合征唇腭裂病例和57例无先天畸形对照,取脐带血,通过Sequenom MassARRAY时间飞行质谱阵列基因分析平台,分析验证FGFR2基因甲基化岛的平均甲基化水平,探讨其DNA甲基化在镍暴露与非综合征唇腭裂关联中的作用。
2.实验检测:
本课题组前期已通过电感耦合等离子体质谱,完成脐带镍浓度的测定[4]。
(1)DNA甲基化检测流程:基因组DNA亚硫酸氢盐转化,WGA方式扩增、片段化,芯片杂交、洗脱、延伸、成像,数据分析。
(2)Sequenom MassARRAY质谱分析:DNA重亚硫酸盐处理,甲基化特异性PCR,虾碱性磷酸酶SAP反应,碱基特异性酶切反应,脱盐,上机检测,数据分析。
3.统计学分析:根据所有研究对象镍浓度的中位值,将镍浓度转换为二分类变量,即低暴露组和高暴露组。高低暴露组间和病例对照组间的人口学特征差异分析,正态分布的连续变量采用t检验,偏态分布的连续变量采用非参数检验;分类变量采用Pearson卡方检验或Fisher精确检验。
使用Mann-Whitney U检验分析不同病例对照组间甲基化水平的差异;使用非条件Logistic回归模型调整母亲孕期叶酸补充、主动或被动吸烟和饮酒等因素,分析甲基化水平与非综合征唇腭裂发生的关联。根据镍浓度和目的基因甲基化水平的分布类型,采用Pearson相关或Spearman相关分析方法,分析脐带镍浓度与目的基因甲基化水平的关系;并进一步使用线性回归模型调整母亲孕期叶酸补充、主动或被动吸烟和饮酒等因素。
统计分析均采用双侧检验,以P<0.05为有统计学意义。使用SPSS 22.0软件进行数据处理和统计分析。
结 果
1.甲基化芯片结果:阶段一共纳入10例非综合征唇腭裂病例和10例孕周、性别相匹配的无出生缺陷的对照。病例对照组间孕周和性别差异无统计学意义(P>0.05)。
FGFR2基因有2个位于基因体区的位点的甲基化值在病例组和对照组间差异有统计学意义,且病例组的甲基化值高于对照组的甲基化值0.05以上(P<0.05);这两个位点的甲基化值在镍高暴露组和低暴露组间的差异也有显著性(P<0.05),见表1。
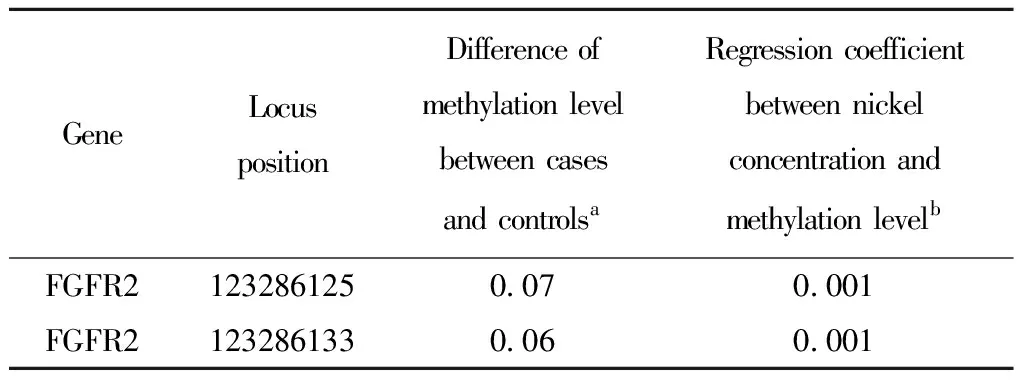
表1 FGFR2基因甲基化差异位点Table 1 Methylation difference of FGFR2
2. Sequenom MassARRAY质谱结果:阶段二纳入24例非综合征唇腭裂病例和57例无先天畸形对照。表2显示了病例组和对照组母亲的基本情况。病例组和对照组母亲的分娩年龄、BMI、教育水平、产次、叶酸补充、吸烟、饮酒、孕周、胎儿性别差异均无显著性(P>0.05)。

表2 第二阶段病例对照母亲和胎儿的基本特征Table 2 Characteristics of mothers andinfants of cases and controls in stage 2
表3显示了高暴露组和低暴露组母亲的基本情况。高暴露组和低暴露组母亲的分娩年龄、BMI、教育水平、产次、叶酸补充、吸烟、饮酒、孕周、胎儿性别差异均无显著性(P>0.05)。

表3 第二阶段镍高低暴露组间母亲和胎儿的基本特征Table 3 Characteristics of mothers and infants of high exposure group and low exposure group in stage 2
对照组甲基化水平的中位数及其四分位数间距为3.36%(2.86%,3.81%),病例组甲基化水平的中位数及其四分位数间距为3.80%(3.23%,4.53%),对照和病例组甲基化水平的差异有统计学意义(P=0.015)。调整了母亲孕期叶酸补充、主动或被动吸烟和饮酒,非条件Logistic回归模型结果显示,FGFR2的甲基化水平升高与非综合征唇腭裂发生风险增加有关(P=0.037),OR(95%CI)为1.89(1.04,3.32)。
脐带组织镍浓度和FGFR2基因甲基化水平的分布类型均为非正态分布,采用Spearman相关法分析脐带镍浓度与FGFR2基因甲基化水平的相关性,结果显示,镍浓度与FGFR2基因的甲基化水平之间存在相关关系(rs=0.229,P=0.040)。使用多重线性回归模型,调整母亲孕期叶酸补充、主动或被动吸烟和饮酒,分析镍暴露水平对FGFR2基因甲基化水平的影响。结果显示,脐带组织镍暴露水平对FGFR2基因甲基化水平的影响不显著(P=0.073)。
讨 论
本研究采用两阶段的病例对照研究设计。在阶段一,发现胎儿脐带镍的高暴露水平可导致FGFR2基因的高甲基化,且FGFR2的高甲基化水平与非综合征唇腭裂的发病风险增加有关。在第二阶段,扩大人群,纳入24例非综合征唇腭裂病例和57例无先天畸形对照,发现胎儿FGFR2基因的高甲基化可能会增加非综合征唇腭裂的发生风险,未发现镍暴露水平对FGFR2甲基化水平存在显著影响。
一项全基因组表观遗传学关联分析的研究发现环境颗粒物中的金属镍暴露与DNA甲基化改变相关[7]。镍(Ⅱ)离子可以取代TET双加氧酶的辅因子铁(Ⅱ),抑制TET基因介导的5-甲基胞嘧啶的氧化活性,抑制DNA去甲基化,从而导致基因高甲基化[13]。本研究的结果显示胎儿脐带镍的高暴露水平与FGFR2基因甲基化水平的升高相关,但在调整了叶酸补充、吸烟和饮酒因素后,未见两者相关联,可能是样本量不足导致研究结果不稳定。
已有研究发现CDH1,LINE-1和IRF6基因的DNA甲基化与非综合征唇腭裂的关联性[14-15]。一项人群研究在184例非综合征唇腭裂的全血样本中对12个基因(FGFR1、FGFR2、FGFR3、FGF2、FGF3、FGF4、FGF7、FGF8、FGF9、FGF10、FGF18和NUDT6)进行了测序和关联分析,并用蛋白质结构分析预测氨基酸功能的变异,指出FGF信号通路受损可能导致了3~5%的非综合征唇腭裂的发生[12]。本研究验证了FGFR2基因甲基化水平的改变与非综合征唇腭裂发病风险增加有关。成纤维细胞生长因子信号通路涉及颅面发育多个方面,包括唇和腭的形成,其在调节神经嵴的诱导和迁移、骨骼形成和上皮-间质交互方面的作用尤为重要[16-17]。FGFR2是成纤维细胞生长因子的受体。FGFR2介导的FGF信号通路在小鼠腭部发育的多个阶段,如再定向、水平生长等方面起着重要作用[18]。研究表明,早期腭发育是通过上皮-间质相互作用完成的,FGF10和FGFR2协调的上皮-间质相互作用的破坏会导致腭裂[19]。
本研究采用两阶段的研究设计,先通过全基因组表观遗传分析发现FGFR2基因的异常甲基化,后扩大样本量进行验证,阶段二在一定程度上支持了阶段一的结果,且在各阶段设有严格的质量控制措施,研究结论可信。当然,考虑到DNA甲基化的组织特异性,本研究DNA甲基化检测的样本来自于胎儿脐带血,而非其唇腭组织,存在一定的局限性。不过也有研究发现血样本DNA甲基化水平可在一定程度上代表唇部组织样本的DNA甲基化水平[20]。
综上所述,本研究发现,胎儿FGFR2基因甲基化水平的升高与非综合征唇腭裂发生风险增加存在关联。虽不能得出脐带镍浓度与FGFR2基因甲基化水平相关的结论,但也为环境金属污染与非综合征唇腭裂的病因学探索提供了思路。当然,本研究的结论需要在不同的人群或更大的样本中进一步分析验证。
