多囊卵巢综合征患者血清IL-22和游离脂肪酸与糖脂标记物相关性的研究
2021-08-31齐新宇庞艳莉乔杰
齐新宇 庞艳莉 乔杰
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种临床表现高度异质性的内分泌代谢紊乱症候群,是育龄妇女无排卵性不孕最主要的原因。据统计,中国社区育龄妇女患病率约为 5.6%[1]。PCOS的主要特征包括卵巢多囊样改变、慢性稀发排卵或不排卵性不孕、高雄激素的临床或生化表现等,严重影响着育龄期妇女的生殖健康。PCOS病理生理改变范围广泛,不仅涉及神经内分泌及卵巢功能的改变,还包括糖脂代谢异常等,PCOS患者常常伴有2型糖尿病、肥胖、高血压、心脑血管疾病等远期并发症,影响患者的生活质量和身心健康[2]。据报道,PCOS患者体内存在脂代谢紊乱,游离脂肪酸(free fatty acids,FFA)显著增加,并且可能与PCOS患者内脏脂肪含量增多、心脑血管疾病的发病风险增加有关[3]。
白介素22(interleukin 22,IL-22)主要是由肠道ILC3细胞分泌的,是一种具有多种保护作用的细胞因子,对维持肠道免疫稳态起着重要的作用[4]。近年来研究表明, IL-22可以改善代谢综合征,外源给予肥胖小鼠IL-22后,包括高血糖和胰岛素抵抗在内的代谢异常等可以被纠正[5]。IL-22可以增加肝脏脂肪水解和脂肪酸氧化,下调脂肪肝;抑制胰岛细胞氧化应激,增加胰岛素分泌,抑制胰岛细胞凋亡而发挥改善肥胖小鼠代谢综合征的作用[6]。课题组前期研究发现,PCOS患者血清及卵泡液中IL-22水平降低[7],给PCOS样小鼠腹腔注射IL-22可显著改善其糖耐量异常、激素水平异常、动情周期紊乱、卵巢多囊样改变等PCOS表型[8]。但目前没有关于PCOS患者IL-22与体内糖脂代谢指标相关性的报道。本研究通过探索肠道免疫因子IL-22与糖脂标记物的相关性,以期为中国女性PCOS导致的免疫代谢功能紊乱的发病与诊断提供合理参考。
对象与方法
一、研究对象
本研究采用病例对照研究,选择2015年9月—2016年12月在本生殖中心初诊的PCOS女性患者作为研究组,选择同期在本院体检中心体检正常的健康女性作为对照组。
1. 纳入标准:(1)年龄在 22~36 岁;(2) 18 kg/m2≤体质量指数(BMI)≤28 kg/m2;(3)自愿参与并签署知情同意书。实验过程通过北京大学第三医院伦理委员会审查,伦理批号为2016SZ-006。
2. PCOS诊断标准参照 2003 年鹿特丹标准[9]:具备以下3 条中的2 条就可诊断为PCOS,(1)无排卵或稀发排卵;(2)高雄激素血症的临床表现和(或)生化依据;(3)超声表现为多囊卵巢:一侧或双侧卵巢有直径2~9 mm 的小卵泡>12 个和/或卵巢体积>10 mL。排除其它雄激素过多的相关疾病,如先天性肾上腺皮质增生、库欣综合征、分泌雄激素的肿瘤、高泌乳素血症以及甲状腺功能异常等,排除其它排卵障碍原因。
3. 在本院体检中心体检,排除胰岛素抵抗、高血压、高血脂等代谢异常,排除其它妇科、消化道、内分泌、神经系统、免疫疾病等的健康女性可纳入对照组。
4. 排除标准:(1)入组前三个月接受过治疗,进行过肥胖症手术及影响免疫系统的治疗;(2)有常规使用抗生素类药物史,三个月内参与过其他研究;(3)三个月内服用过肝毒性药物,如如磺胺类、呋喃类、类固醇类药物等;(4)合并关节炎、风湿性关节炎、肾脏和肝脏疾病;(5)有腹痛、便秘或腹泻等胃肠道症状;(6)孕期或哺乳期妇女。
二、方法
1. 标本收集及检测:所有研究对象于月经第2~4天早晨空腹采血,并测量身高、体重。血离心2 095 g,10 min,分装后于-80 ℃保存。检测时,将收集的血清从-80 ℃拿出,室温融化后,瞬离5 s。用化学发光法检测FSH,LH,空腹血糖(FPG),空腹胰岛素(FINS),总胆固醇(TCHO),总甘油三酯(TG),高密度脂蛋白(HDL)和低密度脂蛋白(LDL)的水平。用LC-MS检测雌二醇(E2),睾酮(T),雄烯二酮(A)和硫酸脱氢表雄酮(DHEA-S)的水平。用免疫发光法检测血IL-22的水平。计算HOMA-IR=空腹胰岛素(IU/mL)×空腹血糖(mmol/L)/22.5。脂肪酸检测时,取10 μL血清,依次加入10 μL混合内标溶液,10 μL 0.9 % Nacl,100 μL氯仿-甲醇(2:1)提取液,涡旋20 s,4 ℃冰箱静置30 min。7 800 g/min离心3 min。1 mL注射器吸取下层液于0.5 mL EP管中,立刻分别吸取20 μL于两个内衬管中(供正负离子分别进样)。氮气吹干,密封存于-20℃冰箱中待用。进样前用20 μL乙腈-异丙醇(1:1)复溶,涡旋60 s,进样检测,仪器为Eksigent LC100和AB SCIEX Triple TOF 5600+。
2.统计学分析

结 果
一、一般临床资料
两组的年龄、BMI、FSH、LH、E2、T、DHEA-S、LDL没有统计学差异。PCOS组患者的A、FPG、FINS、HOMA-IR值、TCHO、TG较对照组明显升高(P<0.05);而HDL明显降低(P<0.05),见表1。
表1 一般临床资料Table 1 General Clinical
二、血清IL-22水平
对收集的24名正常对照及24名PCOS患者的血清进行IL-22检测,结果发现对照组患者IL-22为(29.1±4.0),PCOS组患者IL-22均值为(25.4±3.6),PCOS患者血清中IL-22明显降低(P<0.01),见图1。

图1 PCOS与对照组血清IL-22含量Figure 1 The IL-22 level in PCOS and control groups
三、血清脂质组学分析
对24名正常对照及24名PCOS患者的血清进行了脂质组学分析,由两组脂肪酸的VIP图可见,十四烷酸(FFA 14:0)对两组脂肪酸差异的贡献率最大,其次为十八碳一烯酸(FFA 18:1),二十二碳六烯酸/DHA(FFA 22:6),亚油酸(FFA 18:2),十八烷酸/硬脂酸(FFA 18:0),软脂酸(FFA 16:0),花生四稀酸(FFA 20:4)(图2)。两组志愿者的具体脂肪酸结果如表2显示,PCOS组患者的脂肪酸较对照组有明显升高,依次为FFA 14:0、FFA 18:0、FFA 18:1、FFA 18:2及FFA 22:6较对照组显著升高。
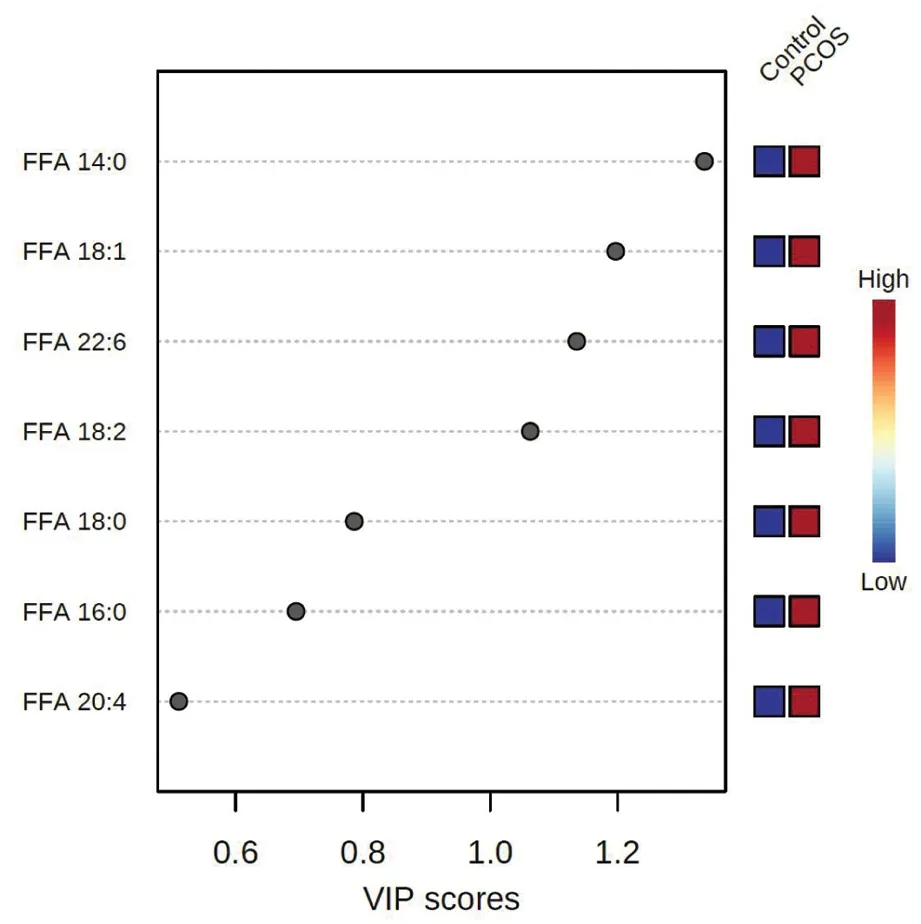
图2 PCOS与对照组脂肪酸VIP图Figure 2 VIP chart of free fatty acids between PCOS and control group

表2 患者血清脂质组结果(Mean±SEM)Table 2 Patient serum lipidome results
四、IL-22与糖脂代谢指标的相关性分析
对所有入组者的IL-22与生殖激素及糖代谢的相关性进行Pearson分析,由表3可见:IL-22与FPG和TG呈负相关(P<0.05)。同时,IL-22与FINS和HOMA-IR呈负相关(P<0.01)。

表3 IL-22与糖脂代谢指标相关性分析Table 3 The Pearson correlation analysis of IL-22 and metabolism markers
五、脂肪酸与糖脂代谢指标的相关性分析
对所有入组者的7种脂肪酸与糖脂代谢指标的相关性进行Pearson分析,由表4可见:FFA 14:0与FINS、HOMA-IR和TG呈正相关(P<0.05),FFA 16:0与TG呈正相关(P<0.05),FFA 18:0与FINS、HOMA-IR、TG呈正相关(P<0.05)。FFA 14:0、FFA 16:0和FFA 18:0与TCHO呈正相关(P<0.01)。FFA 18:1与TCHO呈正相关性(P<0.05)。同时,FFA 18:1与FINS、HOMA-IR和TG也呈正相关(P<0.01)。FFA 18:2与HOMA-IR、TG呈正相关(P<0.01)。同时,FFA 18:2与FINS、TCHO也呈正相关(P<0.05)。FFA 20:4与TG正相关(P<0.05)。FFA 22:6与FINS及HOMA-IR正相关(P<0.05)。

表4 游离脂肪酸与糖脂代谢指标的相关性分析Table 4 The Pearson correlation analysis of free fatty acids and metabolism indicators
*P<0.05,**P<0.01。
讨 论
PCOS作为一种临床表现高度异质性的内分泌代谢性疾病,患者常合并有胰岛素抵抗、肥胖、血脂异常等代谢障碍,严重影响妇女的身心健康。肥胖和脂代谢异常不仅和2型糖尿病、代谢综合征、心脑血管疾病等代谢问题的发生发展关系密切,严重时还会导致卵母细胞发育异常、排卵障碍、月经不调,并增加患者的流产率、降低着床率并影响胚胎发育等[10-11]。肥胖诱发的代谢紊乱,包括胰岛素抵抗和高胰岛素血症等使PCOS女性存在更为严重的内分泌激素紊乱和代谢功能异常。肥胖型PCOS患者体内的FFA增多,过多的FFA一方面可以通过影响肝脏糖代谢过程使肝脏对胰岛素的灭活受到抑制;另一方面,FFA可通过抑制胰岛素受体酪氨酸激酶的活性,从而使血液中胰岛素水平增高。此外,卵巢分泌的雄激素可以在FFA的刺激下分泌增多,并且因为内脏脂肪有更强的脂解活性,所以这种现象在腹型肥胖的PCOS患者中更明显。合并有腹型肥胖的PCOS患者门脉循环中的FFA增高,增加肝脏脂肪变性、肝脏胰岛素抵抗、动脉粥样硬化斑块形成的风险[12]。本研究结果显示,PCOS患者的FFA较对照组升高,尤其是十四烷酸(FFA 14:0)、十八烷酸/硬脂酸(FFA 18:0)、十八碳一烯酸(FFA 18:1)、亚油酸(FFA 18:2)及二十二碳六烯酸/DHA(FFA 22:6)较对照组升高,PCOS患者升高的FFA与患者的空腹血糖、胰岛素、HOMA-IR及血脂异常有相关性,说明PCOS患者糖脂代谢存在一定的障碍,这可能与PCOS患者合并糖耐量异常、糖尿病、肥胖、心脑血管疾病等有关。此外,有研究显示,PCOS患者体内升高的亚油酸水平,不仅可影响PCOS患者的卵母细胞成熟并导致其排卵障碍,还可能与PCOS患者的慢性炎症状态密切相关[13]。另有研究显示,油酸和硬脂酸的浓度与卵母细胞的发育能力有关,这可能是导致PCOS妇女妊娠率下降的原因[14]。
除脂肪酸代谢异常外,PCOS患者体内可能存在多种其他物质代谢途径异常,包括氨基酸、柠檬酸循环、碳水化合物、类固醇激素、胆汁酸、嘌呤的代谢紊乱等,其中PCOS患者的脂质、氨基酸以及柠檬酸循环的代谢异常最为常见[15],与本研究研究结论一致,之前Zhao等人的研究发现,与对照组相比,PCOS中所有确定的脂肪酸均上调[16]。而其他的脂质代谢物,如磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)及其衍生物溶血磷脂酰胆碱(LPC)、溶血磷脂酰乙醇胺(LPE)在PCOS中降低[16]。另一项研究发现,肥胖型PCOS患者与瘦型PCOS患者相比,PC升高,LPC水平降低;肥胖型PCOS患者与瘦型正常对照组相比,多不饱和脂肪酸水平降低,长链饱和脂肪酸水平升高;在肥胖型正常对照组中,花生四烯酸下游的血清生物活性脂质增加;在肥胖和瘦弱的PCOS患者中,与各自的对照组相比,其血清生物活性脂质均降低[17]。PCOS患者内源性氨基酸和糖原性氨基酸的水平升高,如苯丙氨酸,丝氨酸,苏氨酸,酪氨酸和鸟氨酸[16],精氨酸、瓜氨酸、谷氨酸、甘氨酸和组氨酸的水平降低,这可能与PCOS患者的排卵功能障碍有关[15]。此外,PCOS患者存在甘油磷脂代谢的下调和葡萄糖代谢的上调,参与卵磷脂代谢的化合物水平降低。与雄激素代谢有关的三种主要代谢物DHEA-S、硫酸二氢睾酮和硫酸雄甾酮在PCOS患者体内升高[15]。此外,PCOS患者体内胆汁酸水平降低,以甘氨脱氧胆酸(glycodeoxycholic acid,GDCA)下降最明显,普通拟杆菌丰度呈显著升高,GDCA与PCOS患者肠道内普通拟杆菌丰度呈显著负相关关系,给小鼠补充胆汁酸后可改善PCOS小鼠的糖耐量异常、动情周期紊乱、卵巢多囊样改变、生育力下降等[7]。据报道,普通拟杆菌与胰岛素抵抗呈正相关关系,并且可能直接影响宿主的新陈代谢[18]。最近有研究表明,给高脂饮食小鼠补充蜂胶乙醇提取物,可显著改善小鼠的胰岛素抵抗和肥胖,并可降低普通拟杆菌的丰度[19]。
肠道免疫系统失衡是代谢性疾病产生的重要因素,肠道免疫系统对于肥胖、胰岛素抵抗等代谢问题的发病起着重要作用,比如肥胖可改变肠道的免疫力,引发炎症,这与肠道菌群、肠屏障功能、肠道固有和获得性免疫细胞以及管腔抗原的口服耐受性的改变有关,肠道免疫系统可能是全身炎症及胰岛素抵抗的治疗新靶点[20]。在参与肠道粘膜防御的第一道防线——天然免疫系统中,固有淋巴细胞(innate lymphoid cell,ILCs)是新近发现的一群重要的免疫细胞。ILCs家族包括具有细胞毒性的天然杀伤细胞和无细胞毒性的ILC1,ILC2和ILC3亚群。ILC3功能的发挥主要依赖于分泌IL-22。IL-22在机体抗微生物免疫和维持小肠粘膜防御系统完整性上发挥重要作用[21]。近年来研究表明,IL-22可以通过下调下丘脑食物摄取信号;降低外周血管内的内毒素、血糖、血脂及细菌脂多糖;活化肝脏信号传导与转录激活因子3信号通路,增加肝脏脂肪水解和脂肪酸氧化,改善脂肪肝;增强肠道粘膜免疫,增加抗感染能力和肠道粘膜完整性;抑制胰岛细胞氧化应激,增加胰岛素分泌,抑制胰岛细胞凋亡调控多个器官的功能而发挥改善肥胖小鼠代谢综合征的作用[22]。PCOS患者的肠道免疫系统失调,可能导致肠道通透性改变,使一些小分子代谢物作为信使释放入血,进入全身血液循环,激活免疫系统及炎症反应,引起胰岛素抵抗及高雄激素血症等,最终引发PCOS。本课题组之前的研究发现,胆汁酸是肠道菌群与IL-22之间调控的桥梁,“肠道菌群-胆汁酸-IL22”轴在调节PCOS卵巢功能异常、胰岛素抵抗、脂肪棕色化中起着重要的作用[7],给PCOS小鼠腹腔注射IL-22(100 ug/kg/d)可以改善其PCOS表型[8],为将IL-22做为治疗PCOS患者的新靶点提供了理论依据。在本研究中,PCOS患者血清IL-22水平较正常对照明显降低,且IL-22与FPG、空腹胰岛素、HOMA-IR、TG等代谢指标均呈负相关,可能与PCOS患者的肠道免疫失调,导致ILC3分泌IL-22下降有关,IL-22可以作为早期预测PCOS患者代谢异常严重程度的指标之一。虽然小鼠实验证实补充IL-22可以改善小鼠的代谢异常治疗PCOS等,但目前还没有应用于临床。未来,在临床试验的基础上,IL-22可能会成为治疗PCOS的有效药物。
