缺血后适应对右冠状动脉急性闭塞的ST段抬高心肌梗死患者缓慢性再灌注心律失常的影响
2021-08-31叶国红葛菲凡徐海南邓平关贤颂蒋路平
叶国红 葛菲凡 徐海南 邓平 关贤颂 蒋路平
随着我国胸痛中心建设的普及,直接经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术已成为目前我国抢救急性ST 段抬高型心肌梗死(ST segment elevation acute myocardial infarction,STEMI)最快速有效的方法,而术中再灌注损伤的防治是改善患者预后和提高生存率的关键[1]。临床上已经应用缺血后适应(ischemic postconditioning,IPC)来减轻再灌注损伤,但是临床研究结果存在差异[2-4]。再灌注心律失常(reperfusion arrhythmia,RA)作为再灌注损伤的早期表现,是急诊PCI术中的常见现象,同时也是增加手术难度及影响患者预后的主要因素。IPC是否能降低PCI术中RA 的发生,目前仍不确切[1-2]。为此笔者在对右冠状动脉(right coronary artery,RCA)闭塞的STEMI患者行PCI时采用IPC,观察IPC对RA的防治效果;同时通过检测丙二醛(malondialdehyde,MDA)与超氧化物歧化酶(superoxide dismutase,SOD),以初步探讨IPC对RA的影响及其机制。
1 资料与方法
1.1 一般资料 选取2019年3月1日至2020年5月31日首次因STEMI来南华大学长沙中心医院就诊并行急诊PCI,且术中证实为RCA 急性闭塞前向血流TIMI血流0级的患者119例,患者在急诊签署知情同意书后运用软件获取的随机数字表分为IPC组和常规PCI(PPCI)组。最终共入选119例患者,IPC 组60例、PPCI组59例。两组年龄、性别、糖尿病、高血压、高脂血症、吸烟等一般资料无差异(P>0.05),术前心率、肌钙蛋白、胸痛时间、再灌注时间亦无差异(P>0.05),冠状动脉造影(CAG)术中显示右冠优势比率及右冠脉闭塞部位无差异(P>0.05)(表1)。

表1 两组患者基线资料
1.2 入选和排除标准 入选标准:①心电图示下壁和/或右室STEMI,CAG 证实梗死相关动脉为RCA 闭塞TIMI 0级,且无侧支循环形成患者;②发病时间≤12 h。排除标准:①术前已溶栓患者;②有陈旧性心肌梗死、PCI及冠状动脉旁道移植术史者;③血流动力学不稳定(收缩压<80 mm Hg)、室间隔穿孔、二尖瓣腱索或乳头肌断裂等机械并发症者;④术前已出现频发室性早搏(简称室早)、Ⅱ度以上房室传导阻滞(AVB)、阵发性室性心动过速(简称室速)、反复心室颤动(简称室颤)、心脏骤停等心律失常者;⑤病变解剖结构不适合行PCI者;⑥CAG 示病变血管血流TIMI≥1级或远端有侧支循环逆灌注者或重度血栓负荷者;⑦先天性心脏病、风湿性心脏病、扩张型及肥厚型心肌病;⑧急性感染;⑨恶性肿瘤;⑩严重的肝肾功能障碍。本研究已通过我院医学伦理委员会审核。
1.3 方法 所有患者均在急救车或急诊室口服阿司匹林300 mg,氯吡格雷300 mg或(替格瑞洛180 mg)以及阿托伐他汀20 mg治疗。急诊科收集所有患者基线资料、抽血完善生化、MDA、SOD 水平检测、完善十八导心电图(常规十二导加V7~9、RV3~5)。介入过程:采用TIG 管经右桡动脉通路(如桡动脉穿刺失败再改经股动脉)行CAG 确定RCA 为“罪犯”血管病变,前向血流TIMI为0级且无侧支灌注则入组。PCI术前按100 U/kg 给予肝素钠,且冠状动脉内均注射替罗非班0.2 ml/kg。支架选择二代药物洗脱支架。具体操作:IPC组:导丝通过“罪犯”血管病变,在重新恢复血流的1 min内,将预扩球囊(球囊大小根据闭塞部位近端血管直径选择)位于罪犯病变上游,球囊低压扩张(6atm)充气60 s/放气60 s,重复3次[3];再行常规PCI术。PPCI组:直接行PCI术。所有患者均只处理罪犯血管,两组患者冠状动脉开通后,根据血管残存病变情况,决定是否需要植入支架。造影示病变血管远端前向血流达TIMI 3级,残余狭窄<20%,无严重并发症发生,为PCI手术成功的标准。术中出现RA 处理方法:IPC组缺血后处理三循环后或PPCI组观察6 min后仍有持续的快速性心律失常及频发室早的予利多卡因或者胺碘酮抗心律失常,有血流动力学紊乱的电复律;出现缓慢性心律失常持续的予阿托品0.5~1 mg静脉注射,持续三度AVB 的予临时起搏。术后无出血倾向的常规替罗非班维持24 h,如无禁忌常规给予血管紧张转换酶抑制剂/受体阻滞剂、β受体阻滞剂、他汀,双联抗血小板治疗1年。
1.4 观察指标 ①RA:各组病变血管再灌注后30 min内,由心内科介入医生通过多导心电监护记录仪观察和记录频发室早、室速、室颤、Ⅱ~Ⅲ度AVB、交界性逸搏心律、心动过缓(心率<50 次/分)、窦性停搏等发生频率及持续时间,使用药物复律、临时起搏及电转复的例次。
1.5 MDA、SOD 测定 所有患者于术前、术后即刻、24 h与48 h分别抽静脉血约2 ml,存于真空抗凝采血管内,在20 min内进行离心(3 000 r/min,10 min,室温),分离并收集血浆并标记,在-80℃冷冻保存,并在标本完全收集后进行检测。MDA 检测采用TBA 法按试剂盒(索莱宝公司)说明操作。SOD 检测采用ELISA 方法按照试剂盒(索莱宝公司)说明操作。
1.6 统计学方法 使用SPSS19.0软件进行数据处理和统计学分析。计量资料呈正态分布的采用均数±标准差表示,不呈正态分布的采用中位数(P25,P75)。两组间均数的比较采用t检验,不呈正态分布采用秩和检验,计数资料采用例数、百分率(%)表示,组间比较用卡方检验,以P<0.05为差异有显著性。
2 结果
2.1 两组PCI术中发生RA 比较 IPC 组术中出现RA 的比率较PPCI组明显降低,其中AVB、心动过缓及窦性停搏较PPCI组明显减少(P<0.05)。而室速、室早等快速性心律失常未见明显差异(P>0.05)。两组患者缓慢心律失常及需要药物及电转复、临时起搏情况,PPCI组高于IPC 组(P<0.05)。在IPC组出现RA 时给予球囊充气扩张后可以有效终止,需要药物及临时起搏的机率下降(表2)。IPC组室速8例(其中2例给予利多卡因,3例给予胺碘酮,1例通过球囊扩张后复律)、室颤2例(1例在准备电复律过程中通过球囊扩张后自行终止,1例通过电复律),8例心动过缓(其中4例出现心动过缓和Ⅲ度AVB交替,3例通过球囊扩张后好转)、2例Ⅲ度AVB(最终行临时起搏)。而PPCI组室速10例,其中3例室速患者发生室颤最终电复律,发生缓慢性心律失常30例(其中1例为电复律后出现),其中13例出现Ⅲ度AVB 最终行临时起搏治疗,7例出现高度AVB。
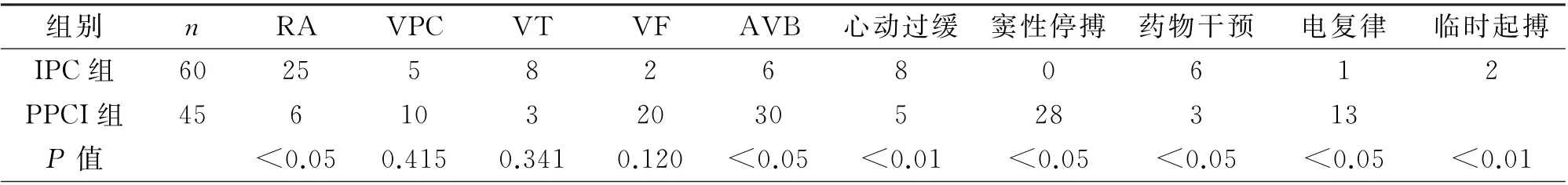
表2 两组患者RA 情况/例
2.2 两 组MDA、SOD 比 较 两 组 术 前SOD 及MDA 均无差异,术后两组MDA 下降、SOD 上升。术后与PPCI组比较,IPC 组术后各时间点SOD 均明显升高(P均<0.05);而MDA 术后各时间点均明显下降(P均<0.05)(表3)。
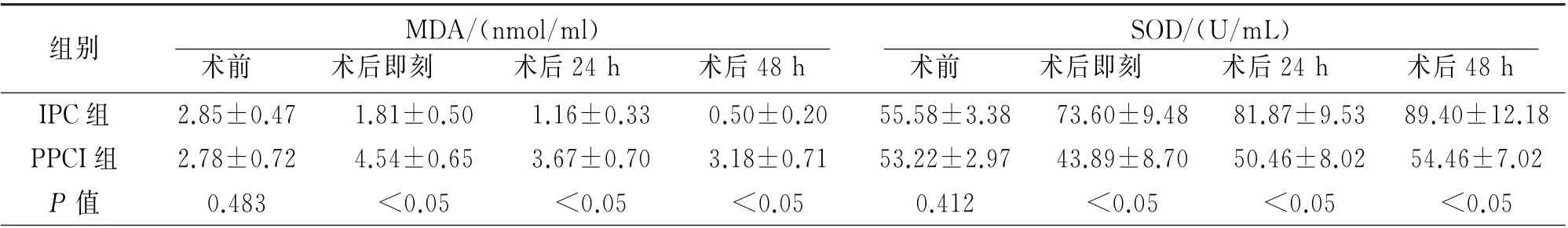
表3 两组间MDA、SOD 水平比较
3 讨论
IPC对RA 的作用最早的临床报道是1994年英国医生Grech[5],随后许多学者在缺血再灌注动物模型上进行了大量的基础研究证实IPC 对持续性再灌注诱导的快速性心律失常有较强的抗心律失常作用[2,6]。既往的研究多是采用结扎动物左前降支的方法或临床上观察IPC 对快速性室性心律失常的效果。对于单纯右冠状动脉闭塞的患者及IPC对缓慢性心律失常的影响研究很少。本研究选择右冠闭塞的STEMI患者,在急诊PCI术中血运重建60 s内采用IPC 60/60 s三个循环的IPC 方法,发现与直接PCI组比较,IPC 能明显减少再灌注导致的缓慢性心律失常的发生、持续时间以及需要干预的比例。与国内外学者报道不同[2,7]的是本研究发现IPC对快速性心律失常的发生影响不大;这可能与右冠状动脉闭塞再灌注心律失常本身主要表现为缓慢性心律失常及本研究两组中快速性心律失常发生率均低有关。
RA 是指冠状动脉突然解除梗阻,缺血心肌重新获得血液灌注后的一定时间内发生的心律失常,临床上RA 既是判断冠状动脉再通的一项指标,同时也是缺血再灌注期患者猝死的重要原因[8]。RA大多在闭塞血管开通后1 min左右突然发生且变化快,如不立即终止往往继发血流动力学不稳定的特点,所以是PPCI术最危急的时刻[5,9]。文献报道,PCI手术后RA 发生率可达40%以上,而当病变血管为右冠状动脉闭塞行PCI过程中RA 发生率更高达50%~80%[4,10],且主要表现为缓慢性心律失常,常伴有低血压现象,其机制在于:①与RCA 的供血范围有关,对于右冠优势型的人窦房结的血液60%、房室结的血液90%及左室下后壁均由右冠状动脉供给。右冠闭塞时容易导致窦房结及房室结缺血,使窦房结、房室结功能受抑;②与自主神经在心脏的分布有关,窦房结、房室结和心脏下后壁心肌有着丰富的迷走神经纤维;同时导致Bezold-Jarisch反射的心脏抑制性感受器主要分布于左室下后壁,再灌注时容易刺激迷走神经导致迷走反射,导致低血压和心动过缓[11]。既往国内外为了预防这种缓慢性心律失常,临床工作中主要是在再灌注前保护性植入临时起搏及静脉或冠状动脉内注射阿托品减轻迷走反射[8,12]。这两种方法均存在一些缺陷,首先因为缺血及再灌注时心肌本身电不稳定,临时起搏导线的刺激有可能增加室速及室颤的发生,对于下壁心肌梗死还会增加心脏穿孔的风险;而阿托品有起效偏慢及导致尿潴留和便秘的风险,同时心率加速亦有可能增加早搏和诱发室性心律失常。本研究发现对于RCA 导致的STEMI患者在急诊PCI过程中采用IPC 方法能明显降低缓慢性心律失常的发生率,且对术中出现的缓慢性心律失常,通过球囊扩张多能有效终止和改善,能大大降低需要植入临时起搏及药物干预的比率。
RA 的发生机制,大量基础研究证实主要与大量氧自由基形成,钙离子超载、磷酸化障碍有关[13]。其中大量氧自由基的产生可能是其始动因素,心肌缺血再灌注后几秒至几分钟内,血流和心肌组织内氧自由基含量可增加数倍,造成细胞结构损伤和功能代谢障碍损伤。MDA 是氧自由基与细胞膜脂类成分发生氧化反应的产物,是氧化应激的重要标志物之一,MDA 增加表明细胞膜结构受到破坏,MDA含量可间接反映氧自由基对心肌脂质过氧化反应的程度;SOD 是机体内清除氧自由的一种特异酶,其活性反映机体抗氧化功能,SOD 活性下降引发脂质过氧化物在金属离子存在下催化裂解产生MDA,诱发细胞凋亡[14]。当心肌缺血再灌注发生时,堆积的大量氧自由基作用于膜上的不饱和脂肪酸,产生脂质过氧化反应,破坏了细胞的结构和功能,造成心肌细胞坏死及功能障碍。脂质过氧化反应导致的细胞膜不稳定性加剧、通透性增加、流动性降低,致使Ca2+内流明显增加,进而诱发心律失常。同时线粒体膜脂质过氧化导致三磷酸腺苷(adenosine triphosphate,ATP)生成减少及心肌细胞能量代谢功能紊乱加重,从而造成ATP 依赖性离子泵功能障碍以及RA[15]。而Raimann等[16]的研究发现线粒体呼吸链途径产生的氧自由基很可能是通过使缝隙连接蛋白43氧化率增加而导致RA 发生。Abdel-Rahman等[18]在猪的体外循环模型中观察到采用逐步复氧的方法可以明显降低再灌注过程中发生室颤的机率,并发现与常规组比较MDA 水平在逐步复氧组中明显下降。康品方等[17]通过结扎冠状动脉前降支复制出大鼠离体心脏缺血/再灌注损伤模型,观察复灌期间心律失常的发生率,发现再灌注心律失常的发生与MDA 成正相关,与SOD 成负相关。
为此我们通过在PCI术前、术后不同时间点抽血检测SOD 和MDA 浓度,发现两者组间术前均无明显差异,而术后各个时间点IPC 组MDA 较常规组明显下降,SOD 则较常规组明显升高,这也与大量的动物实验结果一致[18-19]。所以我们认为IPC可能是通过减少活性氧产生、促进SOD 等抗氧化产物生成,进而减少MDA 等膜脂质过氧化产物的堆积,从而抑制炎症氧化应激、减轻细胞内钙超载、稳定线粒体膜电位和改善细胞间缝隙连接,达到抑制触发活动和折返激动的作用,最终减少RA 的发生。
本研究主要的局限性:①单中心研究病例偏少;②入选的均为病情稳定的患者,对病情危重的患者局部缺血后适应是否有同样的作用不得而知;③目前随访仍在进行中,IPC对长期预后的影响,尤其是出院后恶性心律失常的影响仍需进一步研究。
