温郁金脱毒快繁及移栽方法研究
2021-08-30郭月琴李帆姜程曦任仙樱
郭月琴 李帆 姜程曦 任仙樱

摘要 [目的]通过试验寻找出优良的温郁金脱毒苗的制备方法及栽培方法。[方法]通过固定其中一个条件不变,改变其他因素,验证出较好的温郁金根状茎消毒方法,及其丛生芽的诱导、愈伤、继代、分化、生根培养方法。[结果]温郁金根状茎的消毒方法为流水冲洗30~50 min,再用70%乙醇和10%过氧化氢先后消毒20~40 s和6~8 min,然后用无菌水重新冲洗3~4次。丛生芽诱导培养基为MS+6-BA 3.0 mg/L+NAA 1.0 mg/L,愈伤、继代、分化、生根培养基分别为MS+2,4-D 2.0 mg/L+KT 5.0 mg/L、MS+2,4-D 1.0 mg/L+KT 0.5 mg/L、MS+KT 5.0 mg/L + NAA 0.3 mg/L、MS+NAA 1.0 mg/L。[结论]通过对脱毒苗制备过程的条件控制,使温郁金脱毒苗品质较高以及脱毒率可以达到100%,另外提供科学的栽培方法,使所制备的脱毒苗栽培育苗后成活率达到100%,且幼苗健壮。
关键词 温郁金;脱毒苗;制备方法;移栽方法
中图分类号 S 567.23+9 文献标识码 A
文章编号 0517-6611(2021)16-0040-04
doi:10.3969/j.issn.0517-6611.2021.16.012 开放科学(资源服务)标识码(OSID):
Study on the Rapid Propagation and Transplanting Methods of Virus-free Seedling of Curcuma wenyujin
GUO Yue-qin1,2,LI Fan2,JIANG Cheng-xi1,3 et al (1.College of Pharmaceutical Sciences, Wenzhou Medical University,Wenzhou,Zhejiang 325035;2.Institute of Life Sciences,Wenzhou University,Wenzhou,Zhejiang 325035;3.Wenzhou Ejin Pharmaceutical Co.,Ltd.,Yueqing,Zhejiang 325600)
Abstract [Objective]The preparation method and cultivation method of excellent Curcuma wenyujin virus-free seedlings were found through experiments.[Method]By fixing one of the conditions unchanged and changing other factors, a better disinfection method of Curcuma wenyujin rhizomes, and the induction, callus, subculture, differentiation, and rooting culture methods of cluster buds were verified.[Result]The disinfection method of Curcuma wenyujin rhizoma tympanum was to flush the rhizoma tympanum by running water for 30-50 minutes, then disinfect it with 70% ethanol and 10% hydrogen peroxide for 20-40 s and 6-8 minutes successively, and then rinse it again with sterile water for 3-4 times.The cluster bud induction medium was MS+6-BA 3.0 mg/L+NAA 1.0 mg/L.The media for callus, subculture, differentiation and rooting were MS+2,4-D 2.0 mg/L+KT 5.0 mg/L, MS+2,4-D 1.0 mg/L+KT 0.5 mg/L, MS +KT 5.0 mg/L + NAA 0.3 mg/L, MS+NAA 1.0 mg/L.[Conclusion]By controlling the conditions in the preparation process of virus-free seedlings, the quality of Curcuma wenyujin virus-free seedlings is higher and the virus-free rate can reach 100%,and by providing scientific cultivation methods, the survival rate of the prepared virus-free seedlings after cultivation and nursery can reach 100%, and the seedlings are robust.
Key words Curcuma wenyujin; Virus-free seedlings;Preparation method;Transplanting method
溫郁金 (Curcuma wenyujin) 系浙江南部地区种植的一种姜科姜黄属植物,其块根、根茎可供药用,块根加工成的药材温郁金是浙江省著名道地药材“浙八味”之一[1]。目前,温郁金的野生种已罕见,以人工栽培为主。温郁金喜温暖湿润、阳光充足的气候,耐旱抗涝,但怕霜冻,适宜在土质疏松、排水良好、土层深厚的冲积土、砂壤土中生长[2-5]。温郁金开花很少,种子多不充实,栽培上用种姜根茎繁殖。温郁金年生长周期约250 d,一般4月上旬(清明前后)种植,12月中上旬收获[6]。
随着工农业生产的发展,土壤污染日益严重,尤其是土壤中有害重金属积累到一定程度就会对土壤-植物系统产生毒害,不仅导致土壤退化,还会引起农作物产量和品质降低,危及人类生命和健康。温郁金在环境因子的作用下,植物与病原菌相互适应和相互斗争导致病害的发生和蔓延。由于温郁金属于多基源品种,来源复杂,并且目前温郁金的种植基本上是按照传统的粗放模式进行,导致品种退化、病毒化严重、采收及产地加工不规范等情况出现[7],致使药材质量不稳定,难以得到控制,进而影响产品质量,市场竞争力下降,市场占有份额扩展困难。
近年来,脱毒苗的研究与使用能够在一定程度上缓解上述问题。赵霞等[8]通过对草莓茎尖进行热处理脱毒处理,得到的草莓苗繁育增殖、病虫害减少,降低了生产风险,提高了经济效益。吴顺等[9]以无花丹参茎尖为材料,优化其脱毒培养和植株再生的激素浓度组合,筛选出最佳组合,所得的无花丹参苗移栽后病虫害减少且长势优良。肖雅等[10]以感染TMV和CMV的湘西本地小黄姜为试材,采用热处理、茎尖培养结合添加病毒唑的方法进行脱毒处理以获得无病毒的优质生姜种苗,其脱毒率可达100%。
该试验为了克服现有技术存在的不足,经过多年试验,研制出一种温郁金炼苗方法及移栽方法,为温郁金组培苗生产者提供技术参考,同时为温郁金GAP生产提供新的规范化种植模式。
1 材料与方法
1.1 材料 该试验所用的温郁金顶芽或腋芽尖来自浙江温州市瑞安沙洲村温郁金种植基地,并由温州医科大学姜程曦教授鉴定,共100批次。
1.2 试剂与仪器
MS培养基,KT、6-BA、2,4-D、NAA激素,均来自北京酷来搏科技有限公司;光照培养箱LI180A、恒温培养箱来自上海京孚仪器有限公司。
1.3 试验设计
1.3.1 芽的脱毒。
秋天收获时,挑选株高在70~120 cm的矮秆品种温郁金,取温郁金根状茎上的0.5~2.0 cm的顶芽或腋芽尖端作为接种材料,并对其进行消毒处理,每种处理接种50个。试验设置5个处理。处理①,流水冲洗10~15 min,用70%乙醇和10%过氧化氢先后消毒10~15 s和3~5 min,无菌水冲洗3~4次;处理②,流水冲洗30~50 min,再用70%乙醇和10%过氧化氢先后消毒20~40 s和6~8 min,然后用无菌水重新冲洗3~4次;处理③,流水冲洗10~15 min,再用70%乙醇和10%过氧化氢先后消毒20~40 s和6~8 min,然后用无菌水重新冲洗3~4次;处理④,流水冲洗10~15 min,70%乙醇溶液消毒10~15 s,无菌水冲洗3~4次;处理⑤,流水冲洗10~15 min, 10%过氧化氢先后消毒3~5 min,无菌水冲洗3~4次。
脱毒率=脱毒个数/成活个数×100%(1)
1.3.2 根状茎顶芽的诱导培养。
在无菌条件下,取茎尖生长点,切成0.1~0.3 mm方块接种在MS含有6-BA和NAA不同浓度配比的茎尖启动培养基上,每处理接种50个,在无光照和溫度为12~18 ℃的条件下培养2~5 d,然后在温度为18~24 ℃,每天光照为4~6 h的条件下培养15~20 d,观察茎尖诱导率。
诱导率=成活数/接种数×100%(2)
1.3.3 愈伤组织的诱导。
将小芽转接至含有不同激素2,4-D和KT配比的MS培养基中,在28 ℃进行愈伤组织的诱导,观察愈伤组织的形成情况,每处理接种50个。
1.3.4 继代培养。
形成愈伤组织后转接至含有不同激素2,4-D和KT配比的MS培养基中进行继代培养,观察生长情况,每处理接种50个。
继代培养成活率=继代培养成活数/接种数×100%(3)
1.3.5 转接分化。继代培养之后转接至含有不同激素NAA和KT配比的MS培养基中进行分化,观察分化情况,每处理接种50个。
分化率=分化数/接种数×100%(4)
1.3.6 生根。分化后转接至以MS为基本培养基,分别添加至6-BA、2,4-D、NAA和KT的培养基中进行生根,观察生根情况。
生根率=生根数/接种数×100%(5)
1.3.7 移栽。
在日平均温度为20~30 ℃时进行移栽。研究不同基质、不同基质消毒方式和不同肥料对温郁金育苗的影响,选取长势一致的温郁金脱毒苗,采用正交试验的方法(表1)进行试验,每50株作为一个处理。
基质的原料有椰糠、表土、河沙。A1.椰糠;A2.椰糠∶表土=1∶1;A3.椰糠∶表土∶河沙=1∶1∶1。
基质消毒法使用3种方法:B1.活性炭消毒法,是指将椰子壳烧成灰,洒在基质表面;B2.雷公藤根粉+细土或草木灰消毒法,为该试验原创法,雷公藤的根粉碎成的细粉使用量为每株苗用2.5~3.0 g,细土或草木灰5.0~6.5 g;B3.多菌灵消毒法,每株苗施50%多菌灵可湿性粉剂0.015 g。
使用3种肥料:C1.农家肥;C2.秸秆肥;C3.腐熟的菜籽饼、提取莪术油后产生的药渣以质量比为20~30∶1捣碎混合。3种肥料都是每株苗1.5~3.0 g通过穴施方法施肥。
采用“+”针对成活率、病虫害、生长态势进行评价,5个“+”最优。
2 结果与分析
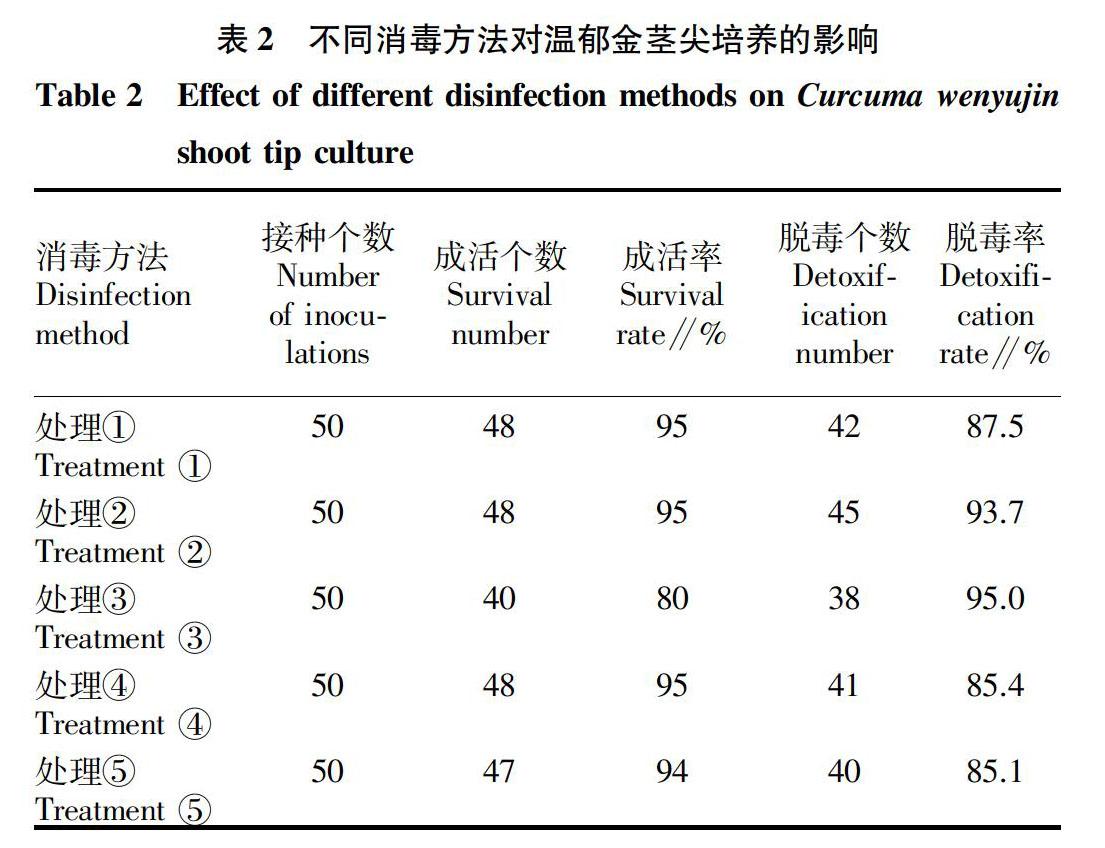
2.1 不同消毒方法对温郁金茎顶芽(腋芽)培养的影响
试验结果表明(表2),各种处理对接种材料都能起到良好的消毒作用,但不同消毒方法的脱毒率与茎尖成活率之间存在差异,其中处理②与处理③的脱毒率较高,但是处理③的成活率最低,处理②的成活率也是最高,适于温郁金茎尖培养。
2.2 不同浓度激素配比对温郁金顶芽(腋芽)诱导率的影响 从表3可以看出,随着6-BA浓度的升高,诱导率逐渐升高后基本持平,且以3.0 mg/L为好;随着NAA浓度的升高,诱导率逐渐升高后基本持平,且以1.0 mg/L为好。所以温郁金茎尖诱导最佳的激素为MS+6-BA 3.0 mg/L+NAA 1.0 mg/L。
2.3 不同浓度激素配比对温郁金顶芽(腋芽)愈伤组织的影响
从表4可以看出,随着2,4-D 浓度的升高,生成的愈伤组织个数逐渐升高后基本持平,且以2.0 mg/L为好;随着KT浓度的升高,生成的愈伤组织个数逐渐升高,且以5.0 mg/L为好。所以温郁金顶芽(腋芽)愈伤组织的最佳激素配比为MS+2,4-D 2.0 mg/L+KT 5.0 mg/L。
2.4 不同浓度激素配比对温郁金顶芽(腋芽)继代培养的影响
从表5可以看出,随着2,4-D 浓度的升高,继代培养成活率逐渐升高后开始下降,且以1.0 mg/L为好;随着KT浓度的升高,成活率逐渐升高后有所下降,且以0.5 mg/L为好。所以温郁金顶芽(腋芽)继代培养的最佳激素配比为MS+2,4-D 1.0 mg/L+KT 0.5 mg/L。
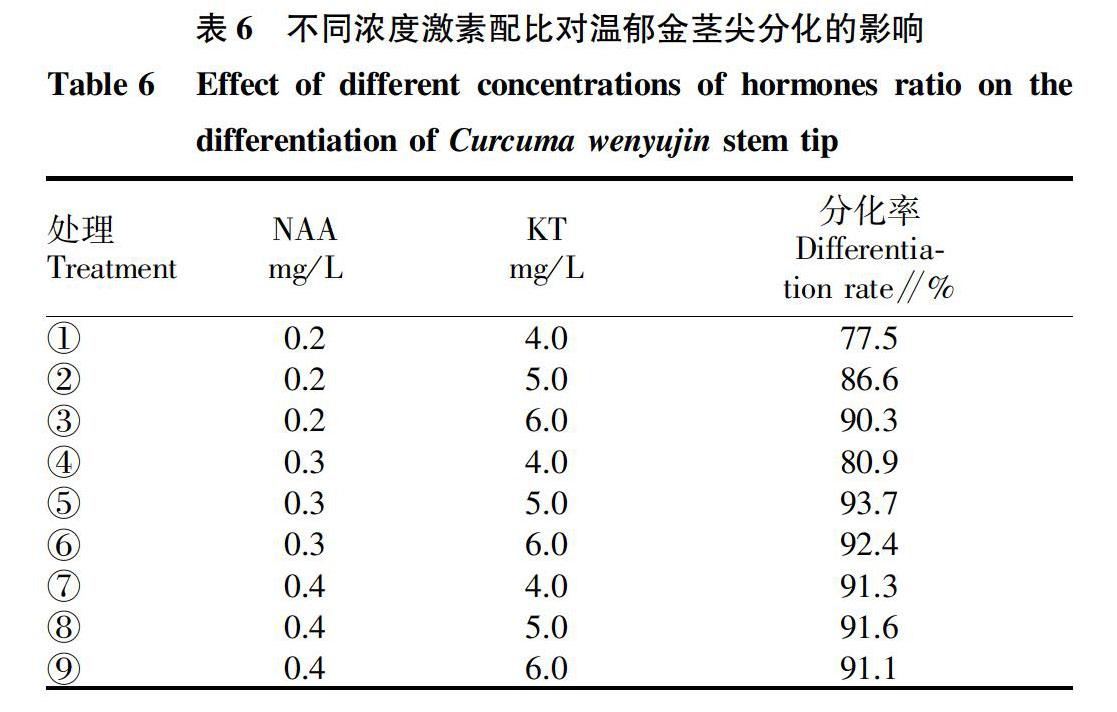
2.5 不同浓度激素配比对温郁金顶芽(腋芽)分化的影响
从表6可以看出,随着NAA 浓度的升高,分化率逐渐升高后开始下降;随着KT浓度的升高,分化率逐渐升高后基本持平。综合考虑,以NAA 0.3 mg/L+KT 5.0 mg/L为好。所以温郁金顶芽(腋芽)分化培养的最佳激素配比为MS+KT 5.0 mg/L+NAA 0.3 mg/L。
2.6 不同激素配比对温郁金顶芽(腋芽)分化后生根的影响
从表7可以看出,添加NAA激素的培养基诱导生根率最高,为97.3%;添加6-BA激素的培养基诱导生根率最低,为86.0%;最高最低相差11.3%。所以,添加NAA 1.0 mg/L激素的培养基诱导生根为最适培养基。
2.7 移栽 试验结果显示(表8),任何含有A3、B2、C3因素的栽培方式都可以起到促进温郁金脱毒苗的生长,以A3B2C3为组合的移栽方式最优,为“+++++”,幼苗成活率为最高(98.91%),病虫害相比传统栽培方法[11]最高能降低84%,生长态势较传统脱毒苗[12]也更为良好。
3 结论与讨论
该试验以温郁金根状茎顶芽(腋芽)为材料,参考前人的研究[13-14],寻找一种更合适温郁金脱毒苗的制法。结果发现,消毒方法为用流水冲洗温郁金顶芽(腋芽)30~50 min,再用70%乙醇和10%过氧化氢先后消毒20~40 s和6~8 min,然后用无菌水重新冲洗3~4次,可以达到100%的脱毒率;脱毒后以MS+6-BA 3.0 mg/L+NAA 1.0 mg/L为诱导培养基,以MS+2,4-D 2.0 mg/L+KT 5.0 mg/L为愈伤组织培养基,以MS+2,4-D 1.0 mg/L+KT 0.5 mg/L培养基进行继代培养,以MS+KT 5.0 mg/L+NAA 0.3 mg/L培养基进行分化,以MS+NAA 1.0 mg/L培养基进行生根,得到脱毒试管苗成活率能达到100%。
另外,该试验参考前人的方法[5,15]在温郁金脱毒苗的移栽方法中创新了对基质的消毒方法和肥料的应用,即采用雷公藤的根粉碎成的细粉加草木灰对土壤进行消毒,选用腐熟的菜籽饼、提取莪术油后产生的药渣作为肥料。
植物经过几代种植,品质一般都出现不同程度的退化,使得植物成活率不高,生长态势不好,而导致这一现象的主要原因是植物病毒的感染。为克服这一问题,获得高产,脱毒苗在植物的种植上得到广泛应用。该试验在传统温郁金脱毒苗制备的方法上[12],结合了其他的方法,寻找到一种更适合温郁金脱毒苗制备的方法,在后续过程中,能培育出成活率更高的苗。
温郁金是一种药用价值极高的药材,其含有的β-榄香烯[16]更是在抗癌方面表现出了很大的潜力。所以,寻找出一条能够快速高效获得温郁金资源的途径非常有必要。该试验为了克服现有技术存在的不足,经过多年试验,研制出一种温郁金脱毒苗的制备方法及移栽方法,为温郁金脱毒苗生产者提供技术参考,同时也为温郁金GAP生产提供新的规范化种植模式。
参考文献
[1] 方露敏,黄真.温郁金的研究进展[J].中华中医药学刊,2008,26(9):1998-2000.
[2] 何寻阳,曹建华,卢玫桂.不同土壤环境对温郁金栽培的影响研究[J].中国生态农业学报,2007,15(5):98-101.
[3] 何寻阳,曹建华,李小芳,等.温郁金的石灰土栽培及其营养元素动态变化初步研究[J].中国岩溶,2007,26(1):49-54.
[4] 杨三豹,卢启强.温郁金优质高产栽培技术[J].温州农业科技,2004(2):24,30.
[5] 潘梅,符瑞侃,吕德任,等.不同栽培基质对4种姜科花卉组培苗移栽成活和生长的影响[J].热带生物学报,2016,7(3):363-367.
[6] 赵沛锋.浅谈新开发耕地温郁金栽培技术[J].中国农业信息,2015(17):38.
[7] 姜武,吴志刚,陶正明,等.温郁金温莪术药材重金属及农药残留分析[J].浙江农业科学,2015,56(6):851-852.
[8] 赵霞,宋勇义,梁树乐.草莓茎尖脱毒及原种苗的网室繁育技术[J].中国果菜,2018,38(7):90-92.
[9] 吴顺,张琴,詹乐洋,等.无花丹参的脱毒培养及植株再生[J].中药材,2015,38(3):451-453.
[10] 肖雅,雷艳,杨建国,等.生姜脱毒快繁与病毒检测技术研究[J].现代农业科技,2017(22):49-51.
[11] 吴志刚,陶正明,徐杰.温郁金GAP栽培技术标准操作规程[J].浙江农业科学,2008,49(2):165-167.
[12] 汪洪,蔡小军,于晓敏,等.温郁金脱毒组织培养技术研究[J].药物生物技术,2009,16(6):565-567.
[13] 王曉慧,杨恩秀,庞实锋,等.温郁金愈伤组织培养及快速繁殖[J].北方园艺,2008(10):143-146.
[14] 汪洪,林观样,李校堃.温郁金的组织培养与快速繁殖[J].植物生理学通讯,2007,43(3):509-510.
[15] 吕德任,潘梅,戚华莎,等.温郁金组培苗移栽技术[J].中国园艺文摘,2013,29(9):155-156.
[16] XU L Y,TAO S J,WANG X M,et al.The synthesis and anti-proliferative effects of β-elemene derivatives with mTOR inhibition activity[J].Bioorganic & medicinal chemistry,2006,14(15):5351-5356.
