花生根际微生物群落结构对干旱和盐胁迫的响应
2021-08-30梁新波张冠初丁红徐扬李泽伦石书兵张智猛
梁新波 张 晨 张冠初丁 红徐 扬李泽伦石书兵*张智猛*
(1.新疆农业大学农学院,新疆 乌鲁木齐 830052;2.山东省花生研究所,山东 青岛 266100)
我国幅员辽阔,干旱半干旱地区面积占国土面积的52.5%,其中半干旱地区占22.0%,干旱地区占30.5%[1]。我国70%以上的花生集中产区分布于干旱半干旱地区的古河故道、丘陵坡地等处,花生虽是抗旱耐瘠固氮和中度耐盐碱作物,但干旱缺水、肥力瘠薄、土壤盐碱胁迫仍是制约花生持续发展和提高产量效益的主要因子,是我国花生生产上分布最广、危害程度最大的限制因素。受干旱半干旱区气候条件、地下水埋深、土壤特性、矿化度等自然条件和诸如灌溉、施肥和种植方式等人为不合理利用、干预等诸多因素影响,耕作土壤次生盐渍化风险较高[2-3]。
花生是我国重要的油料作物和经济作物,其总产量和出口量均居世界首位[4]。因常年干旱引起的受害面积达266.7万hm2,减产率平均在20%以上,是花生生产必须着重解决的关键问题之一[5]。同时,随着国民生活水平和健康理念的发展,高质量食用植物油需求和供应矛盾凸显,花生油因其较高的不饱和脂肪酸含量受到广大消费者的认可和青睐。然而,干旱和土壤盐渍化严重威胁干旱半干旱区农业生产和种植业结构优化的同时,也影响着花生产业的持续发展,在继续提高花生产量的基础上,扩大种植面积是缓解食用植物油需求和粮棉油争地矛盾的重要途径。因此,高效利用干旱半干旱地区温光热和耕地资源、开发垦殖利用次生盐渍化和盐渍化土地,可极大地提高干旱半干旱地区脆弱农业种植结构的抗风险能力。
根际微环境是构建植物与土壤交流沟通的桥梁,也是植物遭受胁迫时优先作出响应的区域[6]。根际微生物对植物的生长发育、养分获取及病害防御起着至关重要的作用[7-8],同时,植物也通过根系对根际微生物群落结构和功能加以驯养和塑造[9-11]。以往多是分别进行水和盐胁迫条件对根际土壤中微生物的影响研究,主要从根际土壤养分与酶活性[12]、微生物数量与分布特点[13-14]、土壤微生物群落组成[15]以及土壤微生物功能代谢[16]等方面,很少有人探究水盐共同作用下根际土壤微生物的响应,尤其在次生盐渍化和较轻度盐碱胁迫的干旱半干旱农业生产地区更显重要
本试验模拟干旱、盐碱胁迫条件,研究花生根际微生物群落结构的组成及变化,旨在从花生根际细菌群落结构的角度阐述干旱和盐胁迫对花生根际细菌菌群的影响及与根际微生物之间的相互作用,为根际生态系统调节机理及生产上科学施肥调控提供理论支持和参考。
1 材料方法
1.1 试验材料
以花育22号(HY22)为试验材料。供试土壤采用山东省花生研究所莱西试验站0~20 cm 表层土,其基本理化性质:土壤有机质含量12.37 g/kg,全氮1.63 g/kg,全磷(P2O5)0.91 g/kg,全钾(K2O)11.13 g/kg,水解氮(N)95.2 mg/kg,速效磷(P2O5)12.4 mg/kg,速效钾(K2O)112.2 mg/kg,土壤pH 7.2,土壤含水量8.97%。
1.2 试验设计
试验于山东省花生研究所试验站防雨干旱棚中进行,土壤风干、过筛(1 cm)后装入底部直径36 cm,高为26 cm 的塑料盆中,每盆装土18 kg。选取饱满均匀的种子,每盆播种7粒种子,播深均为3.5 cm,留5株长势一致的幼苗。
设对照(土壤相对含水量75%~80%,CK)、盐胁迫(含盐量1.5 g/kg NaCl下保持土壤相对含水量75%~80%,S)、中度干旱胁迫(土壤相对含水量45%~50%,D)和旱盐同时胁迫(1.5 g/kg NaCl+土壤相对含水量45%~50%,SD)4个处理,6次重复,随机排列。土壤水分和盐分控制均贯穿于花生全生育期。盐胁迫处理以NaCl形式于装盆前均匀混入土壤,土壤含水量采用质量法控制浇水量。
于饱果期以处理和重复为单位,采用多点混合采样法采集根际土壤样本。采集根际土壤样本时将植株小心地从盆中取出,去除根际附着不紧密的土壤,然后用无菌刷收集附着紧密的土壤,混合每盆中的植株根际土壤,每2盆根际土壤样品混合为1个生物学样本重复,每处理均获取3个生物学重复,封入无菌袋,置于冰盒带回实验室,保存于-80℃冰箱备用。相关测试工作由上海美吉生物医药科技有限公司完成,数据计算与制图均在美吉生物云平台进行。
1.3 土壤DNA 提取
收集所得土壤样品利用OMEGA土壤总DNA提取试剂(OMEGA soil DNA kit)盒进行提取。所得DNA 采用1.5%琼脂糖凝胶电泳和Nanodrop 2000分光光度计检测DNA的纯度和浓度。
1.4 16S rRNA 文库构建及高通量测序
稀释后的基因组DNA 利用引物340F:CCTACGGGNBGCASCAG 以及805R:GACTACNVGGGTATCTAATCC 对16S rRNA 基 因的V3~V4区进行扩增。扩增程序如下:95℃预变性3 min;30 个循环包括(95℃,30 s;50℃,30 s;72℃,60 s);72℃,7 min。PCR 产物使用1.5%浓度的琼脂糖凝胶进行电泳检测;根据PCR 产物浓度进行等浓度混样,充分混匀后使用0.5×TBE浓度1.5%的琼脂糖胶电泳纯化PCR 产物,割胶回收目标条带。产物纯化试剂盒使用的是QIAGEN 公司的MinElute胶回收试剂盒。最后使用HiSeq2500进行250PE测序。
1.5 生物信息学分析
对花生根际土壤微生物的多样性和丰富度进行Alpha多样性和样本间Beta多样性分析,同时进行群落结构统计分析和基于OTUs的物种组成聚类,分析挖掘样本间物种组成差异和生物功能分析。
2 结果分析
2.1 根际微生物群落测序数据分析
供试的12个样本共检测出细菌47个门、154个纲、352个目、555个科、1003个属和2024个种。获得有效序列257 154条,以干旱胁迫处理的有效序列数最大72 154.67条,CK 有效序列数最小,仅55 306.3条。样本序列长度在215.7~511.7 bp,但多数样本序列平均长度在414.4~415.5 bp之间(表1)。Venn图分析表明,CK、S、D、SD各处理中共有OTUs数2876个,单独存在于各处理中的分别为155、149、129和108个,其中S、D和SD三个处理共有OTUs数较高,为360个,而CK、D和SD三个处理共有OTUs数较少,为210个。表明各处理样本细菌组成相似,盐胁迫、干旱胁迫对花生根际土壤样本的物种组成影响不显著(图1)。

图1 不同处理花生土壤样本中OTU 数量维恩图Fig.1 Venn diagram representing the total numbers of OTUs in the soil samples of peanut under different treatments

表1 各处理花生根际微生物群落测序数据 (剔除可疑序列后)Table 1 Sequencing quantity of each sample after removing doubtful sequences
2.2 Alpha多样性分析
2.2.1 Rank-Abundance曲线和稀释曲线
Rank Abundance分析用于解释物种的均匀度和丰富度。稀释曲线反映各样本在不同测序数量时的微生物多样性,判断本次测序数据量是否足够。图2所示,各样本中物种OTU 数量以2000为分界点,小于2000时,曲线下降较为迅速、不平缓,表明样本中对应物种相对丰度较高而均匀度较低。当OTU 数量大于2000时曲线平缓,表明对应的物种在根际土壤样本中相对丰度较低,分布较均匀,不同样本之间的物种均匀度差异不大(图2左)。Shannoneven指数曲线显示,当各样本在测序量达到5000时,曲线趋于平缓,说明测序深度足够,结果覆盖所测样本中的所有物种(图2右)。
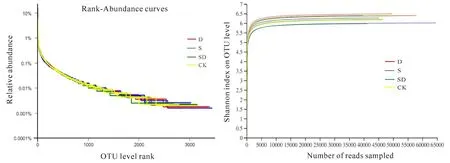
图2 Rank-Abundance曲线和稀释曲线Fig.2 Rank-Abundance curve and rarefaction curve
2.2.2 多样性指数分析
表2表明,无论是反映群落多样性(Community diversity)的Shannon、Simpson指数,反映群落均匀 度(Community evenness) 的Simpsoneven、Shannoneven指数,还是反映群落覆盖度(Community coverage)的coverage指数,其各处理间均无显著差异,仅干旱胁迫下的群落丰富度(Community richness)chao和ace指数与对照间表现出显著差异。说明干旱胁迫使花生根际细菌群落丰富度提高。
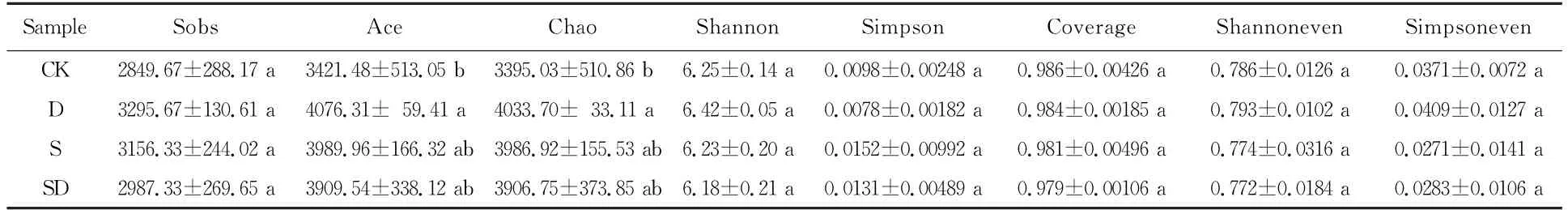
表2 各处理根际土壤样本Alpha多样性指数Table 2 Alpha diversity index of rhizosphere soil samples under the treatments
2.3 物种群落组成分析
2.3.1 门水平群落组成
门水平上,各处理样本重复间取均值且others合并<0.01、相对丰度值5.00%以上的为优势菌门。图3可见,各处理优势菌门均为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和拟杆菌门(Gemmatimonadota)。无论干旱胁迫还是盐胁迫均使优势菌门中变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)相对丰度降低,降幅分别为-7.73%~14.50%、6.20%~36.38%。干旱和盐胁迫均使花生根际非优势菌门蓝藻菌门(Cyanobacteria)的相对丰度较CK分别提高0.25倍和15.9倍,但干旱和盐同时胁迫则使其相对丰度降低60.0%。

图3 门水平各样本菌落结构柱状图Fig.3 Percentage of microbial community abundance at the phylum level in peanut rhizosphere
2.3.2 目水平群落组成
目水平上,各处理样本重复间取均值且others合并<0.025、相对丰度值在5.00%以上的为优势菌目。图4可见,各处理样本的优势菌目为微球菌目(Micrococcales)、Vicinamibacterales、丙酸杆菌目(Propionibacteriales)、根瘤菌目(Rhizobiales)、鞘脂单胞菌目(Sphingomonadales)和伯克氏菌目(Burkholderiales)。无论是干旱盐单独胁迫还是同时胁迫,Vicinamibacterales、根瘤菌目(Rhizobiales)和鞘脂单胞菌目(Sphingomonadales)的相对丰度均明显降低,三胁迫处理下的鞘脂单胞菌目(Sphingomonadales)较CK 降低均在40%以上,而丙酸杆菌目(Propionibacteriales)的相对丰度在干旱、盐及旱盐同时胁迫处理下均表现升高,升幅在5.38%~24.95%。非优势菌目蓝藻菌目(Cyanobacteriales)相对丰度在盐胁迫下极显著升高,较CK升高102.5 倍,而SD 处理则使小单孢菌目(Micromonosporales)相对丰度较CK提高3.3倍。
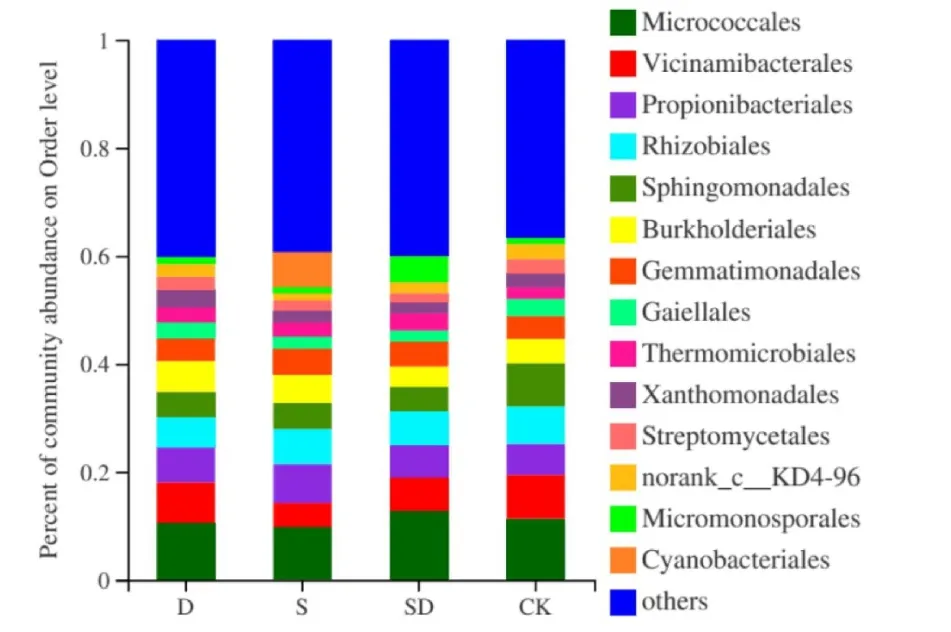
图4 目水平各样本菌落结构柱状图Fig.4 Percentage of microbial community abundance at the order level in peanut rhizosphere
2.4 Beta多样性分析
2.4.1 样本聚类分析和PLS-DA 分析
基于Weighted UniFrac距离,对所有样本进行层级聚类分析,结果表明,依照花生根际微生物物种组成可将样本划分为4个不同类群,干旱胁迫、盐胁迫、旱盐同时胁迫和对照各处理样本分别聚为一类,表明盐胁迫、干旱胁迫和旱盐同时胁迫处理下,花生根际细菌群落组成有明显不同(图5),即盐胁迫和干旱胁迫非生物胁迫因素影响花生根际细菌群落组成。
偏最小二乘法判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)结果表明,各处理样本可明显区分并分别聚成4个不同的类群,盐胁迫、干旱胁迫和旱盐双重胁迫均使花生根际细菌群落组成分异较大,盐胁迫和干旱胁迫均是影响花生根际细菌群落组成的重要因素(图5右)。
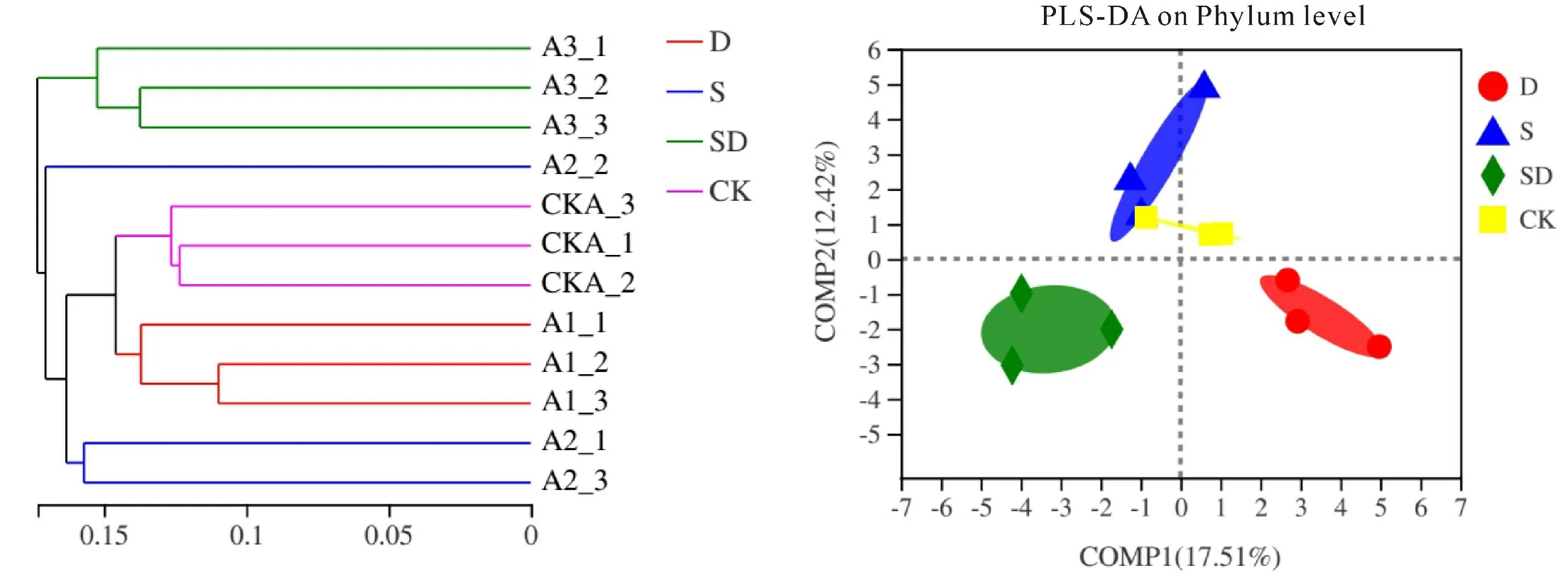
图5 Beta多样性分析Fig.5 Beta diversity analysis
2.4.2 PcoA 分析
PCoA 分 析(Principal co-ordinates analysis)即主坐标分析,可用来研究样本群落组成的相似性或差异性。基于unweighted unifrac距离的PCoA 分析(图6)表明,盐胁迫、旱盐双重胁迫和对照样本菌群组成差异不明显,而干旱胁迫处理样本与盐胁迫、旱盐双重胁迫及对照样本菌群间存在明显差异。相较于轻度盐胁迫,干旱胁迫对花生根际细菌群落组成有更大影响,说明花生根际细菌群落受根际微域环境的影响并随其变化而重新响应。

图6 PCoA 分析Fig.6 Principal co-ordinates analysis
2.5 物种差异分析
LEfSe采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小。通过LEfSe分析(LDA阈值为2)发现,不同胁迫处理显著影响的微生物类群,其样本富集的物种类型存在较大差异(图7)。与对照组、干旱胁迫处理组和盐胁迫处理组相比,旱盐同时胁迫处理的花生根际样本中富集更多的Symbiobacteriia、腈降解菌目(Nitriliruptorales)、Thalassobaculales等,干旱胁迫处理富集全噬菌纲(Holophagae)、Subgroup_7、Diplorickettsiales等,盐胁迫则使Kapabacteriales、Bradymonadales、未分类的蓝藻菌门(unclassified_p_Cyanobacteria)、未分类的变形菌门(unclassified_c_Alphaproteobacteria)等物种富集。旱盐同时胁迫处理和干旱胁迫处理均使得unclassified_c_Actinomarinales富集。

图7 LEfSe物种差异分析Fig.7 Species diversity analysis of LEfSe
2.6 16S功能预测
图8表明,干旱胁迫使花生根际细菌功能基因丰度值明显升高,旱盐同时胁迫则使其明显降低。干旱胁迫使各类功能基因丰度值均最大,而SD 处理下的各类功能基因丰度值均最低,并以能源生产与转化、氨基酸转运和代谢、碳水化合物的运输和代谢、转录和仅通用功能预测等5类功能基因丰度值升高明显,干旱胁迫下5类功能基因丰度值较CK 提高均在10%以上,旱盐同时胁迫处理的5类功能基因丰度值较CK 均降低10%以上,且降幅最大的无机离子的运输与代谢类达15.69%。这与花生具有较强抗旱能力有关,但重度干旱对花生根际微生物功能基因的影响有待深入研究。轻度盐胁迫条件下,除次生代谢产物的生物合成、转运和分解代谢丰度稍有降低外,其余类功能基因丰度均略有升高。适度的盐胁迫对作物生长的促进作用有待深入研究。
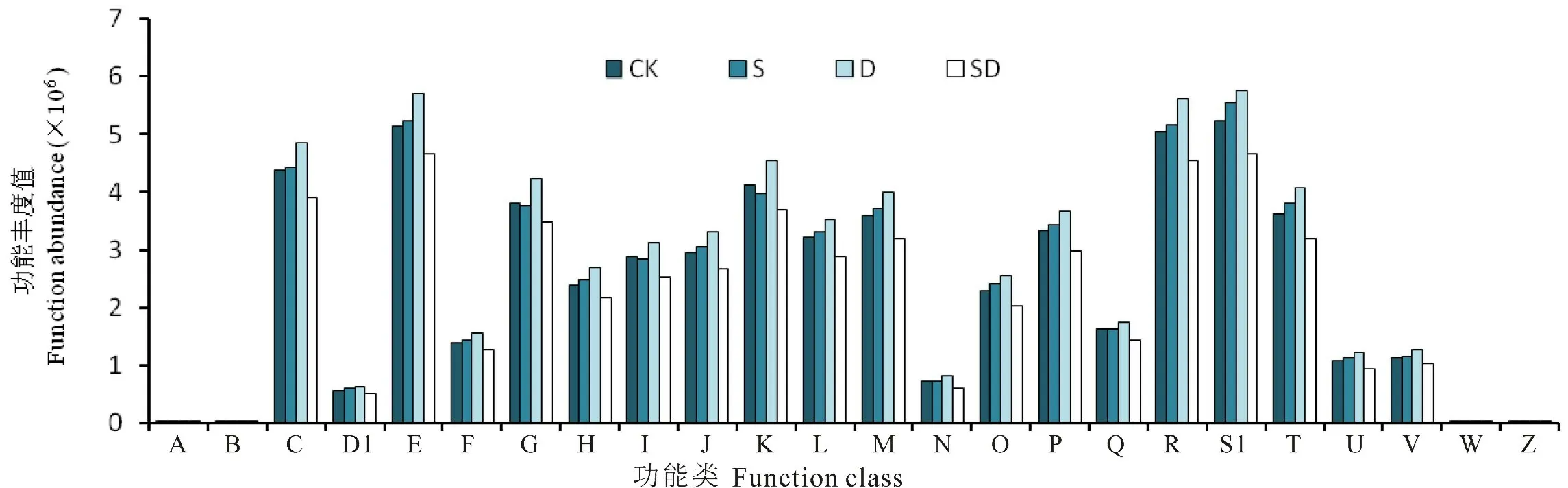
图8 土壤微生物菌群功能预测Fig.8 Prediction on the microbial functional features of Orthologous Groups (COG)
3 讨论与结论
土壤微生物与环境间的关系极为复杂,不仅受土壤性质、周围非生物因素等环境条件的制约,还受植物种类、自身生物特性的影响[17]。土壤微生物在干旱、盐渍化的恶劣环境中,须缓解各种非生物胁迫以生存定殖[18-19]。已有研究证实,土壤水盐条件对根际土壤微生物活性有显著影响,其中水分含量与微生物活性呈正相关,盐分含量与微生物活性呈负相关[20-21]。当盐胁迫强度低于1.5 g/kg时,干旱胁迫对花生根际细菌群落组成有更大影响。也有研究结果认为,干旱对土壤微生物的多样性影响不大,但是对群落组成有显著影响[22-25]。干旱条件对细菌群落的影响强于根际。荒漠干旱植物小叶锦鸡儿根际土壤细菌群落主要由Firmicutes、Actinobacteria、Proteobacteria、Acidobacteria、Chloroflexi、Bacteroidetes 和Planctomycetes 构成,Lactococcus、Bacillus、Pseudarthrobacter、Solibacillus和Pseudomonas为优势属[17],干旱胁迫使Proteobacteria、Planctomycetes 和Acidobacteria丰度和数量降低[26]。驱动根际土壤微生物群落季节性分布的关键因子是季节变化引起的土壤养分、含水率和温度变化[17,27]。
对黄河三角洲盐碱地不同植物类型和土地利用方式下根际土壤微生物群落组成研究结果表明,根际微生物优势菌门相同,均为变形菌门、放线菌门、酸杆菌门、拟杆菌门、绿弯菌门和芽单胞菌门为优势物种[28-30]。中度耐盐植物根际环境中含有较多的变形菌门和厚壁菌门细菌,轻度耐盐植物根际环境中含有较多的酸杆菌门和芽单胞菌门细菌[29]。控制条件下的2.0 g/mg NaCl盐胁迫和中度干旱胁迫强度下,花生根际土壤微生物群落均以变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、Saccharibacteria、绿弯菌门(Chloroflexi)和蓝藻菌门(Cyanobacteria)等6 种菌门为主[31]。干旱和盐胁迫均不同程度地降低了变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的相对丰度,但显著提高了蓝藻菌门(Cyanobacteria)的含量[31]。
本试验条件下,干旱胁迫、盐胁迫及二者同时胁迫处理的优势菌门均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Gemmatimonadota)。干旱胁迫和盐胁迫均使得变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)相对丰度降低,而蓝藻菌门(Cyanobacteria)的相对丰度提高,但在干旱和盐同时胁迫条件下蓝藻菌门(Cyanobacteria)的相对丰度降幅达60.0%。具有较强固氮能力的蓝藻门细菌丰度的提高可能对花生抵御旱盐逆境具有重要作用。可见,不同类型、不同成因的盐碱土壤或人工模拟盐碱胁迫条件,其植物根际微生物在门和纲水平的优势菌群差异不大,变形菌门、放线菌门、酸杆菌门、拟杆菌门、绿弯菌门和芽单胞菌门为优势物种,但在属和种水平上物种差异较大,尤其是“未分类(unclassified)”和“没有明确的分类信息或分类名称(norank)”的物种差异较大。这就为特异功能物种和菌株的分离提供了更大的可能和空间,为促生菌的分离培养优化和应用提供了技术基础和前景。
土壤微生物功能预测分析显示,信号转导机制、防御机制及翻译后修饰、蛋白质转换和分子伴侣等相关功能在旱盐双重胁迫中活性更强[31]。膜转运(Membrane transport)、氨基酸代谢(Aminoacids metabolism)和碳水化合物代谢(Carbohydrate metabolism)是沙地榆根际细菌群落中主要的代谢功能群[27]。本试验条件下,干旱胁迫使花生根际细菌功能基因丰度值明显升高,旱盐同时胁迫则使其明显降低,并以能源生产与转化、氨基酸转运和代谢、碳水化合物的运输和代谢、转录和仅通用功能预测等5类功能基因丰度值升高明显;轻度盐胁迫条件下,次生代谢产物的生物合成、转运和分解代谢功能群丰度稍有降低,其余类功能基因丰度均略有升高。适度盐胁迫对作物生长的作用机制有待深入研究。
因此,建议今后丰富根际微环境研究对象的多样性,综合分析不同影响因子之间的内在关系的基础上,运用新技术、新方法从基因水平对根际微环境信号传递和基因定位等热点问题进行系统研究,为进一步完善根际微生态系统作用机制和提高作物抗逆性提供理论支撑。
