一株花生白绢病菌拮抗细菌的筛选、鉴定及发酵液中活性物质稳定性研究
2021-08-30李亮亮雷高李磊岳丹丹甄静王继雯
李亮亮雷 高李 磊岳丹丹甄 静王继雯
(河南省科学院生物研究所有限责任公司/河南省微生物工程重点实验室,河南 郑州 450008)
花生(ArachishypogaeaLinn.)是全球范围内最重要的油料作物之一,有很高的食用价值和经济价值,在我国的种植历史已有上百年[1]。近年来,随着我国花生种植面积的急剧扩大,以及连作重茬现象日益加剧,导致病害逐年加重。特别是花生白绢病的发生,对我国花生产业造成严重损失。花生白绢病(Southern blight)是世界范围内花生上发生的一种重要的枯萎型真菌病害,已经对美国、阿根廷、印度、日本等国家的花生产业造成了巨大的经济损失[2-5],该病病原菌的无性世代是半知菌亚门齐整小核菌(SclerotiumrolfsiiSacc.)有性世代为罗氏阿太菌(Atheliarolfsii)[6]。该病菌寄主范围广泛,能侵染花生、辣椒、油茶、白术等植物,是一种危害严重的土传真菌[7-10]。
目前对花生白绢病的防治方法主要包括轮作、培育抗性品种以及使用化学药剂,但防治效果都不理想。同时化学药物的大量使用不仅污染环境、破坏生态平衡,而且使病原菌逐渐产生了抗药性,所以科研人员开始研究对花生白绢病的生物防治方法。白绢病生防真菌方面,席亚东等[11]用绿色木霉防治白绢病,防效可达70%左右。杜婵娟等[12]发现使用木霉菌剂或木霉粉剂对白绢病均有一定的防治效果,进一步研究发现木霉菌株对白绢病菌菌丝的扩展有一定的拮抗作用,主要表现为菌丝畸形,菌核不能正常形成。
与真菌相比,细菌具有培养简单、生长繁殖速度快等特点,因此生防细菌在生防微生物的研究中占有重要地位。目前已报道的防治花生白绢病的生防细菌种类主要有解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(B.subtilis)、荧光假单胞菌(Pseudomonasfluorescens)等[13-15]。近年也有学者发现放线菌对白绢病有较好的生防作用[16]。但关于白绢病菌的研究报道和生防菌种还十分有限,亟待进一步研究。本文以实验室保存的4株细菌为研究对象,筛选对花生白绢病菌具有高效拮抗活性的菌株,对筛选出的菌株进行鉴定,并对拮抗菌株发酵液中活性物质的稳定性进行了研究。
1 材料与方法
1.1 供试菌株
花生白绢病菌(Sclerotiumrolfsii)RS-1分离自河南省汝南县花生病株。供试菌株WS2-1、WS3-1、WS3-2和nkkc由河南省微生物工程重点实验室提供。
1.2 供试培养基
NA 培养基:蛋白胨10 g,氯化钠5 g,牛肉膏3 g,琼脂粉20 g,蒸馏水1000 mL,pH 7.2~7.4。
NB培养基:蛋白胨10 g,氯化钠5 g,牛肉膏3 g,蒸馏水1000 mL,pH 7.2~7.4。
PDA 培养基:200 g新鲜马铃薯去皮煮汁,葡萄糖 20 g,琼脂粉20 g,蒸馏水1000 mL。
1.3 拮抗细菌的筛选
1.3.1 平板对峙试验
将经NA 培养基活化的4株待测细菌分别划线接种于PDA 平板两侧,再将直径5 mm 的花生白绢病菌PDA 平板培养物点接于平板中间。以只接病原菌的PDA 平板为对照,每处理3个重复。置于25℃培养箱内培养,待对照接近长满整个平板时观察不同细菌对病原菌的拮抗效果。
1.3.2 细菌发酵滤液对病原菌生长的影响
将4株待测细菌接入含100 mL NB液体培养基的三角瓶中于30℃、200 r/min条件下摇培,将摇培3 d后的细菌发酵液于10000 r/min、4℃条件下离心20 min,再用滤膜孔径为0.22 μm 的细菌过滤器将菌体过滤,所得的滤液即为无菌发酵滤液。将发酵滤液分别稀释2 倍、4 倍后,按照滤液:PDA 为1:4的比例混合,制成带毒平板,然后将活化好的5 mm 病原真菌菌饼点接于平板中央。以不接菌的NB液体培养基代替无菌发酵滤液为对照。每个处理设置3个重复,25℃恒温培养箱中培养。待对照长满整个平板时,计算细菌发酵滤液原液、2倍和4倍稀释液对花生白绢病菌的抑菌率。计算公式如下:

1.4 拮抗细菌WS3-1对白绢病菌菌丝生长及菌核形成的影响
将筛选的拮抗菌株WS3-1接入含100 mL NB液体培养基的三角瓶中于30℃、200 r/min条件下摇培24 h,备用。将活化好的直径5 mm 白绢病菌菌饼接种到PDA 固体平板中央,在距离平板中央3.5 cm 处打孔,向孔内加入20 μL活化的WS3-1菌液,对照孔里加入20 μL 的无菌液体培养基。30℃培养3 d后,观察菌株WS3-1对花生白绢病菌的抑制作用。挑取白绢病菌的菌落边缘菌丝于空白PDA培养基上培养,同时在光学显微镜下镜检。继续培养15 d后,记录产生的菌核数量。
1.5 拮抗细菌的鉴定
1.5.1 形态特征和生理生化特征测定
拮抗细菌WS3-1的形态特征和生理生化特征测定按照参考文献《微生物学实验技术教程》[17]和《常见细菌系统鉴定手册》[18]的方法进行。
1.5.2 分子生物学鉴定
利用16S rDNA 和gyrB基因对拮抗菌株WS3-1进行分子生物学鉴定。提取拮抗细菌WS3-1的基因组DNA[19],分别用细菌16S rDNA 和gyrB的引物进行PCR扩增。16S rDNA引物序列为:27f:5'-AGAGTTTGATCCTGGCTCA-3';1492r:5'-GGTTACCTTGTTACGACTT-3'[20],PCR 扩增条件为94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1.5 min,33个循环;72℃延伸10 min。gyrB简并引物序列为UP-1:5'-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3';UP-2r:5'-AGCAGG GTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3'[21],PCR 扩增条件为94℃、4 min;94℃、1 min,60℃、1 min,72℃、2 min,33个循环;72℃、10 min。
扩增产物经1%琼脂糖凝胶检测后,交由华大基因测序。将获得的16S rDNA 和gyrB基因序列在NCBI网站上用BLAST 程序进行同源性比对,并用MEGA 6.05 软件对16S rDNA 与gyrB线性拼接序列进行联合建树。
1.6 WS3-1抗菌物质稳定性测定
1.6.1 热稳定性试验
将拮抗细菌WS3-1的无菌发酵滤液分别在40、60、80、100℃水浴锅中处理1 h,在121℃条件下处理20 min。待降至室温后,按照1.3.2的方法测定滤液原液对白绢病菌的抑菌活性。以经相应温度处理的NB液体培养基代替发酵滤液作对照,每个处理3次重复。
1.6.2 pH 稳定性试验
用1 mol/L 的NaOH 和HCl将WS3-1发酵滤液的pH 分别调至3.0~10.0。然后将调至不同pH 的发酵滤液置于4℃过夜后,于8000 r/min离心20 min取上清。按照1.3.2的方法测定各上清液对白绢病菌的抑菌活性。得到的沉淀被原体积的蒸馏水溶解后(pH=8.5),同样方法检测抑菌活性。以相应pH 的NB液体培养基代替发酵滤液为对照,每个处理重复3次。
1.6.3 紫外线稳定性试验
将待测WS3-1发酵滤液置于紫外灯下照射。照射条件为波长254 nm,功率36 w,高度25 cm,照射时间为1,2,4,8,16 h。照射完毕后,按照1.3.2的方法测定滤液原液对白绢病菌的抑菌活性。以经紫外灯照射相应时长的NB液体培养基代替发酵滤液为对照,每个处理重复3次。
2 结果与分析
2.1 白绢病拮抗细菌的筛选
2.1.1 平板对峙试验
通过平板对峙法检测4株细菌对白绢病菌的拮抗作用,图1可知,菌株WS3-1和WS2-1对白绢病菌的抑制作用最强,抑菌带最宽。菌株nkkc的抑制效果次之,菌株WS3-2对病菌的抑制效果最差。同时还发现经菌株WS3-1和WS2-1拮抗的病菌菌丝稀疏,挑取菌落边缘的菌丝于PDA培养基上培养,不能正常生长。

图1 花生白绢病拮抗细菌的筛选Fig.1 Screening of antagonistic bacteria against Sclerotiumr olfsii
2.1.2 细菌发酵滤液对病原菌生长的影响
表1可知,4株细菌发酵滤液对病原菌均有一定的抑菌活性,随着稀释倍数升高,抑菌活性逐渐下降。菌株WS3-1对白绢病菌的抑制效果最好,与其他3株细菌相比,其滤液原液、2倍和4倍稀释滤液对病菌的抑制率都是最高,分别为95.04%、71.66%和30.64%。结合平板对峙试验的结果,选取菌株WS3-1进行下一步试验。

表1 细菌发酵滤液对花生白绢病菌的抑制作用Table 1 Antagonism by bacterial fermentation filtrate against Sclerotiumr olfsii
2.2 拮抗细菌WS3-1对白绢病菌菌丝生长及菌核形成的影响
试验结果显示,白绢病菌菌丝经菌株WS3-1处理后菌丝形态出现异常,拮抗效果较为明显,表现为菌丝肿胀变粗、交叉缠结,菌丝顶端膨大畸形(图2)。继续培养15 d后,对产生的菌核进行计数。结果表明,经WS3-1处理的白绢病菌产生的菌核数量为37粒,明显少于对照平板产生的94粒菌核数量,表明菌株WS3-1可以抑制白绢病菌菌核的产生。
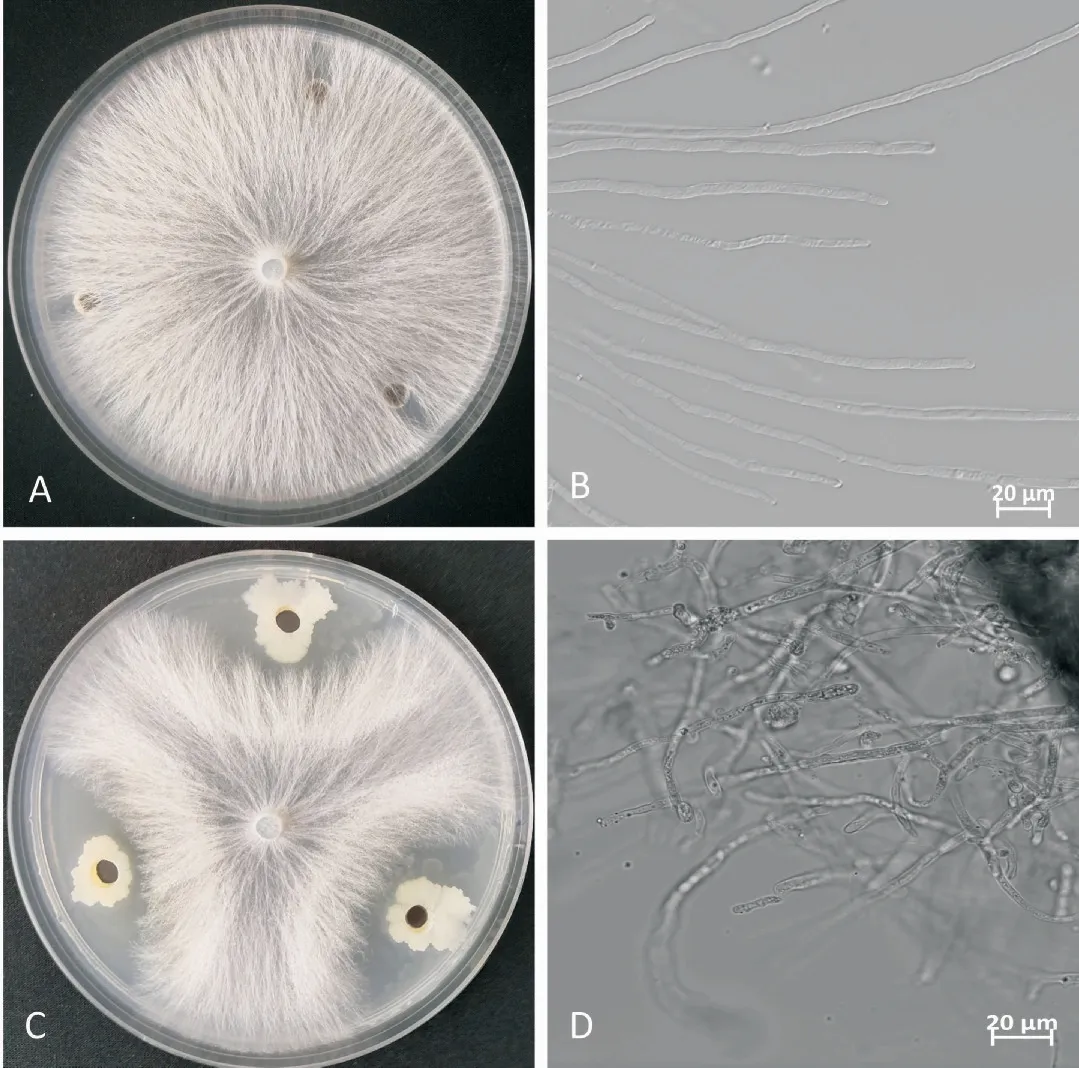
图2 菌株WS3-1对白绢病菌的抑制效应Fig.2 Inhibition effect of strain WS3-1 against Sclerotiumr olfsii
2.3 拮抗细菌的鉴定
2.3.1 形态特征和生理生化特征测定
菌株WS3-1在NA 培养基上培养48 h,菌落呈圆形,稍微隆起,颜色为淡乳白色,不透明,表面较粗糙。细胞杆状,革兰氏染色阳性(图3),芽孢卵圆形,中生。菌株WS3-1的生理生化特征结果见表2。结合形态特征和生理生化特征,菌株WS3-1符合解淀粉芽孢杆菌Bacillusamyloliquefaciens特性。
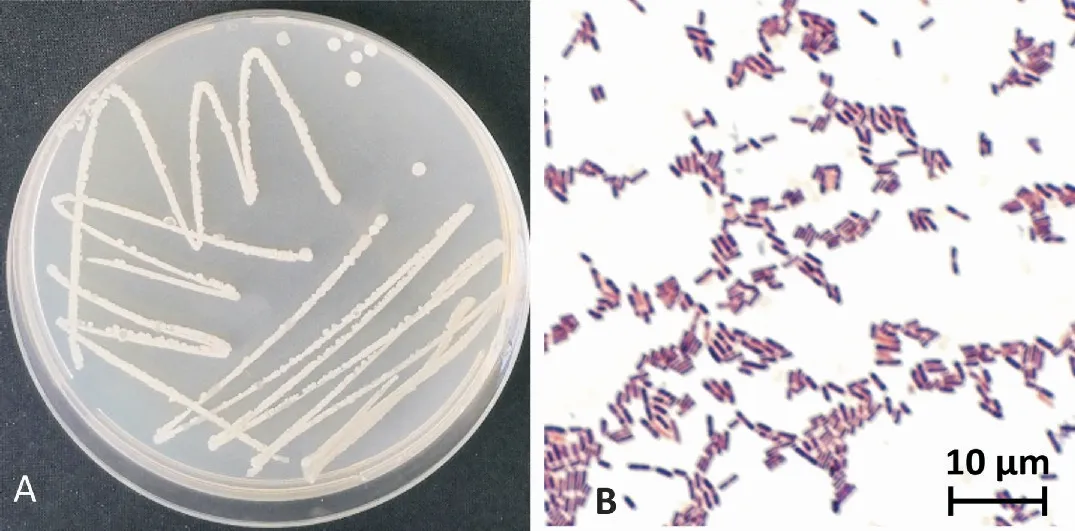
图3 菌株WS3-1的形态特征Fig.3 Morphological characteristics of strain WS3-1

表2 拮抗细菌WS3-1的生理生化特性Table 2 Physiological and biochemical characteristics of strain WS3-1
2.3.2 分子生物学鉴定
对菌株WS3-1的16S rDNA和gyrB序列进行测序,基因序列片段长度分别为1450 bp和1164 bp。将测得的序列提交至GenBank,获得登录号分别为MT579842和MW045314。将WS3-1的16S rDNA和gyrB序列分别与 GenBank 中的序列进行BLAST比对,发现与菌株WS3-1相似性最高的是Bacillusamyloliquefaciens,相似度均达99%以上。将比对获得的同源序列和测定序列进行同源性分析,利用MEGA6.05软件对16S rDNA与gyrB序列进行联合建树(图4)。图4可看出,菌株WS3-1与BacillusamyloliquefaciensBCRC14193 和BacillussiamensisKCTC13613同属一个遗传分枝,亲缘关系十分接近。在BLAST 比对过程中,菌株WS3-1的16S rDNA 序列与Bacillusamyloliquefa-ciensBCRC14193的相似度为99.51%,与Bacillus siamensisKCTC13613 的相似度为99.44%,两者非常接近,所以仅依靠16S rDNA 序列难以区分亲缘关系接近的菌种。而菌株WS3-1的gyrB序列与BacillusamyloliquefaciensBCRC14193和BacillussiamensisKCTC13613 的相似度有较大差别,分别为99.40%和96.22%,具有很好的区分性。同时结合细菌的形态特征和生理生化特征,最终将菌株WS3-1鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。

图4 基于16S rDNA 和gyrB 序列构建的菌株WS3-1系统发育树Fig.4 Phylogenetic tree based on sequences of 16S rDNA and gyrB of strain WS3-1
2.4 WS3-1抗菌物质稳定性测定
2.4.1 热稳定性测定
菌株WS3-1发酵滤液经不同温度处理后的抑菌活性如图5所示。由结果可知WS3-1发酵滤液经40℃、60℃、80℃条件下处理1 h后,其对花生白绢病菌的抑菌率均在90%以上,与未经处理(25℃)的发酵液的抑菌活性没有显著差异。当温度升高到100℃和120℃后,抑菌活性仍达到42.09%和31.92%,说明WS3-1发酵滤液中含有耐高温的抗菌物质。

图5 温度对菌株WS3-1抑菌活性的影响Fig.5 Influence of temperature on antifungal activity of strain WS3-1
2.4.2 pH 稳定性
菌株WS3-1发酵滤液经不同pH 处理后,得到的上清和沉淀的抑菌活性如表3所示。在pH为7~10的条件下,菌株WS3-1对白绢病菌的抑菌率均在84%以上,抑菌活性稳定,不产生沉淀,说明WS3-1发酵滤液中的抑菌物质受碱性条件影响较小,在碱性条件下可以稳定存在。当pH<7时,发酵滤液开始产生沉淀,随着pH 的下降,上清液的抑菌活性逐渐降低,产生沉淀的抑菌活性逐渐升高。当pH=3时,沉淀的抑菌率达到78.42%,而上清液的抑菌活性只有18.61%,说明在酸性条件下WS3-1发酵滤液中的抑菌物质会出现沉淀现象。

表3 pH 对菌株WS3-1抑菌活性的影响Table 3 Influence of pH on antifungal activity of strain WS3-1
2.4.3 紫外线稳定性
菌株WS3-1经紫外线处理后的抑菌活性如图6所示。随着紫外线照射时间的增加,菌株WS3-1的抑菌活性逐渐下降,但变化不明显。照射16 h 后,抑菌率仍达到72.07%,说明菌株WS3-1发酵滤液中的抑菌物质具有较好的抗紫外线分解能力。

图6 紫外照射对菌株WS3-1抑菌活性的影响Fig.6 Influence of ultraviolet on antifungal activity of strain WS3-1
3 结论与讨论
芽孢杆菌是一类好氧、能产生内生芽孢的革兰氏阳性细菌,广泛存在于土壤、水源和植物根际中,同时也是常见的植物内生细菌。研究表明,芽孢杆菌对植物不仅具有促生作用,还具有内生固氮和防治病害等多方面的生物学作用[22-23]。由于芽孢杆菌对人畜无害,对生态环境友好,同时自身具有较强的抗逆性,因此是目前极有开发应用前景的一类生防菌。本文通过平板对峙试验和菌丝生长速率法筛选到一株对花生白绢病菌具有拮抗活性的细菌菌株WS3-1,该菌发酵滤液原液对白绢病菌菌丝的生长抑制率达到95.04%,同时还可抑制病菌菌核的产生。利用细菌形态特征、生理生化特征及16S rDNA 和gyrB序列联合分析,将该菌株鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。解淀粉芽孢杆菌是一种重要的生防细菌,具有较广的抑菌谱,能够防治多种真菌和细菌类病害。邓建良等[24]从果园土壤中分离到一株解淀粉芽孢杆菌YN-1,该菌的抑菌谱广泛,对包括丝核菌和镰刀菌在内的多种病原菌都有较好的拮抗作用。蒋凯丽等[25]从圣女果中分离到一株解淀粉芽孢杆菌KL-1,经研究菌株KL-1对极细链格孢菌、黑曲霉、青霉菌和胶孢炭疽菌等多种病原菌都有明显的抑制作用,抑菌谱广泛。
微生物的次级代谢产物是极其复杂的,代谢产物中活性物质的稳定性对活性物质的提取、生产应用都起着至关重要的影响。本文研究了菌株WS3-1次级代谢产物中活性物质的稳定性,发现活性物质经40℃、60℃、80℃处理后活性稳定,抑菌率保持在90%以上,但当温度升到100℃和120℃后抑菌活性迅速下降,说明菌株WS3-1产生的活性物质中含有不耐高温物质,可能是某种蛋白酶类物质。宋利沙等[26]对分离自肿节风体内的一株内生解淀粉芽孢杆菌进行研究,发现该菌株可产生几丁质酶、纤维素酶和蛋白酶等多种抗菌活性物质,这些酶类可单独或协同作用使病菌菌丝顶端膨大畸形,导致菌丝不能正常生长。这与本研究筛选的解淀粉芽孢杆菌WS3-1可促使白绢病菌菌丝畸形和死亡的结果相一致,推测菌株WS3-1也可产生上述酶类物质破坏菌丝细胞结构从而抑制病菌的生长。菌株WS3-1发酵滤液经121℃处理20 min后仍具有一定的抑菌活性,抑菌率为31.92%,说明WS3-1产生的活性物质中还包含部分耐高温成分。同时WS3-1发酵滤液经酸处理后上清液抑菌活性迅速下降,活性物质出现了酸沉现象,推测菌株WS3-1活性物质中的耐高温成分是一种脂肽类物质。王宝等[27]研究了一株解淀粉芽孢杆菌BEB33对香蕉枯萎病菌的生防作用,发现菌株BEB33发酵产生的脂肽类物质可以引起病菌菌丝细胞膨大、细胞膜穿孔,从而抑制病原菌的生长。对于菌株WS3-1在发酵过程中产生的酶类和脂肽类物质,我们将在接下来的试验中进一步研究。
