牛流行热病毒山东分离株α3基因序列分析及原核表达与纯化
2021-08-30朱鸿超何畅侯佩莉王洪梅李雪漫唐文娟何洪彬
朱鸿超,何畅,侯佩莉,王洪梅,李雪漫,唐文娟,何洪彬
(1.山东师范大学生命科学学院/反刍动物疾病研究中心,山东 济南 250014;2.山东师范大学附属中学国际部,山东 济南 250014)
牛流行热病(bovine ephemeral fever,BEF)是一种通过空气、同槽、节肢动物(主要是蚊子)引起动物牛(黄牛、水牛和乳牛)的急性热性传染病[1-3],其特征为突然高烧,呼吸道、消化道严重的卡他性炎症以及运动障碍。该病多发生在6—9月份,流行面广、传播速度快、病势猛,尤其是高温多雨时发病率极高,短期内可使任何品种、性别、年龄的大批牛只黏膜化脓、奶量降低、瘫痪以及死亡,具有发病率、死亡率高等特点,给养牛业造成巨大的经济损失。目前在亚洲(中国的28个省)、非洲和大洋洲的40多个国家发现有BEF的广泛流行传播,防控牛流行热病已成为中国畜牧业的重中之重[4]。
牛流行热病病原为牛流行热病毒(bovine ephemeral fever virus,BEFV)[5]。该病毒为弹状病毒科、牛流行热病毒属的单股负链RNA病毒,只有一个血清型,病毒粒子主要存在于病牛呼吸道分泌物、血液及粪便中。该病毒基因组大小约为14.9 Kb,编码5个典型的弹状病毒结构蛋白(N、P、M、G和L)和6个非结构蛋白(Gns、α1、α2、α3、β和γ)[6,7]。其中α3蛋白是牛流行热病毒基因组编码的一个非结构蛋白,其功能报道较少[8]。
目前尚未有牛流行热病商品化诊断试剂盒,已上市批准的牛流行热病毒疫苗种类较少且单一[9-13]。因此本研究旨在通过生物信息学分析α3蛋白相关特征,构建pGEX-4T-1-α3原核表达载体,表达并纯化此蛋白,为进一步制备α3多克隆抗体、建立相关的血清学检测方法、研制高效准确的诊断试剂和新型疫苗等提供理论基础。
1 材料与方法
1.1 试验材料
病毒RNA提取试剂盒购自成都福际生物技术有限公司;反转录试剂盒购自Thermo Fisher;BEFV山东分离株、pGEX-4T-1载体为本实验室保存;2×Phata max master mix、胶回收试剂盒购自南京诺唯赞生物科技股份有限公司;rTaq聚合酶购自天根生化科技(北京)有限公司;Ex taq聚合酶、T4 DNA连接酶、限制性内切酶BamHⅠ/XhoⅠ、DNA Marker购自TaKaRa公司;大肠杆菌DH5α感受态、大肠杆菌BL21感受态购自北京全式金生物技术有限公司;氨苄青霉素、IPTG诱导剂、胰蛋白酶抑制剂、胃蛋白酶抑制剂、咪唑、0.45 μm PVDV膜、5×SDS上样缓冲液为Solarbio公司产品;电泳液(5×)、转膜液(10×)、TBST(10×)购自上海雅酶生物科技有限公司;GST抗体购自Abways公司。
1.2 试验方法
1.2.1 BEFVα3基因的扩增 根据BEFV山东分离株α3的基因序列,利用Primer 5.0软件进行引物设计(表1)。引物由青岛擎科生物科技有限公司合成。

表1 引物序列
按试剂说明书提取BEFV的全基因组并反转录成cDNA,以其为模板采用PCR扩增α3基因片段。反应体系(50μL):18μL ddH2O,3μL cDNA模板,25μL 2×Phata max master mix,2μL(10 μmol/L)上游引物,2μL(10μmol/L)下游引物。扩增条件:95℃3 min;95℃15 s,60℃15 s,72℃30 s,共35个循环;72℃5 min。将符合预期的琼脂糖凝胶电泳条带进行回收[14]。回收产物连接pEASY-T载体,挑取单克隆菌落,送青岛擎科生物技术有限公司测序。
1.2.2 α3序列同源性分析 从GenBank中查找到3株来自中国和1株来自泰国的BEFVα3参考序列(表2)。使用DNAStar中的MegAlign将BEFV山东分离株α3基因与参考毒株信息进行核苷酸序列和氨基酸序列同源性比对分析[15]。

表2 参考毒株信息
1.2.3 生物信息学分析 测序获得牛流行热病毒山东分离株α3蛋白完整的基因序列,利用ProtParam 软件和抗原表位分析软件(Immune Epitope Database Analysis Resource,http://tools.immuneepitope.org/bcell/)中 的Bepipred Linear Epitope方法预测氨基酸水平的B细胞线性表位及亲水性关系,以确定α3蛋白是否为亲水性的可溶性蛋白[16]。
1.2.4 原核表达载体pGEX-4T-1-α3的构建采用BamHⅠ/XhoⅠ分别双酶切pGEX-4T-1载体和α3基因序列。酶切目的基因α3的体系为:BamHⅠ3μL,XhoⅠ3μL,10×Fast Green Buffer 5μL,胶回收后的α3基因39μL,37℃;酶切载体的体系为:BamHⅠ3μL,XhoⅠ3μL,10×Fast Green Buffer 5μL,pGEX-4T-1载体4 μL,ddH2O 35μL,37℃。采用2%的琼脂糖凝胶电泳进行酶切鉴定。用T4 DNA连接酶将α3基因序列与pGEX-4T-1载体连接。连接体系为:T4 DNA ligase 0.8μL,5×T4 DNA ligase Buffer 2 μL,pGEX-4T-1载体2μL,α3基因4μL,ddH2O 1.2μL,25℃连接15 min。将连接的重组质粒pGEX-4T-1-α3转化DH5α,而后在有氨苄抗性的LB固体培养基上涂板,待长出菌落后挑取单克隆放入含有氨苄的LB液体培养基中,37℃摇床培养8 h后交由擎科生物科技有限公司测序,测序正确的克隆提取质粒-20℃保存备用。
1.2.5 α3重组蛋白的诱导表达及产物纯化 将测序正确的重组质粒pGEX-4T-1-α3转化至大肠杆菌BL21感受态,接种到含有氨苄固体LB培养基上,长出菌落后挑取单克隆菌落到液体LB培养基中,振荡培养12~14 h后保存菌液。取pGEX-4T-1-α3重组菌液2 mL加入到200 mL液体LB培养基中,37℃、200 r/min振荡培养至菌液OD600值为0.4~0.6时,加入200μL IPTG诱导4 h,同时设置空载体pGEX-4T-1作为对照。菌液离心后将沉淀的菌体用NPI-10重悬,随后进行超声破碎(350 W,工作5 s,停止5 s,超声破碎1 h),12 000 r/min离心10 min,取出上清加入GST磁珠,在旋转摇床上结合过夜,用NPI-20冲洗结合蛋白的GST磁珠5次,每次5 min,将洗杂完的磁珠转入纯化柱中,分装3个1 mL的离心管收集α3蛋白。将菌液超声后的上清、纯化的α3融合GST、GST空载的菌液超声后的上清和纯化的GST磁珠进行SDS-PAGE电泳(150 V,1 h),电泳结束后加入10 mL的考马斯亮蓝染液,放入孵育摇床上4 h后观察蛋白表达情况。
1.2.6 Western Blot鉴定α3重组蛋白 通过Bio-Rad湿转电泳仪(220 mA,160 min)冰浴条件下将空载体表达GST纯化蛋白和α3融合GST纯化蛋白进行SDS-PAGE电泳,胶分离后将其转移到PVDF膜上。转膜后放入10 mL含5%脱脂奶粉溶液中,室温条件下封闭2 h后弃去封闭液,重新加入GST的单克隆抗体血清,室温孵育2 h后弃去一抗,用PBST洗涤3次,每次5 min,然后加入1∶2 000稀释的HRP标记的羊抗兔IgG二抗,室温孵育2 h,再用PBST洗涤3次,每次5 min。最后滴加ECL发光液进行显色,并用化学发光检测仪进行观察。
2 结果与分析
2.1 α3基因的PCR扩增
以BEFV的cDNA为模板,采用特异性引物α3-F和α3-R进行PCR扩增,结果如图1所示,扩增条带156 bp,与预期的α3基因大小一致。连接T载体后进行基因测序,序列与参考基因的序列一致。
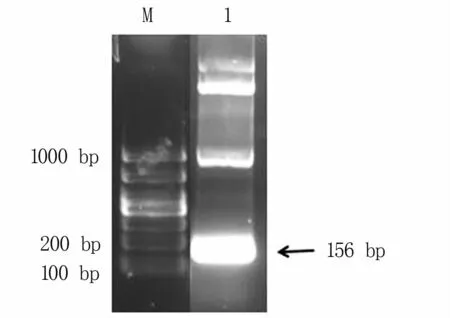
图1 RT-PCR扩增α3基因片段电泳图
2.2 α3序列的同源性分析
测序比对结果表明,从山东分离株上克隆的α3基因片段长度为156 bp,编码51个氨基酸。该基因核苷酸序列与参考毒株的同源性为98.0%~100.0%,氨基酸的同源性也为98.0%~100.0%(表3)。表明α3蛋白具有较高的保守性。
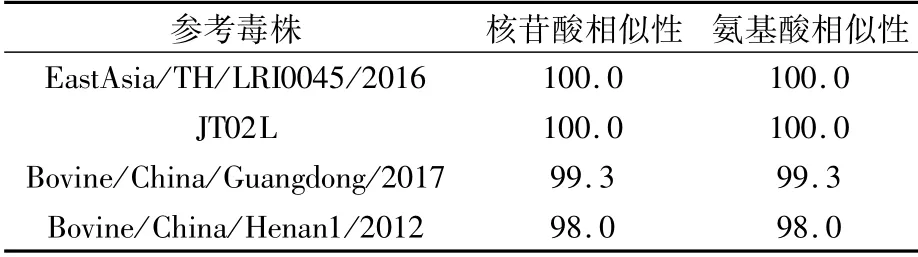
表3 BEFV山东分离株与参考毒株的α3序列同源性分析(%)
2.3 α3蛋白结构和功能分析
根据ProtParam软件预测,α3蛋白的理论等电点为9.23,不稳定系数为48.73,总平均疏水性为-0.737,说明α3是一个可溶性蛋白。
根据蛋白抗原表位分析α3蛋白B细胞线性表位结果表明,α3蛋白包含5个线性表位,其中区段3~5 aa、9~47 aa是α3蛋白的优势抗原表位区段(图2)。明确α3蛋白的线性表位区段,为获得特异性的抗原区段提供了较好的依据。
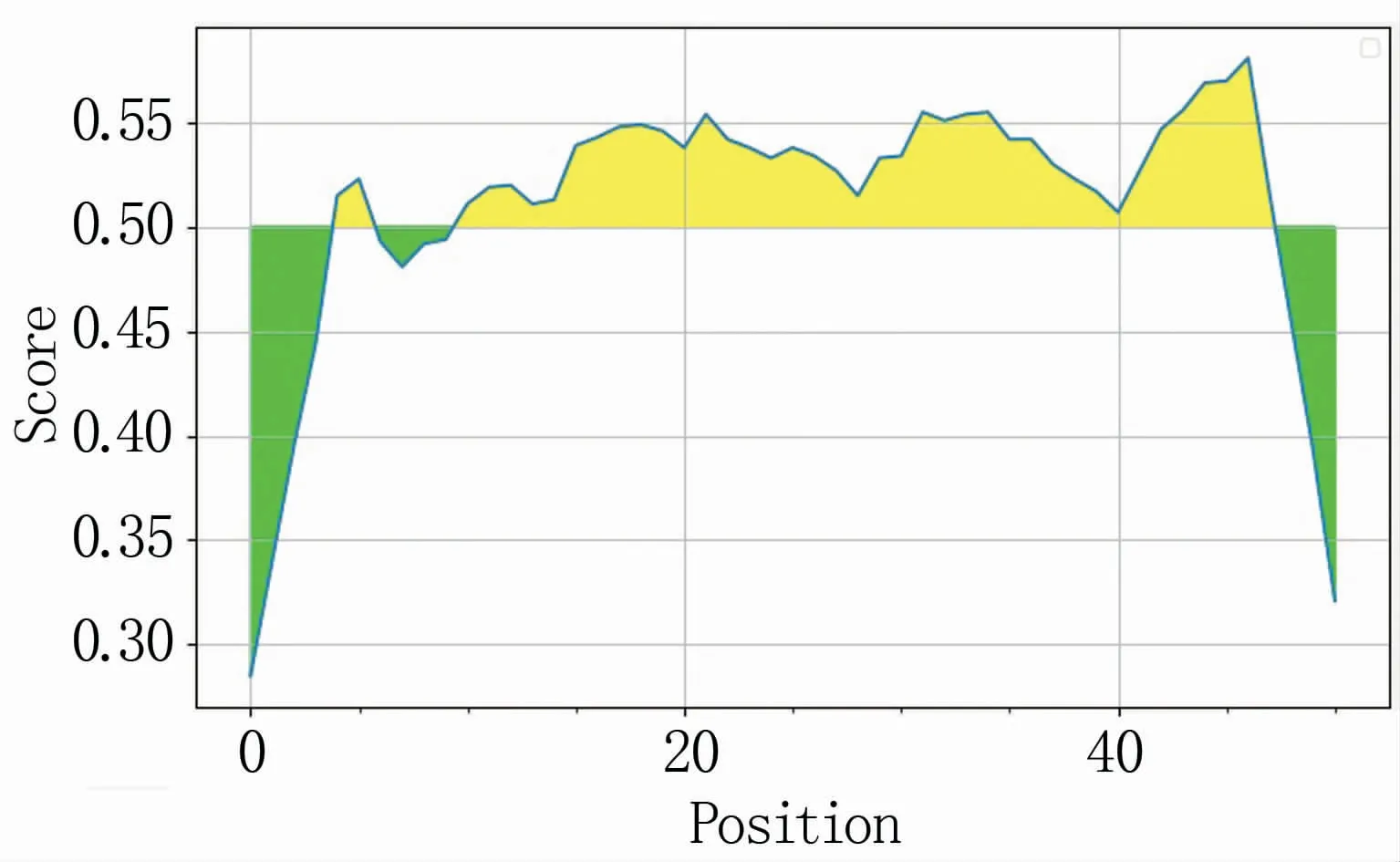
图2 α3蛋白的B细胞线性表位分析
2.4 重组质粒构建及鉴定
将扩增目的片段和pGEX-4T-1载体用BamHⅠ和XhoⅠ双酶切,连接转化后构建pGEX-4T-1-α3重组载体,重组载体用BamHⅠ和XhoⅠ进行双酶切(图3),得到α3目的片段和pGEX-4T-1的线性片段且基因片段大小与预期相符。基因测序分析表明插入目的基因正确,说明成功构建了重组表达质粒pGEX-4T-1-α3。
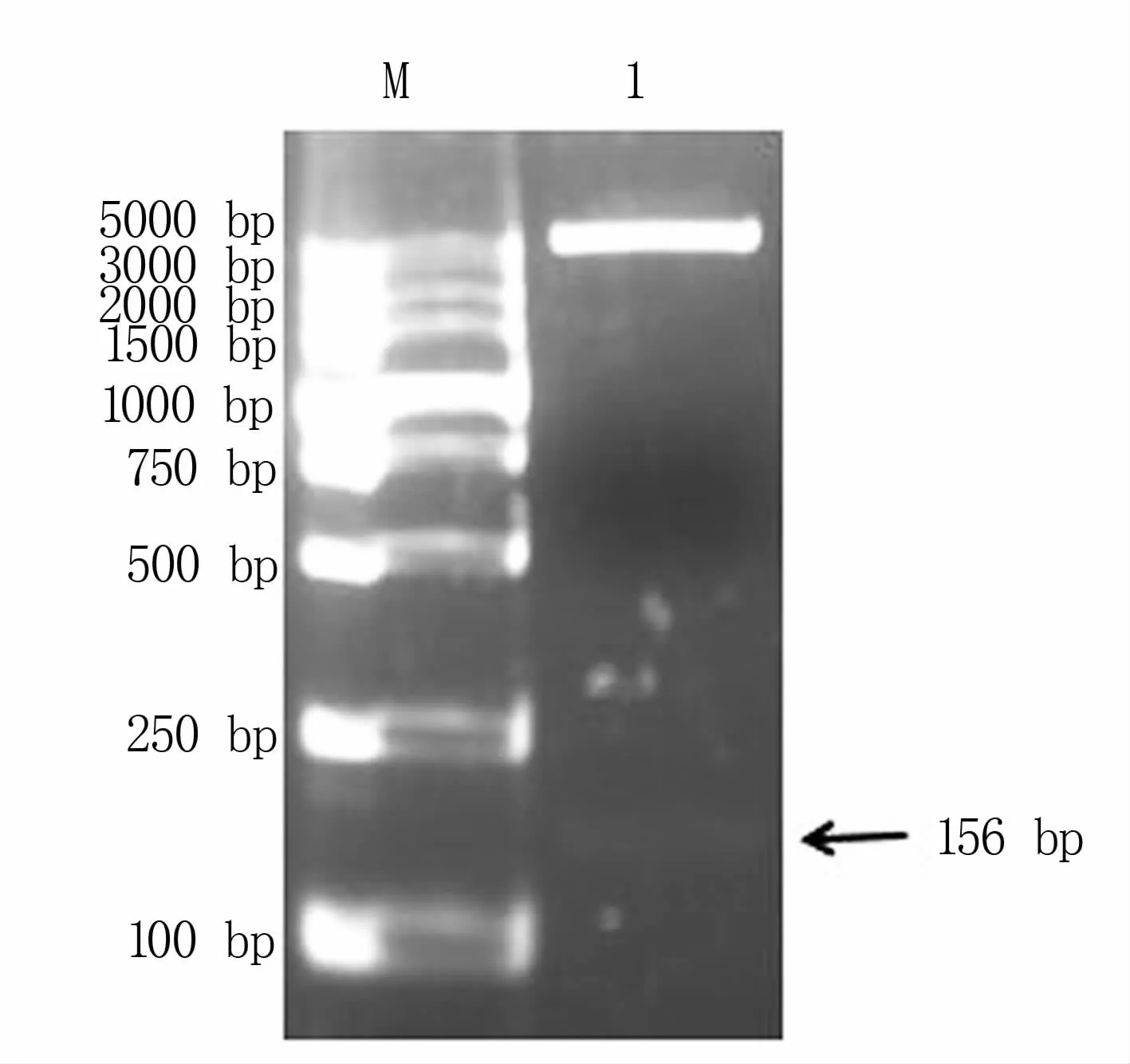
图3 pGEX-4T-1-α3重组载体双酶切鉴定
2.5 融合α3蛋白的表达纯化及鉴定
蛋白表达结果(图4)显示,通过泳道1和泳道2对比,说明α3蛋白正常表达,泳道3和泳道4说明GST空载正确表达,泳道1和泳道4说明GST及α3融合GST纯化效果好,与预期相符。
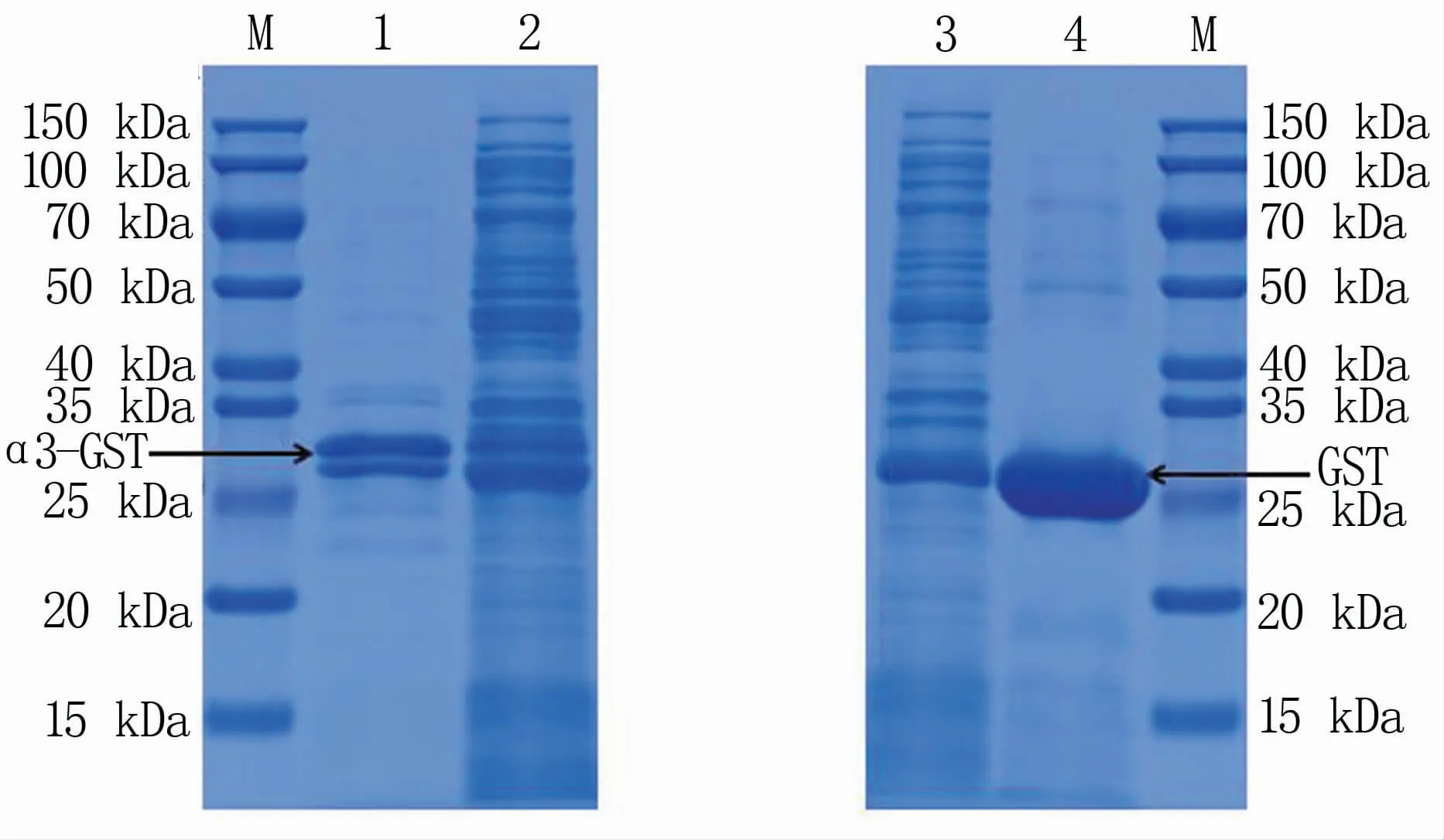
图4 重组α3蛋白表达和纯化检测
2.6 α3融合蛋白Western Blot鉴定
Western Blot鉴定结果(图5)显示,纯化后的α3和GST融合蛋白、GST蛋白能够与GST的抗体在大约30 kDa处发生特异性反应,与预期大小一致,表明α3目的蛋白表达正确。
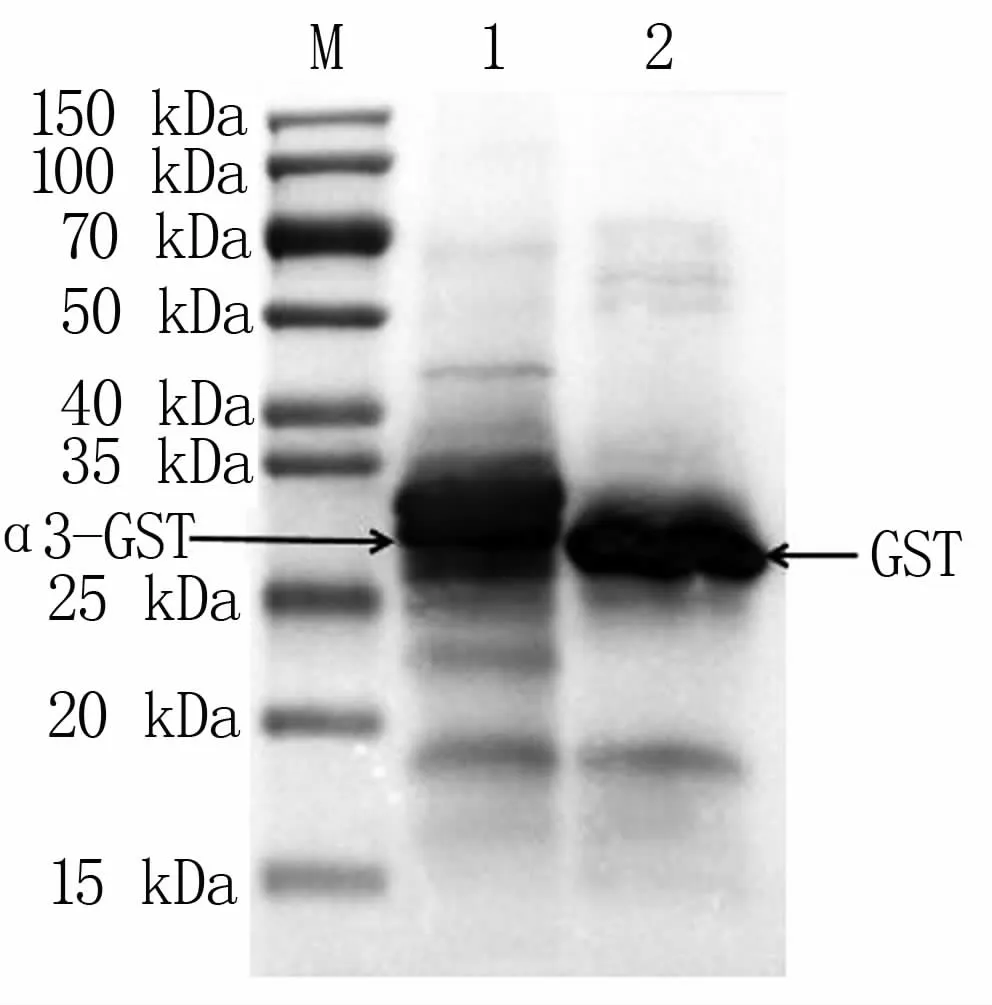
图5 纯化后的α3蛋白Western Blot检测
3 讨论与结论
BEFV与狂犬病毒、水泡性口炎病毒均属于弹状病毒科[17]。但BEFV在基因组大小及编码蛋白上存在较大差异,除了5个结构蛋白外,还编码6个非结构蛋白,这些非结构蛋白是BEFV所特有,关于其功能研究报道较少[18-22]。本研究表明,山东分离毒株牛流行热病毒α3基因片段大小为156 bp,编码51个氨基酸,与参考毒株的核苷酸序列及氨基酸序列同源性均大于98.0%,因此推测α3蛋白在不同毒株之间具有很高的保守性。牛流行热病毒实验室诊断方法主要为核酸检测与血清学检测,应用的靶蛋白主要是病毒的G糖蛋白,但是G糖蛋白容易发生突变,从而导致检测的特异性低。鉴于α3蛋白具有一定的保守性,可能是BEFV血清学诊断的重要抗原[5,23]。
本研究首先通过生物信息学软件对α3蛋白的抗原表位进行分析,结果表明,α3蛋白包含5个B细胞线性表位,其中区段3~5、9~47 aa是α3蛋白的优势抗原表位区段,推测α3蛋白可能具有免疫原性。赵庆亮等[16]利用ProtParam软件分析蛋白的亲水性,以判断该蛋白是以包涵体形式存在还是可溶性形式存在。本研究根据Prot-Param软件预测α3蛋白的总平均疏水性为-0.737,推测其为可溶性蛋白。本试验成功构建了pGEX-4T-1-α3重组载体,将其转化BL21感受态中,IPTG诱导4 h后,α3蛋白能够高效以可溶性蛋白表达,进一步通过GST磁珠纯化获得较高浓度的α3蛋白,这提示BEFV的α3蛋白可能是一个重要潜在亚单位疫苗的候选蛋白,需要进一步进行免疫原性的研究[24-28]。纯化的α3融合GST蛋白与磁珠可作为GST pull-down试验的诱饵蛋白,免疫沉淀BEFV感染的宿主细胞蛋白,可为研究α3蛋白的相关功能奠定基础。
综上所述,本研究利用原核表达系统将α3蛋白与GST融合可溶表达,纯化具有天然免疫构像活性且产量高的蛋白,具有极大的商品化潜力,为下一步诊断方法的创新、寻找与α3相互作用的蛋白及研制新型的BEFV疫苗提供了理论基础。
