DPEP1基因过表达BT549细胞株的建立和鉴定
2021-08-28郑美玲魏春莉刘晓燕傅俊江
郑美玲,魏春莉,刘晓燕,傅俊江
西南医科大学医学基础研究中心·四川省高校表观遗传与肿瘤重点实验室(泸州 646000)
肿瘤是机体在各种异常因素作用下产生的新生物,其中恶性肿瘤为医疗界的一大难题,它严重威胁人类的生命健康,是全球发病率和死亡率的主要原因之一,其中50岁以上女性乳腺癌发生率为80%以上。据统计,在目前已知的各种恶性肿瘤中,由于绝大多数患者对该病不够重视,社会科普体系不健全及医院早期诊断、治疗机制不完善等客观因素无法在短时间内解决,也在很大程度上增加了恶性肿瘤的病死率[1-3]。同时由于肿瘤的致病因素、易感基因、肿瘤转移、相同肿瘤的不同类型和血管生成机制等与该病有关的各种因素尚未完全清楚[3],也在某种程度上阻碍了上述各种客观因素的有序推进。
值得注意的是,既往研究中所构建二肽酶1(de⁃hydropeptidase-1,DPEP1)基因表达载体研究与DPEP1 蛋白表达相关研究[4],揭示DPEP1 的某些生物学新功能与大肠癌、结肠癌中呈高表达的同时还与其癌症病理标本和负相关参数的侵略性和不良预后均有密切相关。DPEP1 可能通过降解基质屏障来促进细胞迁移和血管生成[5]。同时也有研究证实,DPEP1 的这种新生物学特性在肿瘤的癌细胞转移、侵袭中也存在。既往研究还证实[6],肿瘤细胞侵袭性也会受DPEP1 的过度表达抑制,吉西他滨(gem⁃citabine),一种化学治疗剂,治疗时的敏感性也会在DPEP1 的影响下递增,表皮细胞生长因子(epider⁃mal growth factor,EGF)治疗可减少DPEP1表达。
DPEP1 基因(NM_004413.4)属于肽酶M19 家庭,它定位于人类染色体16q24.3。DPEP1长度为28 233碱基对,含9 个外显子和8 个内含子;它编码411 氨基酸,预测分子量为45 674道尔顿。
研究DPEP1 调控蛋白水平、稳定性和在肿瘤癌细胞转移、侵袭中的作用,对拓展肿瘤新的治疗靶点、靶标等具有重要意义,也可为肿瘤的实验研究提供有价值的参考。
1 材料与方法
1.1 主要材料、试剂与仪器
1.1.1 试剂DMEM培养基、RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)和Opti-MEM培养基购自GIBCO 公司;EcoR V 和Nhe I 购自BIO-RAD;DPEP1 质粒购自上海吉凯基因化学技术有限公司;One-Step RT-PCR Kit及PCR产物回收试剂盒(德国QIAGEN公司)、Taq plus DNA聚合酶(上海生工生物工程公司)、Trizol试剂盒(美国Invitrogen公司)、Cell Counting Kit-8 试剂盒(CCK-8)购自日本同仁化学研究所等,其他试剂盒则参照使用说明书。载体pcD⁃NA5/FRT/TO、大肠杆菌DH5α、HEK-293 细胞系、HeLa细胞系、MDA-MB-231细胞系、BT549细胞系、潮霉素B、氨苄青霉素由本实验室保存。
1.1.2 主要仪器荧光倒置显微镜(日本Olympus 公司,型号:IX81)、超低温冰箱(美国Thermo公司)、高速冷冻离心机(美国Thermo 公司)、荧光实时定量PCR 仪及PCR 分析仪(美国ABI 公司)、BIO-RAD 双向电泳分析系统(美国伯乐公司,型号:Bio-Rad Mini-protean Tetra cell)、全波长酶标仪(美国Thermo公司)等。
1.2 方法
1.2.1 实验步骤设计实验方案(见图1)后按相关步骤开展各项实验。①应用Primer Express 2.0 软件设计DPEP1(NCBI基因库序列号:NM_004413)引物和探针获取DPEP1 的cDNA 序列(见表1)。②实验步骤:以已有DPEP1 cDNA基因为模板进行高保-聚合酶链反应(polymerase chain reaction,PCR)扩增DPEP1 全长基因。将pcDNA5/FRT/T0 表达载体用EcoR V和Nhe I双酶切消化后与相同内切酶消化的DPEP1 连接,并获取pcDNA5/FRT/T0/DPEP1。接着进行阳性克隆筛选以获得阳性克隆。最后转染细胞系过表达,并应用Western blot检测DPEP1的表达情况。

表1 DPEP1引物序列表
1.2.2 PCR扩增及克隆①反应条件:95 ℃预变性1.5 min,94 ℃40 s、65 ℃30 s、72 ℃2 min 进行35 个循环,接着在72℃条件下延伸2 min,16 ℃保存。②PCR 产物纯化:所有的PCR 产物均经EcoR V、Nhe I双酶切后胶回收纯化处理,然后连入载体并转化至大肠杆菌DH5α中并随机挑选克隆提质粒和电泳,鉴定并将初筛的阳性克隆菌液进行基因测序(Sanger测序法)。重组质粒命名为pcDNA5-DPEP1。
1.2.3 DPEP1 质粒的扩增和提取将重组质粒DPEP1克隆于氨苄青霉素阳性的LB(Luria-Bertani)培养基(37 ℃)中过夜,培养结束后提取质粒。进行琼脂糖电泳检测质粒提取质量。
1.2.4 细胞转染及构建细胞系将在含有完全培养基DMEM,10%胎牛血清的12 孔培养基中培养的HeLa 和BT549 细胞密度达到70%左右时,采用脂质体转染法将构建的pcDNA5-DPEP1 质粒和pcDNA5质粒分别共转染细胞。取3支已灭菌1.5 mL离心管,向各管分别加入OPTI-MEM、质粒、空质粒,再按顺序分别加入Lipofectamine™3000、P3000™、P3000™后,室温静置10 min,再将含有Lipofectamine™3000混合液均分至另外两支管并混匀,室温静置10 min。处理细胞后,加入50 μL OPTI-MEM培养基,再缓慢加入已静置10 min 的DNA-Lipofectamine™3000 复合物,水平前后左右轻轻推动培养板各2 次混匀并在培养板上做好标记后,将培养板放置在37 ℃CO2孵育箱中培养。培养6 h后,吸出培养液,每孔加入含有10%胎牛血清的培养基1mL;观察细胞情况,第2~3 d 将细胞传代[7-13]。潮霉素B 筛选细胞系,获得潮霉素B抗性细胞系。
1.2.5 蛋白质免疫印迹杂交(Western Blot)将细胞蛋白裂解液进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electro⁃pheresis,SDS-PAGE),10%分离胶,5%浓缩胶,蛋白质电泳至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,5%脱脂牛奶封膜,摇床1.5 h,分别加入FLAG 或DPEP1 和HSP70 抗体(1∶5 000),摇床4 ℃过夜;再用1×TBST 洗膜3 次,10 min/次。用显影液在凝胶图像成像仪曝光,从而用FLAG 抗体和DPEP1 抗体分别检测DPEP1 蛋白是否成功过表达。HSP70作为内参蛋白[11-15]。
1.2.6 CCK-8 法检测过表达细胞系CCK-8 是Cell Counting Kit-8 的简称。将转染细胞按70%左右的密度接种到96孔板,100 μL/孔。DPEP1质粒组、空质粒组、对照组、空白组均设置7 个平行孔,24 h 后加入10 μL/孔的CCK-8 溶液,培养2 h 后,置于全长酶标仪450 nm处测各孔的吸光度(OD值)[16-18]。
1.3 统计学方法
2 结果
2.1 DPEP1 cDNA扩增
以DPEP1 基因的cDNA 作为模板,高保真PCR多聚酶扩增,获得DPEP1 基因片段,再经用EcoR V和Nhe I双酶切消化后和纯化,获得用于克隆中连接所需要的纯化DPEP1片段。
2.2 鉴定重组质粒pcDNA5-DPEP1
采用PCR检测和EcoR V和Nhe I双酶切消化与相同内切酶消化的DPEP1重组质粒pcDNA5-DPEP1,获得pcDNA5/FRT/TO/DPEP1,得到与理论片段相符的1 个质粒。图2A 是阳性克隆经PCR 鉴定结果(黑色箭头标示所扩增的开放阅读框片段大小);图2B是阳性克隆经EcoR V 和Nhe I 双酶切鉴定的结果(红色箭头标示所酶切的DPEP1 片段)。然后进行Sanger 测序分析,该基因的Sanger 测序分析证明其与DPEP1(NCBI 基因库序列号:NM_004413.4;1 233 bp)序列一致(结果未显示)。

图2 DPEP1基因阳性克隆的PCR(A)和酶切鉴定(B)
2.3 DPEP1蛋白过表达分析
构建过表达DPEP1 质粒pcDNA5-DPEP1 并成功构建稳定细胞系BT549,提取蛋白进行Western blot 分析,结果显示我们成功地检测到DPEP1 蛋白的过表达(图3A,通道1 和2),而阴性对照无表达(图3A,通道Ctrl)。经对目的蛋白DPEP1 过表达的WB条带灰度值进行分析,通道1的值约是通道对照组(ctrl)的20.16 倍,通道2 的值约是ctrl 的18.13 倍(图3B)。DPEP1蛋白过表达成功证明建立了稳定表达细胞系。
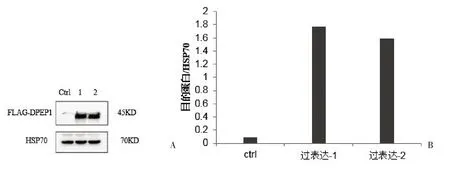
图3 DPEP1蛋白的过表达及WB条带灰度分析
2.4 DPEP1的生长分析
过表达DPEP1 细胞系进行CCK-8 检测,BT549过表达组吸光度与其他转染组细胞系进行吸光度分析。其结果以不同组为横坐标、OD 值为纵坐标作柱状图显示(图4)。DPEP1 过表达组与非DPEP1 过表达对照组、空载体质粒组之间的OD 值差异不大(分别为P=0.054,P=0.092,P=0.87),无统计学意义(P>0.05),证明DPEP1对肿瘤细胞生长无影响。

图4 DPEP1质粒转染细胞的OD值柱状图
3 讨论
据统计,在导致乳腺癌发生的各种危险因素(如未婚,未育,晚育,未哺乳等)中经期的早(月经初潮<12岁)、迟(绝经>55岁)尤显著,结肠癌主要以腹胀、消化不良、排便习惯改变等消化道症状为主,而子宫颈癌中的阴道不规则流血、排液、疼痛为主要表现,妇科检查可见宫颈糜烂、溃疡或菜花状新生物尤为突出,当然与肿瘤相关的突变基因、易感基因对其有调控作用,机体携带与相关基因也是可能存在的潜在危险[19-23]。乳腺癌是最常见的癌症,也是全世界各地女性因癌症致死的主要原因以及诊断频率最高、根治性差的癌症[18-19]。对于恶性肿瘤的发病机制及对恶性肿瘤未来的治疗方向,主要是将促使癌症发生、发展、转移的基因和途径与在其发展中不发挥作用的基因和途径进行区分,及新型靶向治疗的研究,而DPEP1的研究作为目前肿瘤生物医学研究领域中探讨乳腺癌致病因素及治疗新切入靶点之一,有其研究的必要性与迫切性。
作为肽酶M19 家庭的重要成员之一的DPEP1,临床上又将其称作神二肽酶或膜二肽酶、微粒体二肽酶。既往研究表明[24-27],DPEP1在结肠癌、大肠癌等癌组织中的表达情况均显著高于正常组织,其表达随病理分化程度的降低而降低,也随淋巴结和远处转移情况的下降而下降。研究发现,即使DPEP1 在结肠癌、大肠癌等癌组织中呈低表达,但其整体预后效果不是非常显著,当然这在那些根治性手术患者中依旧如此[13,28-30]。
本文以DPEP1 的cDNA 基因作为模板,高保真PCR 多聚酶扩增而获得DPEP1 基因片段,再用EcoR V 和Nhe I 双酶切消化和纯化,最终获得的DPEP1 cDNA 基因序列与DPEP1(NCBI 基因库序列号:NM_004413)序列相符。且重组DPEP1 蛋白后获得了与理论片段相符的质粒。而在RAPD 技术肿瘤组织分析中也发现,乳腺癌中的DPEP1 表达有显著的异常扩增特征[26-31],提示DPEP1 可能影响肿瘤患者的癌细胞的侵袭性而改变寄主细胞原有的性状或癌细胞的产生提供便利,以及癌细胞的转移起到促进作用,这可能与DPEP1 蛋白在肿瘤细胞中存在过表达现象有关[7,20,29]。在分子生物学研究中,通常需要基因/蛋白质的所需表达[26]。上述研究均证实,DPEP1蛋白在肿瘤细胞中能显著的过表达现象。而既往研究[32-34]中的DPEP1 cDNA(结直肠上皮内癌变组织)和蛋白表达情况与病理特征对比分析也发现,二者的表达趋势有显著的一致性,且DPEP1 蛋白水平越高其癌变组织发生癌变的可能性也越高。同时也有研究表明[35-36],DPEP1 的过表达通过激活PI3K/Akt/mTOR使原本沉默的DPEP1在肝母细胞瘤中起到癌基因的作用。肿瘤癌变进程中表观遗传学的变化能引起抑癌基因失活与原癌基因活化,对不同肿瘤的发生发展、侵袭转移起关键性作用[7,37-41]。结合上述研究可以推断,肿瘤患者的DPEP1 表达量升高是随着肿瘤病变的发生、发展而逐渐发生转变的,DPEP1表达在乳腺癌的肿瘤演进机制中发挥了重要作用。DPEP1在恶性肿瘤的瘤变过程中存在显著的过表达特征,且影响肿瘤细胞的侵袭性。
综上所述,此次实验成功构建DPEP1 过表达载体并成功构建乳腺癌BT549 稳定细胞系,并检测到了DPEP1 蛋白过表达,对下游调控信号通路及DPEP1 功能的研究可能非常有用。推测DPEP1 在恶性肿瘤的病变过程中可能诱导正常细胞转变为癌细胞,可能是恶性肿瘤潜在的一个新治疗靶点。但仍需更多的研究予以证实,而本研究为将来阐明DPEP1基因在肿瘤中的作用及机制奠定实验基础。
4 结论
本研究成功构建了DPEP1 的过表达载体及稳定细胞株,并获得DPEP1 蛋白的过表达。该研究的成功实施为深入阐明DPEP1 在肿瘤中的作用机制奠定了前期实验基础。
