基于多重PCR技术同时检测肉制品中6种动物源性成分
2021-08-28赵志勇朱少华赵晓燕索玉娟陈爱亮李晓贝张艳梅周昌艳
赵志勇,朱少华,赵晓燕,索玉娟,陈爱亮,李晓贝,张艳梅,周昌艳∗
(1上海市农业科学院农产品质量标准与检测技术研究所,上海201403;2农业农村部工程建设服务中心,北京100125;3中国农业科学院农业质量标准与检测技术研究所,北京100081)
肉制品掺假是食品领域一直存在的质量安全问题,也是公众关注的焦点之一[1-2]。由于肉类品质和价格存在差异,个别企业和商贩在利益驱动下,用低价劣质肉冒充高价优质的肉,尤以掺杂异种肉(如猪肉、鸭肉冒充牛、羊肉等)的行为最为常见[3]。近年来,该类掺假事件在国内外屡有发生,引起了社会的广泛关注。2011年新华网报道,很多大排档为降低成本通过“牛肉膏”使猪肉变身“牛肉”,江西、福建、广州及其周边市场也存在这种状况。2013年欧洲暴发“马肉风波”,在瑞典、英国和法国部分牛肉制品中发现了马肉[4]。2018年,河北河间多个乡镇的黑作坊将骡子肉、马肉、猪肉加工后冒充驴肉出售。这些掺假事件不仅损害了消费者的利益、扰乱了市场秩序,也容易引发民族宗教等问题[5]。另外,掺假产品中经常使用调味剂及调色剂,仅从产品的色泽和气味上,很难判断出肉制品中是否添加了其他肉类成分。为了严厉打击肉类产品掺假售假等行为,建立肉制品中动物源性成分鉴别检测技术显得尤为重要。
从20世纪80年代开始,国内外就已开展了动物源性成分检测相关的研究工作[1,6-9]。目前,主要的检测方法包括:以显微镜观察为基础的物理方法[10]、以检测蛋白质为基础的免疫学方法[8]、以检测DNA为基础的分子生物学方法[7,11]、以高效液相色谱技术为基础的化学方法[12]、以近红外反射技术为基础的光谱学方法[13]。其中,聚合酶链式反应(Polymerase Chain Reaction,PCR)具有特异性高、成本较低、操作简便等优点,已在微生物和动植物的种质鉴别中得到广泛应用,在肉制品掺假鉴别方面也显示出良好的应用前景[14-15]。我国政府监管部门已颁布了利用PCR技术鉴定肉源性成分的国家标准和行业标准。然而,这些标准大多针对单种动物源成分进行鉴定,对于确证食品中是否掺杂有多种肉类成分,则需分别鉴定,检测成本高、操作繁琐且耗时。本研究旨在建立一种可同时检测食品中牛、羊、鸡、猪、鸭和驴等成分的六重PCR方法,以用于肉制品中6种动物源性成分的同时鉴定。
1 材料与方法
1.1 材料与试剂
磁珠法基因组DNA抽提试剂盒和PCR Taq扩增试剂盒(含染料或不含染料)购自生工生物工程(上海)股份有限公司。所用引物由生工生物工程(上海)股份有限公司合成。牛肉(鲁西黄牛、和牛、南阳牛和安多牦牛)、猪肉(太湖猪、三元猪、杜洛克猪、良杂猪和沂蒙黑猪)、兔肉和狗肉等由中国农业科学院农业质量标准与检测技术研究所提供。羊肉(崇明白山羊和波尔山羊)、鸡肉(白羽鸡、三黄鸡、乌骨鸡和草鸡)及草鸭等购自上海屠宰场或大型超市。样本保存在-20℃条件下。
1.2 仪器与设备
T100 PCR扩增仪(美国Bio-Rad公司),Universal Hood II凝胶成像系统(美国Bio-Rad公司),Nanodrop 2000C超微量分光光度计(美国Thermo Scientific公司),PowerPac@basic电泳仪(美国Bio-Rad公司)。
1.3 方法
1.3.1 DNA提取方法
(1)盐提取法 称取肉样50 mg,加入液氮研磨成粉末,转移至1.5 mL离心管中,加入400μL裂解液I(10 mmol∕L Tris-HCl,pH 8.0;2 mmol∕L EDTA,pH 8.0;0.4 mol∕L NaCl)和80μL 10%SDS。涡旋振动后,加入2μL 20 mg∕mL蛋白激酶K,65℃条件下孵育1 h。涡旋后,加入20μL 10 mg∕mL Rnase酶,65℃下孵育10 min。加入300μL 5 mol∕L NaCl,涡旋30 s。10 000 r∕min下离心10 min,将上清液转移至新的离心管中,加入等量异丙醇,涡旋后置于-20℃冰箱30 min,15 000 r∕min离心5 min后,移除上清液。向离心管中加入700μL体积分数为70%乙醇,吸打或者点振混匀,15 000 r∕min离心5 min后,移除上清液,重复该步骤。室温开盖干燥15—20 min至管内无液体残留。向离心管中加入100μL灭菌水,剧烈振荡。
(2)酚-氯仿提取法 称取肉样50 mg,加入液氮研磨成粉末,转移至1.5 mL离心管中,加入500μL裂解液II(50 mmol∕L Tris-HCl,pH 8.0;10 mmol∕L EDTA,pH 8.0;0.1 mol∕L NaCl)、30μL 10%SDS和2μL 20 mg∕mL蛋白激酶K,50℃条件下孵育1 h。涡旋后,加入20μL 10 mg∕mL Rnase酶,50℃下孵育10 min。加入等体积的酚∕氯仿∕异戊醇(24∕24∕1,V∕V∕V)至反应体系中。涡旋3 min,10 000 r∕min下离心5 min。将上清液转移至新的离心管,加入等体积氯仿∕异戊醇(24∕1,V∕V)。涡旋振荡后,10 000 r∕min离心5 min。取上清液转移至新的试管,加入等量冰浴过的乙醇,在10 000 r∕min离心5 min后,移除上清液。使用体积分数为70%乙醇溶液冲洗DNA,离心后去除上清液。残渣用100μL灭菌水溶解。
(3)试剂盒法参照基因组提取试剂盒说明书进行提取。
1.3.2 引物设计
在GenBank中搜索牛、羊、鸡、猪、鸭和驴等线粒体细胞色素b(Cyt b)的基因序列。釆用正反向引物特异的策略,通过Blast功能确保属内序列间具有较高的同源性后,将序列导入到DNAMAN软件中,分析属间基因组的差异。在此基础上,用Primer 6设计各物种的特异性引物。经过验证与筛选,6种动物源性成分的引物信息见表1。
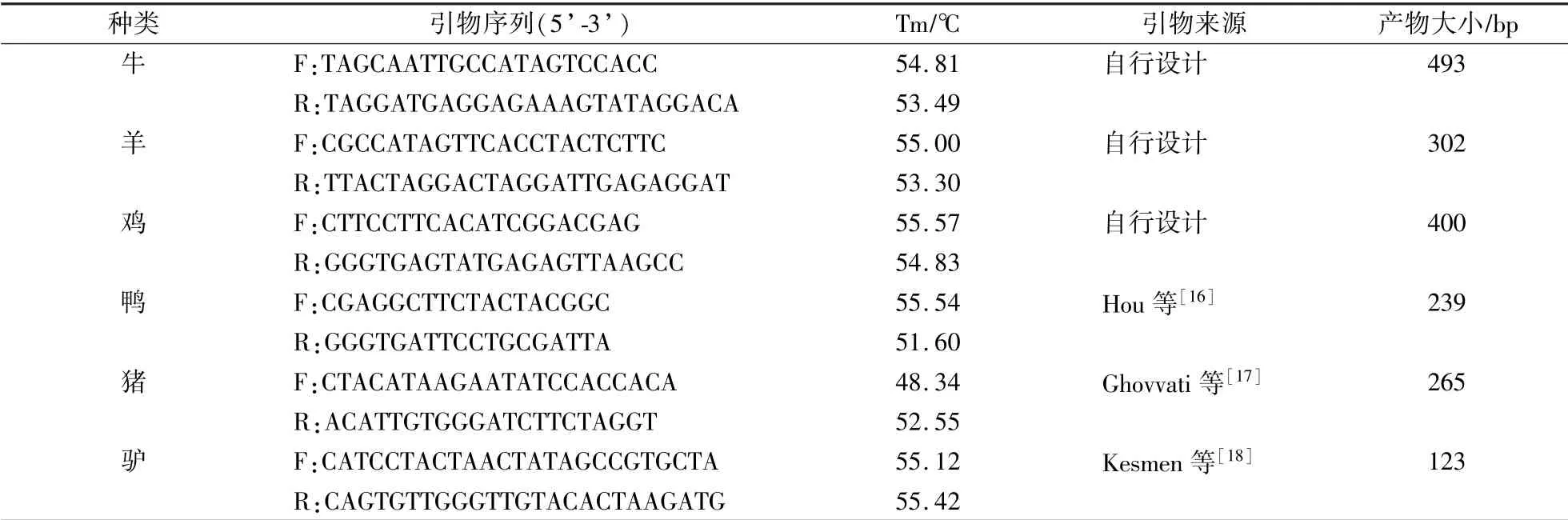
表1 牛、羊、鸡、鸭、猪和驴等引物序列信息Table 1 The primer information of cattle,sheep,chicken,duck,pig and donkey
1.4 引物特异性验证
利用设计及筛选的6对引物,分别扩增17种不同畜禽品种(牛、羊、鸡、猪、鸭、驴、兔和狗)的基因组DNA,验证引物的特异性;并分别扩增各动物组织的DNA,考察多重PCR反应体系的特异性与适用性。
1.5 多重PCR反应体系
PCR反应体系(50μL):5×PCR Buffer 10μL,dNTPMix浓度为0.2 mmol∕L,Taq DNA聚合酶2.5 U,MgCl23 mmol∕L,DNA模板1μL,最佳引物比例为牛∕羊∕鸡∕猪∕鸭∕驴=2∕1∕1∕1∕0.5∕1[1代表10 pmol∕(50μL)],最后用灭菌水将体系补足至50μL。PCR反应条件为:94℃预变性5 min;94℃变性40 s,58.6℃退火30 s,72℃延伸1 min,35个循环;72℃延伸5 min。反应结束后,取3μL PCR产物用2%琼脂糖凝胶电泳进行检测,凝胶成像系统观察结果并拍照。
1.6 多重PCR体系的优化
1.6.1 引物比例
设置5种引物比例[(1代表10 pmol∕(50μL)]:①牛∕羊∕鸡∕鸭∕猪∕驴=1∕1∕1∕1∕1∕1;②牛∕羊∕鸡∕鸭∕猪∕驴=2∕1∕1∕0.5∕1∕0.5;③牛∕羊∕鸡∕鸭∕猪∕驴=2∕1∕2∕0.5∕2∕1;④牛∕羊∕鸡∕鸭∕猪∕驴=2∕1∕1∕0.5∕1∕1;⑤牛∕羊∕鸡∕鸭∕猪∕驴=2∕1∕2∕0.5∕1∕2。根据凝胶电泳条带数量及亮度,确定最佳引物比例。
1.6.2 Mg2+浓度的优化
在多重PCR反应体系中,Mg2+的浓度依次设为1.0 mmol∕L、2.0 mmol∕L、3.0 mmol∕L、4.0 mmol∕L、5.0 mmol∕L,根据凝胶电泳条带数量及亮度,确定体系中最优的Mg2+浓度。
1.6.3 退火温度的优化
利用梯度PCR反应程序,分别设定退火温度为53.0℃、53.9℃、55.0℃、57.4℃、58.6℃、59.8℃、61.0℃和62.0℃,其他反应条件不变。根据凝胶电泳条带数量及亮度,确定最佳退火温度。
1.7 检测灵敏度
将100 ng∕μL的6种动物源性成分的DNA模板混合稀释至10 ng∕μL,然后用灭菌蒸馏水依次稀释至1 ng∕μL、0.1 ng∕μL、0.01 ng∕μL、0.001 ng∕μL。利用1.5中多重PCR方法进行扩增,考察多重PCR方法的灵敏度。
1.8 市售样品检测
采集15份市售的肉类产品,包括5份肉丸、5份火腿及5份鲜肉卷等,利用建立的六重PCR方法进行检测。同时,使用现行颁布的标准方法:《SN∕T 3731.5—2013食品及饲料中常见禽类品种的鉴定方法第5部分:鸭成分检测PCR法》《SN∕T 2051—2008食品、化妆品和饲料中牛羊猪源性成分检测方法实时PCR法》《SN∕T 2978—2011动物源性产品中鸡源性成分PCR检测方法》《SN∕T 3730.4—2013食品及饲料中常见畜类品种的鉴定方法第4部分:驴成分检测实时荧光PCR法》与本方法进行对比确证。
2 结果与分析
2.1 肉类DNA提取方法
如表2所示,对于羊、鸡、猪、鸭和驴等源性成分,试剂盒法提取的DNA浓度最高,酚-氯仿法与盐抽提法次之;对于牛源性成分,3种提取方法的DNA得率基本一致。盐抽提法提取的DNA A260∕A280值在1.57—1.82,酚-氯仿抽提法的DNA A260∕A280值在1.78—1.91,试剂盒提取法的DNA A260∕A280值在1.98—2.06。相比较而言,试剂盒法提取的DNA纯度更高。
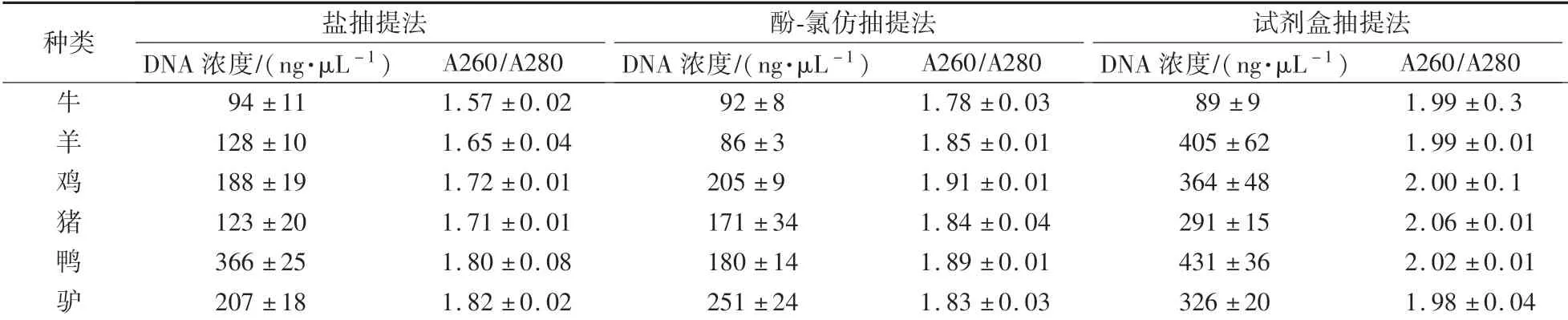
表2 不同抽提方法对DNA浓度及纯度的影响Table 2 Effects of different extraction methods on DNA concentration and purity
2.2 引物特异性验证
如图1(a)所示,使用牛引物分别扩增17种动物组织的DNA。结果显示:南阳牛、鲁西黄牛及和牛均出现493 bp扩增条带,而安多牛和其他肉制品未出现特异性条带。如图1(b)—(f)所示,分别使用羊、鸡、猪、鸭和驴的引物扩增17种动物组织。结果显示:羊、鸡、猪、鸭和驴的扩增条带分别为302 bp、400 bp、265 bp、239 bp和123 bp,其他种属动物DNA扩增结果均为阴性。表明所选择的6对引物对同种属动物源性成分能扩增出目的条带,对其他肉源性成分均无扩增现象,引物特异性良好。
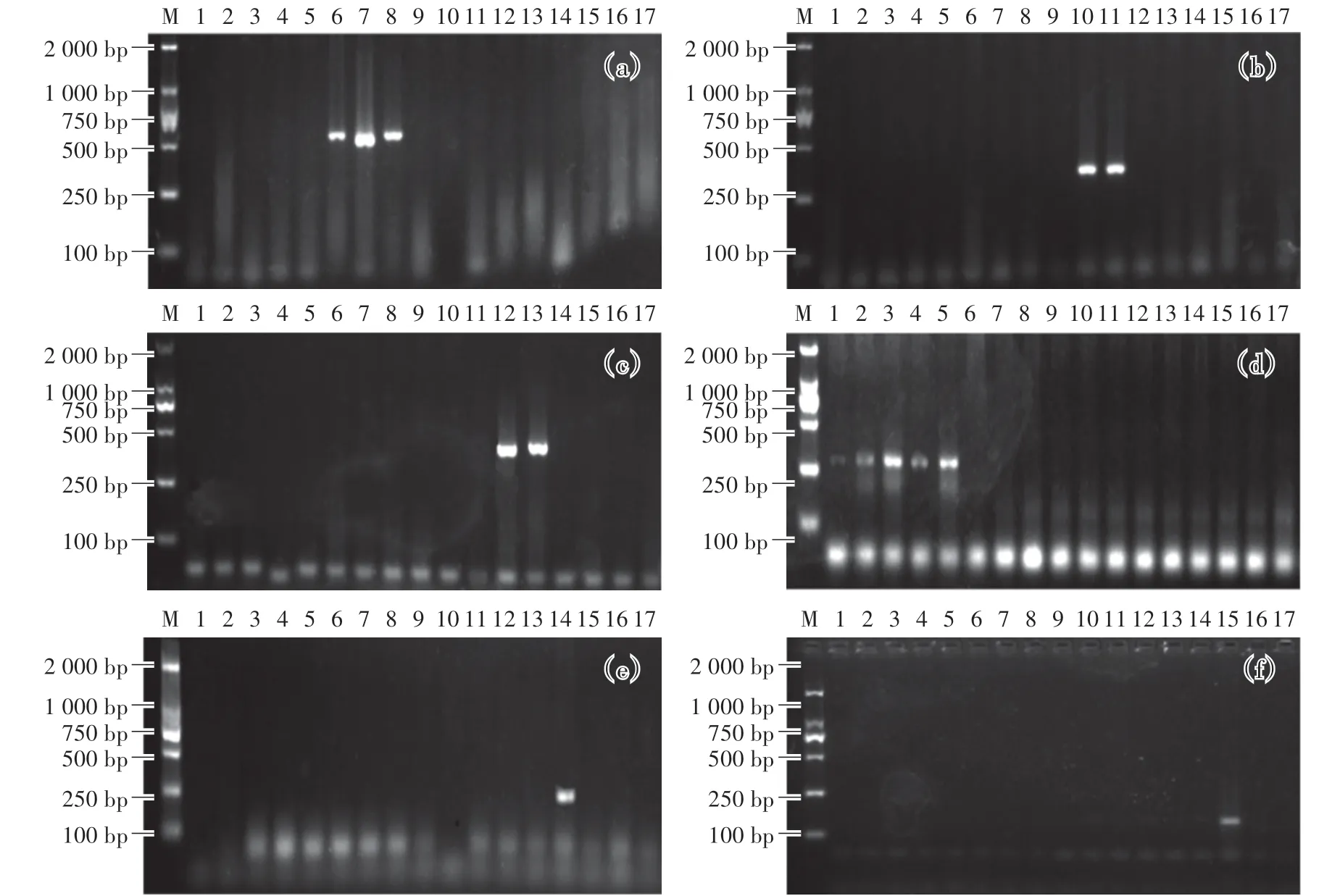
图1 单引物分别扩增各动物DNA的电泳图Fig.1 The gel electrophorogram of DNA from different animal species by signal prime
同时,考察了单引物分别扩增含6种动物源性成分的混合DNA模板。如图2所示,每对引物仅扩增出单一特征性的目的条带。使用六重引物体系分别扩增牛、羊、鸡、猪、鸭和驴等动物源性成分,也均扩增出单一特征性条带,表明所设计的引物可满足多重PCR的特异性要求。
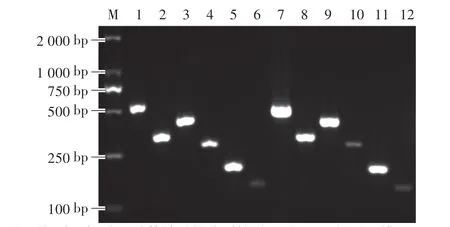
图2 单重PCR和六重PCR反应体系的凝胶电泳Fig.2 The gel electrophorogram of single and multiple PCR system
2.3 多重PCR反应条件的优化
2.3.1 不同引物比例对多重PCR反应的影响
引物浓度可影响PCR扩增效率[19]。若引物浓度过低,则引物不能充分与DNA靶标位点结合,从而导致产物量降低;若引物浓度过高,则容易引起错配,导致非特异性产物增加。在多重PCR反应体系中,引物之间也可能会产生交叉结合,从而影响PCR反应的效率。如图3所示,当牛∕羊∕鸡∕鸭∕猪∕驴=2∕1∕1∕0.5∕1∕1时,各物种间无交叉反应,可出现6条清晰的目的条带。
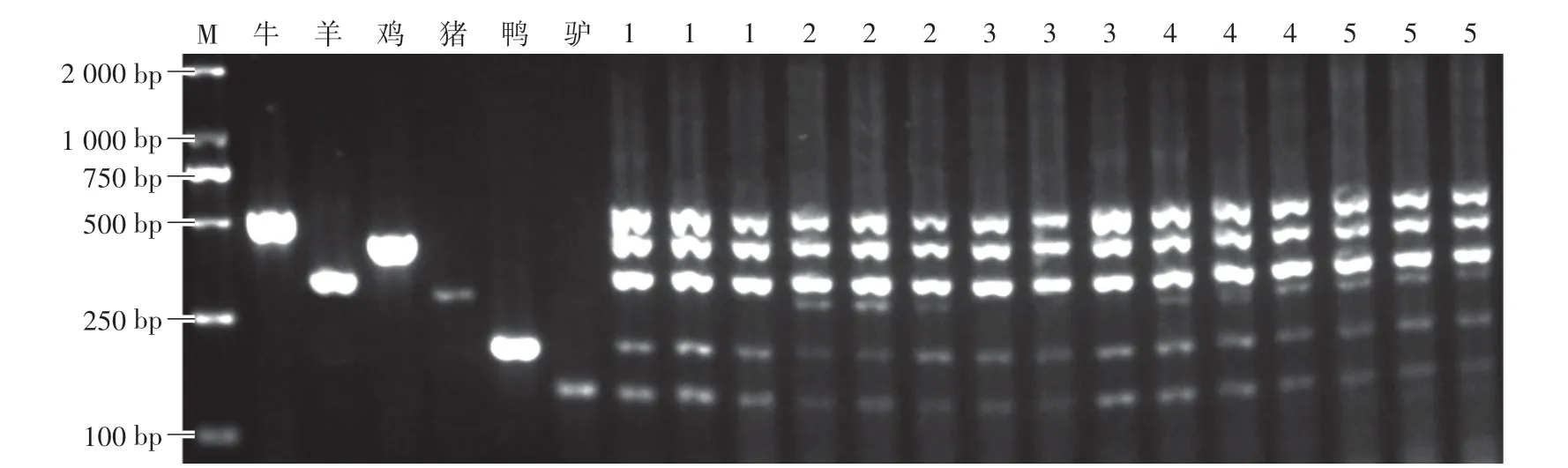
图3 不同引物比例对PCR扩增效率的影响Fig.3 Effects of different primer ratios on the PCR amplification efficiency
2.3.2 Mg2+浓度对多重PCR反应的影响
Mg2+是TaqDNA聚合酶的活性因子,其浓度对PCR扩增的特异性和产量均有影响。当其浓度过低时,会降低TaqDNA聚合酶的活性,使扩增产物量减少;当浓度过高时,可导致酶催化的非特异性扩增增加。如图4所示,当Mg2+浓度为1 mmol∕L时,猪、鸭和驴的目的条带亮度十分低;当Mg2+浓度增加至2—3 mmol∕L时,可扩增出6条目的条带;当Mg2+浓度高于3 mmol∕L时,驴的目的条带亮度较低。最终选择Mg2+浓度为3 mmol∕L。
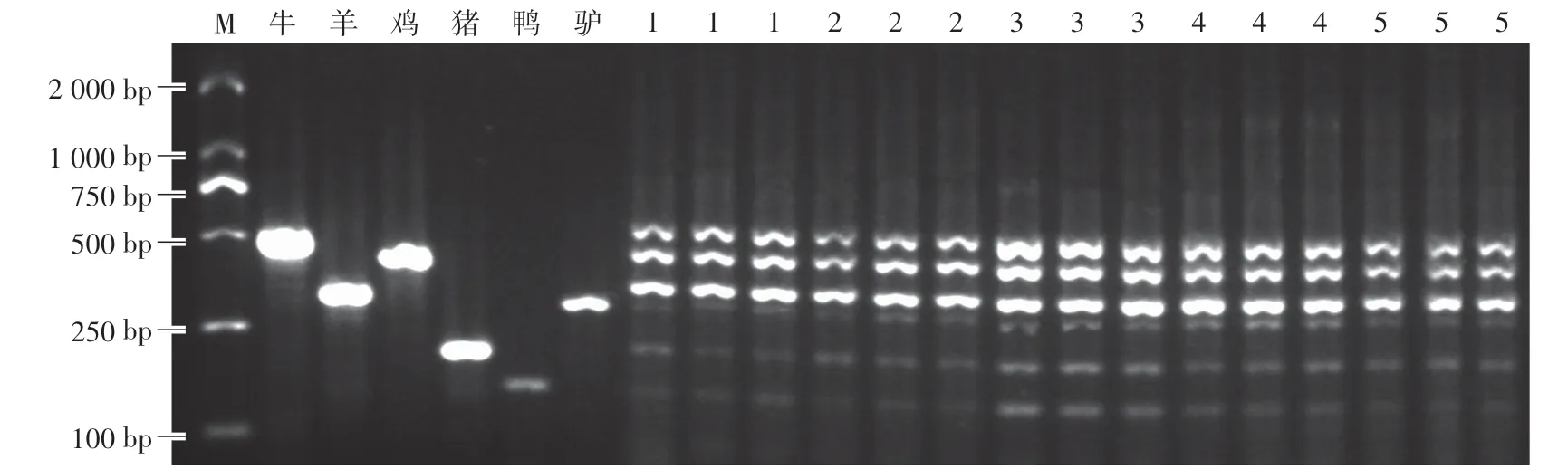
图4 Mg2+浓度对PCR扩增效率的影响Fig.4 Effects of Mg2+concentration on PCR amplification efficiency
2.3.3 退火温度对多重PCR反应的影响
退火温度是引物与DNA模板结合的温度,也是影响PCR反应特异性的重要因素[20]。在PCR反应中,退火温度过低会增加非特异性扩增,退火温度过高则扩增不出目的条带。如图5所示,当退火温度小于55℃时,无法扩增出猪源性成分的目的条带,仅能扩增出另外5种源性成分的目的条带;当温度提高至55℃时,可同时扩增出6种源性成分的目的条带。通过比较,本研究选择58.6℃为最佳退火温度。
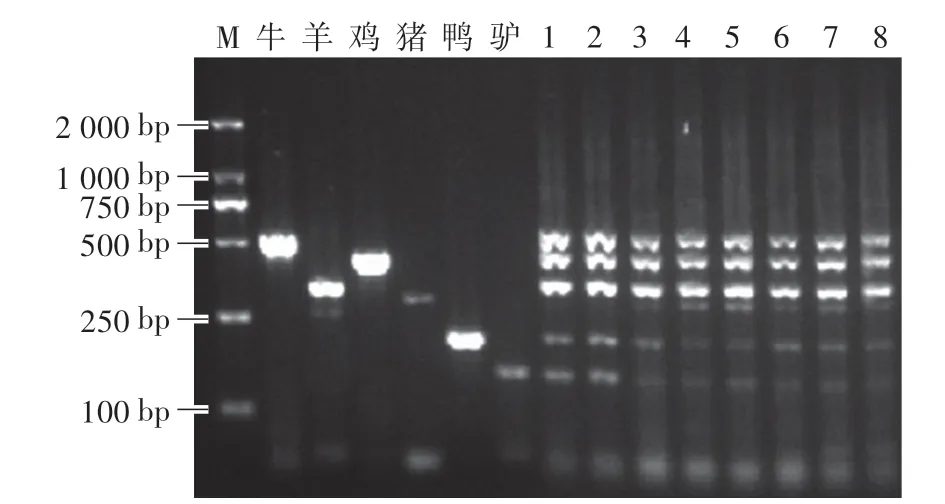
图5 退火温度对PCR扩增效率的影响Fig.5 Effects of annealing temperature on PCR amplification efficiency
2.4 检测灵敏度试验
如图6所示,当添加1μL 0.1 ng∕μL混合DNA时,仍可扩增出6种动物源性成分的目的条带,表明该方法检测6种动物源性成分的灵敏度为0.1 ng∕μL DNA。
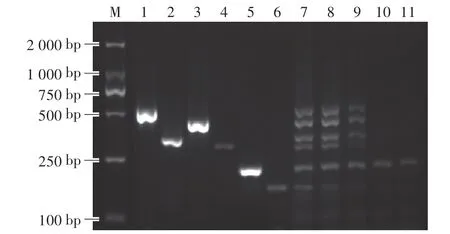
图6 六重PCR方法的灵敏度Fig.6 The sensitivity of multiple PCR method
2.5 市售样本分析
利用建立的六重PCR方法与现行颁布的行业标准对市售肉制品进行检测。如表3所示,5份肉丸中有2份检出标注成分之外的肉类,例如牛肉丸中检出鸭和猪源性成分等;5份火腿样品中有3份检出标注成分之外的肉类;5份鲜肉卷均为其标注的肉类成分。总体来看,对于肉丸与香肠制品仍需加强市场监管与抽查力度。
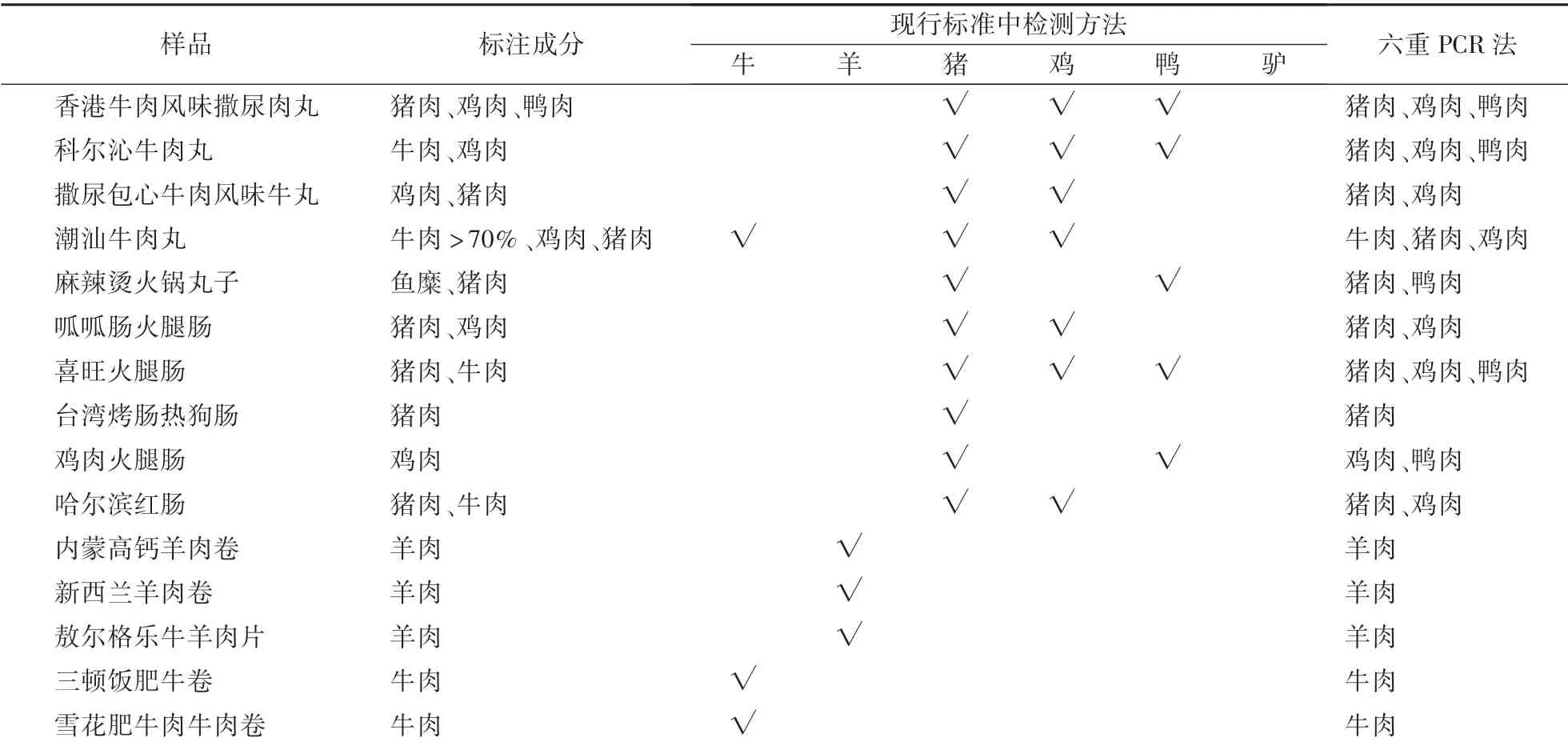
表3 15份市售肉制品分析结果Table3 Analysis results of 15 of meat products from market
3 讨论
肉制品掺假是食品质量安全领域一直存在的问题。我国监管部门针对肉源成分的鉴定已颁布了约31个国家、行业或地方标准。然而,这些标准大多数仅能同时检测2—3种动物源性成分,尚未颁布可同时检测4种以上肉制品的技术标准。另外,国内外已有不少研究人员建立了基于PCR的动物源性成分鉴定方法。唐修君等[21]以线粒体16SrRNA基因序列为靶位点设计特异性引物,建立了可检测羊、牛、猪、兔和鸡源性成分的检测方法。该方法在同一反应体系中仅能检测单种动物源性成分,不能同时检测多种源性成分。本研究建立了一种可同时鉴别食品中牛、羊、鸡、猪、鸭、驴等源性成分的多重PCR方法。该方法可在一个PCR反应体系中同时鉴定6种动物源性成分,极大地节省人力、时间和检测成本。冯海永等[22]建立了检测羊肉产品中7种动物源性成分的PCR方法,该方法引物的设计采用上游引物共用、下游引物特异的策略,未针对不同动物源性成分设计各自特异性的引物对,也未考察反应体系同时扩增7种肉源成分的效果。同样,Song等[23]建立了可同时检测牛、羊和猪源性成分的检测方法。该方法也采用上游引物共用、下游引物特异的引物选择策略。本研究起初针对不同畜禽种类自行设计合成了6对特异性的引物,并在17种不同品种或品系的肉制品中进行验证,结果表明牛、羊、鸡引物仅对本类肉制品扩增出目的条带,引物特异性高;猪、鸭和驴引物对其他肉类也可扩增出目的条带,引物特异性较差。鉴于此,本研究筛选并验证了已报道的猪、鸭和驴引物,并结合自行设计的牛、羊、鸡引物,建立了六重PCR检测方法。
多重PCR技术可极大节约检测成本和简化操作步骤,但是多重PCR技术也存在一定的技术难题。例如,在同一反应体系中加入多对特异性引物,极有可能会出现非特异性扩增,产生拖尾和引物二聚体,从而造成目标序列扩增效率下降及灵敏度降低等情况,进而使相关方法的推广及标准化受到限制[24]。一般来讲,影响扩增效果的因素包括:引物浓度、Mg2+浓度、退火温度、模板浓度、循环参数等[25]。本研究通过对引物比例、Mg2+浓度、退火温度进行优化,提高引物反应过程中的特异性和灵敏度,最终扩增出6条特异性目的条带,不同物种间无交叉反应,极大地节约了检测成本、提高了检测效率。
总体来说,本研究建立了一种可同时检测肉制品中牛、羊、鸡、猪、鸭和驴等源性成分的多重PCR方法。相较于已报道的方法,本研究自行设计了牛、羊和鸡等源性成分的高特异性引物,并且在17种不同品种的畜禽产品中进行验证,确保了所使用的引物在不同品种间依然有较强的特异性,避免出现假阳性结果。另外,相较于荧光定量PCR方法,该方法具有检测成本低、操作简单快捷等优点,可在基层监管部门中推广应用,为维护消费者权益,打击肉制品掺假售假等问题提供技术支撑。
