转基因聚球藻7942的vp19基因表达效率及其光合生理特性研究
2021-08-28施定基何培民
朱 婵,施定基,何培民,贾 睿∗
(1上海海洋大学海洋生态与环境学院,上海201306;2中国科学院植物研究所,北京100093)
微藻作为水产动物的开口饵料,可以促进水产动物幼体生长,提高其存活率[1],增强其抗逆性[2],而且可以改善水质[3],抑制有害菌的生长[4]。同时,由于微藻结构简单、生长迅速,因而一些微藻成为了水产动物口服疫苗的表达载体[5]。为建立口服疫苗产业,微藻的规模化培养是需要考虑的首要问题[6]。张春莉等[7]首次将白斑综合征病毒(White spot syndrome virus,WSSV)囊膜蛋白基因vp28在鱼腥藻7120(Anabaenasp.PCC 7120)中表达,并通过口服用药的方式提高了对虾对WSSV的免疫力[8],但vp28基因在其中的表达效率很低,远不能满足生产需求。邓元告等[9]把vp28基因转入聚球藻7942(Synechococcussp.PCC 7942)中,并表达成功;庄旻敏等[10]研究表明,vp28基因在聚球藻7942中的表达率是在鱼腥藻7120中的3倍。
VP19蛋白是白斑综合征病毒中含量仅次于VP28蛋白的囊膜蛋白[11],如果能有效提高目的基因的表达率,则可进一步降低转基因蓝藻的培养成本,从而真正实现口服剂的产业化[12]。现有研究表明,目的基因的表达率可能与生长时间有关[10,12];在微藻的培养研究中,需要确定转基因微藻的生长活力,温度、光照强度、pH和盐度是影响微藻生长和生化组成的重要环境因素[13-15]。
本研究采用荧光定量PCR的方法检测转基因聚球藻7942在不同生长阶段vp19基因的相对表达量,并在此基础上通过氧电极分析转vp19基因型聚球藻7942的光合速率随温度、光照强度和收集天数的变化特征,探究其最适生长条件,以期为后续转基因蓝藻口服疫苗的规模化生产奠定基础。
1 材料与方法
1.1 材料
聚球藻7942(Synechococcussp.PCC7942)由中国科学院植物研究所惠赠,转vp19基因聚球藻7942由本实验室构建。使用含有卡那霉素的BG-11(+N)培养基[16],在35℃、光照强度2 000—2 500 lx下,135 r∕min振荡培养聚球藻。
1.2 主要仪器和试剂
FTC-3000实时荧光定量PCR系统(Canada Funglyn Biotech Inc.公司),氧电极(Hansatech,UK)。总RNA提取试剂盒、RNA反转录试剂盒、电泳凝胶回收试剂盒购自天根生化科技(北京)有限公司。KAPA通用型SYBR快速定量试剂盒购自上海捷易生物科技有限公司。TAE电泳缓冲液、硫酸卡那霉素、氨苄青霉素、感受态大肠杆菌购自生工生物工程(上海)股份有限公司。一抗(兔多抗)由艾比玛特生物医药(上海)有限公司设计合成,二抗(山羊抗兔)购自艾比玛特生物医药(上海)有限公司,HRP-DAB底物显色试剂盒购自天根生化科技(北京)有限公司。
1.3 方法
1.3.1 Western Blot法检测VP19蛋白表达
取对数生长期的转vp19基因聚球藻7942,置于-20℃冰箱冷冻12 h,4℃解冻后再放进-20℃冰箱冷冻,反复冻融3次后,于8 000 r∕min离心取上清,即为藻蛋白样品。用Bradford法测定蛋白浓度后上样,60 V下进行浓缩胶电泳30 min,120 V下进行分离胶电泳2 h[17],5%脱脂奶粉封闭后在100 V条件下转膜2 h,一抗二抗孵育,然后显影。
1.3.2 转基因聚球藻目的基因相对含量计算
根据GenBank上登记的对虾白斑综合征病毒核酸序列(AJ937860.1),以WSSV病毒DNA为模板扩增vp19基因(引物见表1),电泳分离、鉴定后对产物测序。以WSSV的DNA作为模板克隆出vp19基因,回收纯化后连接到pGEM-T质粒载体上转入感受态大肠杆菌中,在含氨苄抗生素的LB液体培养液中筛选。扩培筛选成功的大肠杆菌,提取质粒,将浓度稀释10倍后,计算双链DNA浓度和拷贝数[8]。

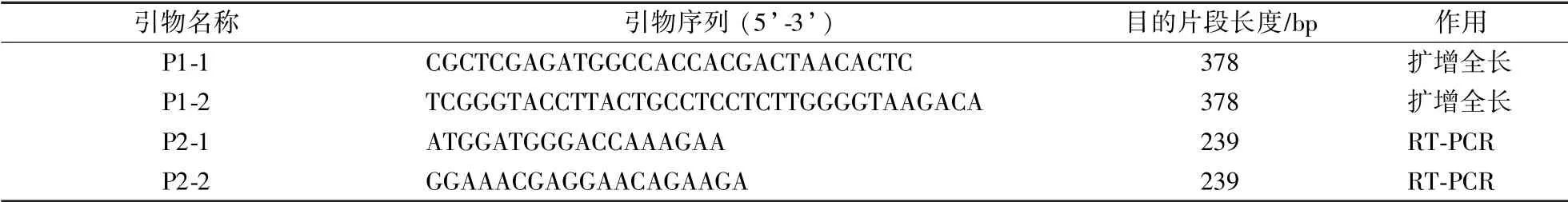
表1 扩增vp19基因的引物序列Table 1 Primer sequence for amplification of vp19 gene
取不同参数组合的转基因型聚球藻样品,提取样品总RNA,并反转录成cDNA,进行RT-qPCR扩增。将Ct值通过标准曲线计算log拷贝数的值,计算样品拷贝数和样品DNA浓度,并以聚球藻干重为底计算百分比含量[8]。
1.3.3 转基因藻光合放氧活性计算
光合速率使用氧电极测定,温度由恒温水浴箱通过循环水控制。取对数期藻细胞,把上样样品叶绿素质量浓度调至10μg∕mL,用氧电极测定转vp19基因型聚球藻7942在不同光照、温度、收集天数下的光合放氧活性[18]。其计算公式:

其中,V:放氧活性,μmol O2∕(mg Chl·h);S:斜率,min-1;K:常数,表示一定温度下水中的溶氧量mol O2∕mL;P:叶绿素质量浓度,mg∕mL。
取藻样于4 000 r∕min离心10 min,去上清液;加入90%(体积分数)甲醇充分混匀,在室温下萃取2 h,置于4℃下8 h,4 000 r∕min离心10 min取上清,测定OD665吸光值。计算样品的叶绿素含量[19]:Chl(μg∕mL)=13.9×OD665。
1.3.4 数据分析
数据处理和图表绘制采用Excel 2017软件和SPSS 24.0软件。试验数据为平均值±标准误(n=3),所有数据均为正态分布数据(S-W检验)。利用SPSS 24.0软件,采用独立样本t检验进行对照组和处理组之间均值比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 转基因聚球藻7942中VP19蛋白的表达
使用Western Blot方法检测转vp19基因型聚球藻7942中VP19蛋白的表达,从处于对数生长期的野生型和转vp19基因型聚球藻7942中提取藻蛋白,测量蛋白浓度后保证每个泳道都有10μg的上样量。如图1所示,转vp19基因型聚球藻7942中有VP19蛋白表达,野生型聚球藻7942中没有VP19蛋白表达。
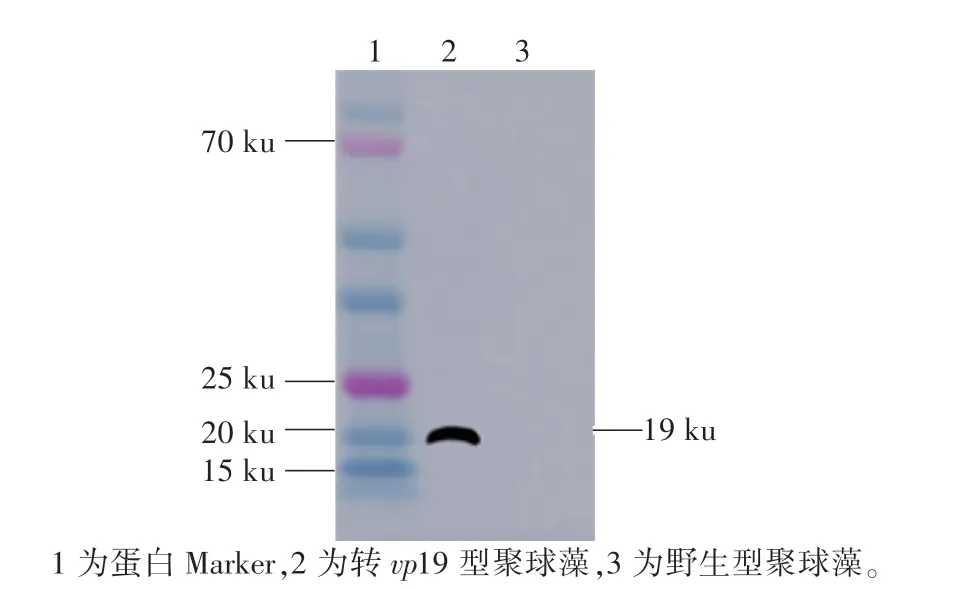
图1 野生型和转v p19基因型聚球藻7942中VP19的蛋白印迹Fig.1 Western Blot of VP19 protein in wild type and transgenic Synechococcus sp.PCC7942
2.2 转基因聚球藻中vp19基因的表达效率
2.2.1vp19基因片段扩增
以WSSV病毒DNA为模板,使用引物P1(表1)扩增vp19基因,用2%琼脂糖电泳检测,对产物切胶纯化回收。由图2可知,扩增出383 bp的DNA特异性条带,与目的片段长度吻合。
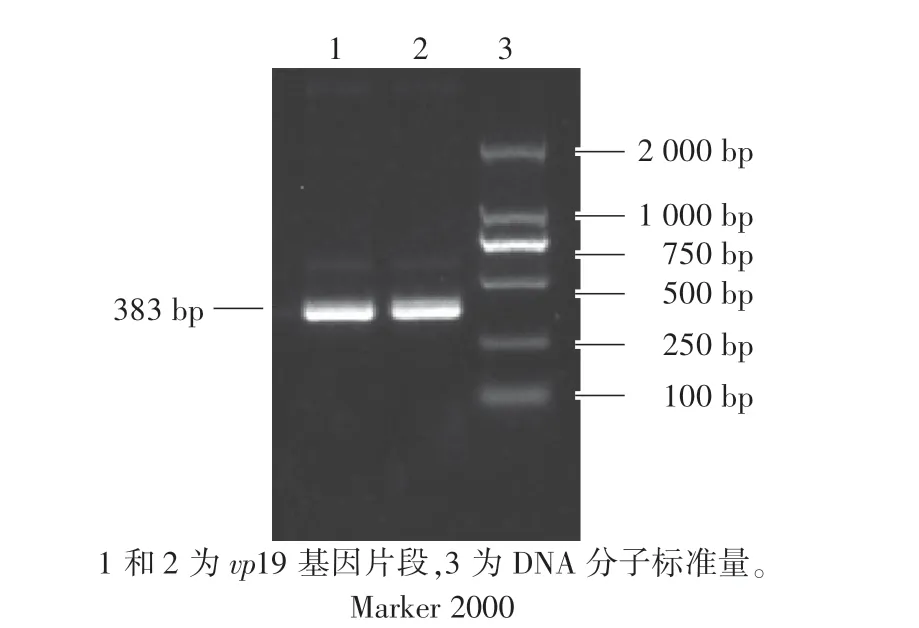
图2 PCR产物的琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of PCR products
2.2.2vp19基因片段标准曲线绘制
将纯化回收后的vp19基因片段10倍梯度逐级稀释后,使用引物P2(表1)进行实时荧光定量PCR扩增,得到标准曲线(图3)。标准品的初始拷贝数为4.5×1010copies∕μL。
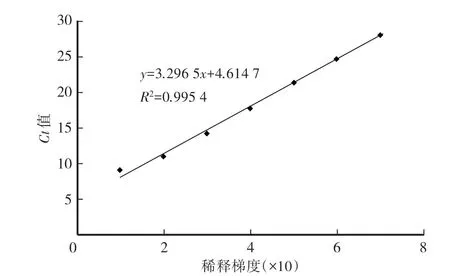
图3 纯化回收的vp19基因片段标准曲线Fig.3 Standard curve of purified vp19 gene fragment
2.2.3 转基因型聚球藻7942中vp19基因的表达效率
取接种3 d、6 d、9 d、12 d、15 d、18 d的转vp19基因型聚球藻7942,分析其不同生长时期vp19基因的表达效率,得到不同生长时期转vp19基因型聚球藻的Ct值、相对表达效率及蛋白产率(表2)。
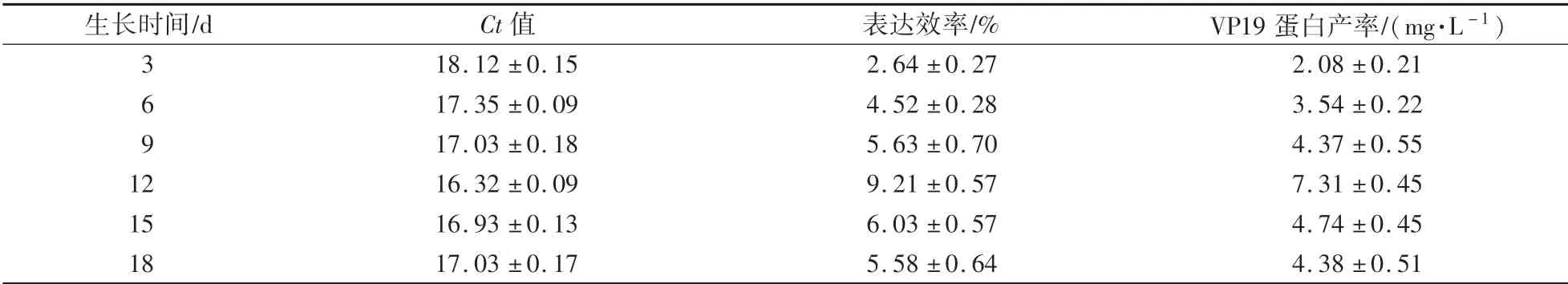
表2 不同生长时期转基因型聚球藻7942中vp19基因的Ct值、相对表达效率及蛋白产率Table 2 Ct value,relative expression rate and protein yield of vp19 gene in transgenic Synechococcus sp.PCC 7942 at different growth stages
由图4可知,进入对数生长后期(约12 d)的转vp19基因型聚球藻7942表达率最高,可达到9.2%,VP19蛋白产率达到7.31 mg∕L。
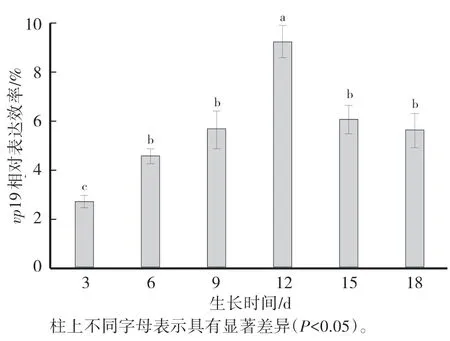
图4 不同生长时期转基因型聚球藻中vp19基因的相对表达率Fig.4 Relative expression rate of vp19 in transgenic Synechococcus sp.PCC 7942 at different growth stage
由上述结果可知,转基因聚球藻7942中vp19基因表达量相对较高,开发该藻作为口服疫苗可以降低生产成本,因此对其最适生长条件进行研究。
2.3 转基因聚球藻7942的生长和光合曲线
2.3.1 聚球藻7942生长曲线及产率
如图5所示,野生型聚球藻7942的生长从第4天开始迅速增加,转vp19基因型聚球藻7942的生长则是从第3天开始逐渐增加,说明转vp19基因型聚球藻比野生型聚球藻有更好的适应能力,能在接种后迅速繁殖。转vp19基因型聚球藻的细胞密度比野生型聚球藻大,可以看出转入基因后对聚球藻的生长具有促进作用,在第7天生长率最大提高了16.9%。在第20天,转vp19基因型聚球藻的生物量达到5.42 g∕L,野生型聚球藻7942的生物量达到5.07 g∕L,转基因型相对于野生型提高了6.9%。
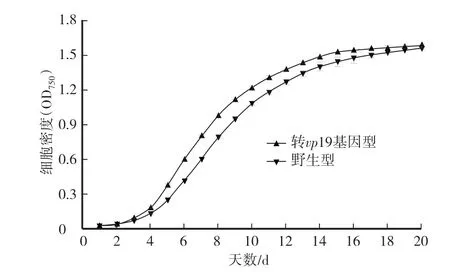
图5 野生型和转vp19基因型聚球藻7942的生长曲线Fig.5 Growth curve of wild type and transgenic vp19Synechococcus sp.PCC 7942
在一定程度上,藻的OD750值可以反应出最终收集到干藻的质量,两者之间呈线性关系(图6),因此可以根据OD750值计算出干藻质量,再根据转基因的表达率,进而确定VP19蛋白的质量。
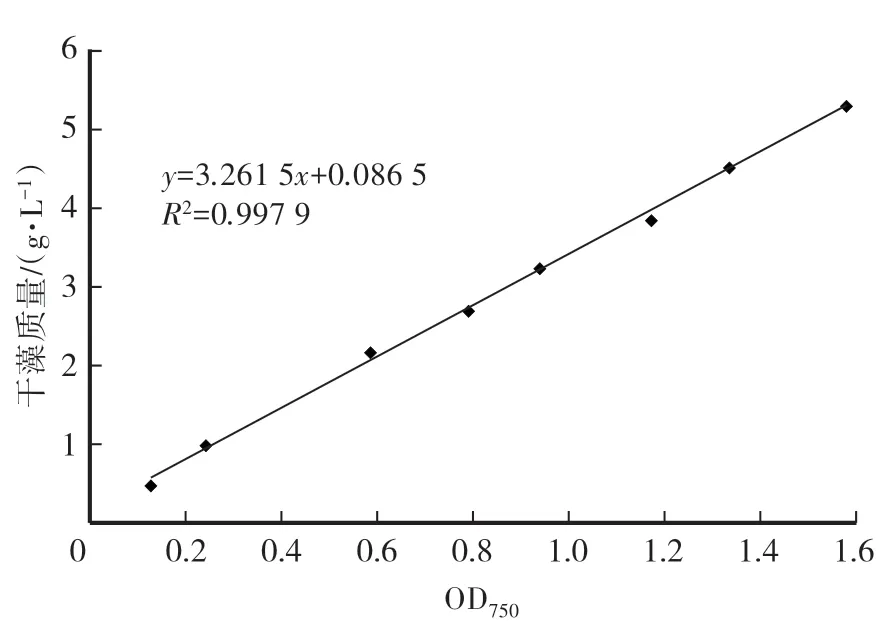
图6 转基因聚球藻7942的OD750和干藻质量的关系Fig.6 Relationship between dry weight and OD750 of transgenic Synechococcus sp.PCC 7942
2.3.2 温度、光强、pH、盐度对转vp19基因聚球藻7942光合作用的影响
从图7a可知,野生型聚球藻和转基因聚球藻对温度的响应一致。放氧活性均在38℃达到最高,野生型聚球藻和转基因聚球藻的净光合速率分别为59.2μmol∕(m2·s)和65.1μmol∕(m2·s)。之后的下降趋势表明,40℃以上高温对聚球藻的生长有抑制作用。通过图7a的纵向对比可以发现,转基因藻在高温时净光合速率下降快于野生型藻。
如图7b所示,野生型聚球藻在光照强度为1 500 lx时到达光饱和点,此时的净光合速率为50.1μmol∕(m2·s),野生型聚球藻在光照强度为2 250 lx时到达光饱和点,此时的净光合速率为62.4μmol∕(m2·s)。光强达到3 000 lx后,野生型聚球藻和转基因型聚球藻均出现光抑制现象。相对于野生型聚球藻,转基因型聚球藻的光饱和点有所提高,净光合速率也提高了19.7%。
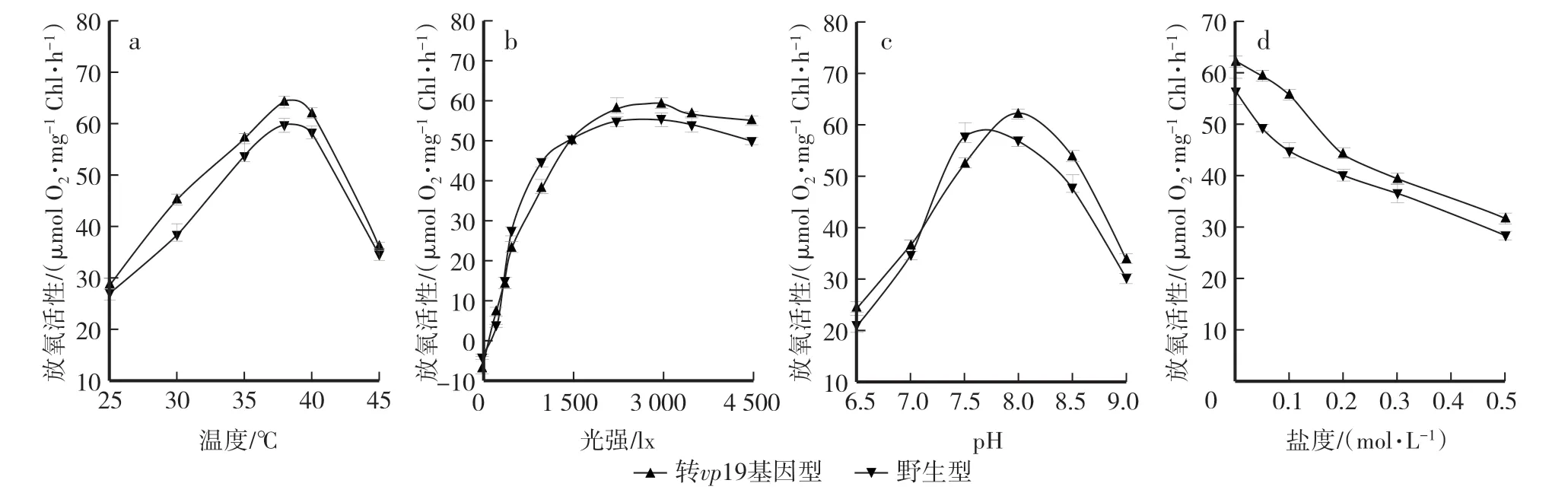
图7 环境因子对野生型与转vp19基因型聚球藻7942光合作用的影响Fig.7 Effects of environment factors on photosynthesis of wild type and transgenic vp19 Synechococcus sp.PCC 7942
野生型聚球藻和转vp19基因型聚球藻对pH的响应趋势较为一致。由图7c可知,野生型聚球藻的最适pH为7.5,转vp19基因型聚球藻的最适pH为8.0。
由图7d可知,两者最适的盐度均为0 mol∕L NaCl,转vp19基因型聚球藻比野生型聚球藻对盐度的抗性高。在到达0.1 mol∕L NaCl之前,转vp19基因型聚球藻光合速率的下降趋势相对野生型聚球藻较缓。
3 结论与讨论
本研究表明,采收天数是决定目的基因表达的关键因素,进入对数生长后期的转vp19基因型聚球藻7942表达率最高,达9.2%,VP19蛋白产率达7.31 mg∕L。这与目前的研究结果相同[8,10],可能是细胞不同生长阶段的主要功能不同,光合作用产物在前期主要用于合成结构物质,到对数生长期后,细胞内基因倾向于分泌特异性的RNA和蛋白,进入分化状态;到稳定期后,细胞功能老化,吸收的养分有限,基因表达量下降。朱嘉诚[20]也认为蓝藻细胞在不同生长阶段的主要功能不同,到达对数生长期后转为合成分泌目的蛋白。
在转vp19基因聚球藻7942的培养过程中,藻细胞的活力是决定微藻接种后能否正常生长的重要因素之一[21]。一定程度上,放氧活性可以体现蓝藻细胞新陈代谢的活性,温度、光强、pH、盐度是影响放氧活性的重要环境因素。通过氧电极法对聚球藻的生理活性进行分析,确定了转vp19基因型聚球藻的最适生长条件为:温度38℃,光照强度2 500 lx,pH 8.0,盐度0 mol∕L NaCl。相对于野生型聚球藻7942,转vp19基因型聚球藻7942的光强和pH有所提高,可以通过控制这两个条件筛选转基因藻。
本研究通过RT-PCR检测vp19基因在聚球藻7942不同生长阶段的表达,确定了转基因藻的最佳采收时间,避免盲目收集,节约了培养成本,还可为对虾攻毒实验的转基因藻用药剂量提供依据。蓝藻作为对虾的天然饵料,转vp19基因型聚球藻既可以作为饵料又可以作为免疫口服剂,表达率高、传代效率好、成本低的口服疫苗有更加广阔的应用市场。
