响应面法优化超声辅助浸提葡萄籽原花青素
2021-08-27李瑞丽张玎婕赵琪王惠妹徐如彦
李瑞丽,张玎婕,赵琪,王惠妹,徐如彦
(1.郑州轻工业大学烟草科学与工程学院,河南 郑州 450001;2.江苏中烟工业有限责任公司技术中心,江苏 南京 210019)
原花青素(procyanidins,PC)是由儿茶素或表儿茶素缩合而成的生物类黄酮,作为天然强有效的自由基清除剂,能有效清除·OH、O2-·、NO·、DPPH·等多种自由基,具有舒张血管、降血糖、降血脂[1-3],抑制肾、肠功能障碍、提高记忆力[4-6],及抗肥胖、美白等作用[7-10],尤其是原花青素的低聚体,其保健功能更是受到人们的广泛关注[11-13]。
葡萄籽、松树皮、蔓越桔等植物中PC含量丰富,自然界的PC多以氢键、疏水键与植物蛋白、多糖结合的形式存在,因此,从植物中提取PC多选用极性溶剂[11,14]。响应面优化设计可将因变量与多个自变量的二次函数关系用响应面直观展示并确定最优条件或最优区域,是解决天然产物有效成分提取过程中多变量问题的有效统计方法[15-19]。
超声波由于其空化效应、机械效应使得天然产物细胞壁破裂,有效成分可快速高效地溶出,在天然产物提取中具有耗时短、效率高等独特优势[20-24]。但其热效应会导致体系局部过热,对于热敏性较差的目标产物有一定的破坏作用。因此,提出利用低频短时超声处理结合恒温水浴的方法萃取葡萄籽中PC,缩短提取周期,提高提取效率,同时降低对目标产物的破坏性。
1 材料与方法
1.1 材料与试剂
葡萄籽:葡萄酒厂下脚料;儿茶素标准品、表儿茶素标准品(>98%):天津尖峰天然产物研究开发有限公司;香草醛、甲醇、浓盐酸、无水乙醇(分析纯):天津市大茂化学试剂厂。
1.2 仪器与设备
Agilent1260Infinity型高效液相色谱仪:美国Agilent公司;722G分光光度计:上海精密科学仪器有限公司;SB-3200DT超声波萃取仪:宁波新芝生物科技股份有限公司;DF-101S恒温加热磁力搅拌器:巩义市瑞利仪器设备有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 样品前处理
取适量葡萄籽,40℃电热鼓风干燥箱中烘干(≥6.0 h),植物粉碎机粉碎,过40目筛,密封,备用。
1.3.2 葡萄籽原花青素提取
称取一定量的葡萄籽粉末,加入适量一定浓度的乙醇溶液,室温(20℃)下超声辅助提取一定时间,然后恒温热回流浸提一定时间,离心处理取上清夜,即为葡萄籽PC提取液。
1.3.3 单因素试验
1.3.3.1 提取时间对PC提取率的影响
称取葡萄籽粉末5.00g,加入70%乙醇溶液60mL,室温(20℃)下超声处理20 min,80℃恒温水浴热回流提取 0.5、1.0、1.5、2.0、2.5 h,测定葡萄籽 PC 提取率。
1.3.3.2 提取温度对PC提取率的影响
称取葡萄籽粉末5.00g,加入70%乙醇溶液60mL,室温(20 ℃)下超声处理 20 min,分别在 50、60、70、80、90℃恒温水浴中热回流提取2.0 h,测定葡萄籽PC提取率。
1.3.3.3 乙醇浓度对PC提取率的影响
称取葡萄籽粉末5.00 g,加入乙醇溶液60 mL,室温(20℃)下超声处理20 min,80℃恒温水浴中热回流提取1.0 h,乙醇浓度分别为40%、50%、60%、70%、80%,测定葡萄籽PC提取率。
1.3.3.4 液料比对PC提取率的影响
称取葡萄籽粉末5.00 g,分别添加70%乙醇溶液30、45、60、75、90 mL,室温(20 ℃)下超声处理 20 min,80℃恒温水浴中热回流提取1.0 h,测定葡萄籽PC提取率。
1.3.4 响应面优化试验
根据Box-Behnken中心组合试验设计原理,在单因素试验基础上,提取时间、提取温度、乙醇浓度、液料比各优选3个水平(见表1),采用四因素三水平响应面分析法优化PC提取条件。

表1 响应面优化因素水平Table 1 The factor level design of response surface optimization
1.3.5 原花青素分析方法
香草醛-盐酸法测儿茶素、表儿茶素单体与原花青素总量:准确称取儿茶素5.0 mg,去离子水溶解并定容至 25.0 mL,分别移取 1.0、2.5、4.0、5.5、7.0 mL 儿茶素标准溶液去离子水定容至10.0 mL,得浓度分别为20、50、80、110、140 μg/mL 儿茶素标准溶液。取儿茶素标准溶液1.0 mL,依次加入40 g/L香草醛-甲醇溶液6.0 mL,浓盐酸3.0 mL,混合均匀,室温(25℃)避光反应15.0 h。以香草醛-甲醇溶液∶浓盐酸∶甲醇=6∶3∶1(体积比)的混合溶液为空白对照,在500 nm处测吸光度。拟合溶液吸光度(y1)与单体及PC浓度(x1)标准曲线:y1=0.001 7 x1-0.041,R2=0.998 0。用于测定葡萄籽提取液中单体与原花青素总量的浓度。
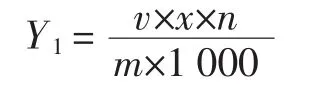
式中:Y1为提取物中单体与原花青素总量,mg/g;v为提取液体积,mL;x为提取液浓度,μg/mL;n为提取液稀释倍数;m为葡萄籽粉末质量,g。
高效液相色谱(high performance liquid chromatography,HPLC)法测儿茶素、表儿茶素单体的量:准确称取0.002 g儿茶素、0.002 g表儿茶素标准品于2 mL容量瓶,甲醇定容,然后依次稀释分别得到500、100、50、20、10 μg/mL标准溶液,HPLC测定峰面积,拟合色谱峰面积对数(y2)与儿茶素浓度(x2)、表儿茶素浓度(x3)的标准曲线方程:儿茶素y2=1.037 7x2-1.086 5,R2=0.999 6;表儿茶素 y2=1.053 6x3-1.384 2,R2=0.999 3。用于测定提取液中儿茶素、表儿茶素单体浓度。

式中:Y2为提取物中儿茶素、表儿茶素单体量,mg/g;v为提取液体积,mL;x2为提取液儿茶素浓度,μg/mL;x3为提取液表儿茶素浓度,μg/mL;n 为提取液稀释倍数;m为葡萄籽粉末质量,g。

1.4 数据处理
利用Excel2016、Origin 9.1进行单因素试验数据处理和绘图;利用Design-Expert 12.0软件进行响应面试验设计、响应曲面、等高线绘图及回归分析、方差分析和参数优化。
2 结果与分析
2.1 提取时间对PC提取率的影响
超声波的机械作用、空化作用及热效应是其加速天然产物有效成分提取的理论依据。空化作用、机械作用导致破壁使有效成分快速溶出,热效应可使溶液内部温度升高,利用超声波破壁作用的同时避免局部温度过高导致PC含量降低,采用超声处理20 min,然后恒温水浴热回流浸提的方式提取,提取时间对PC提取率的影响见图1。
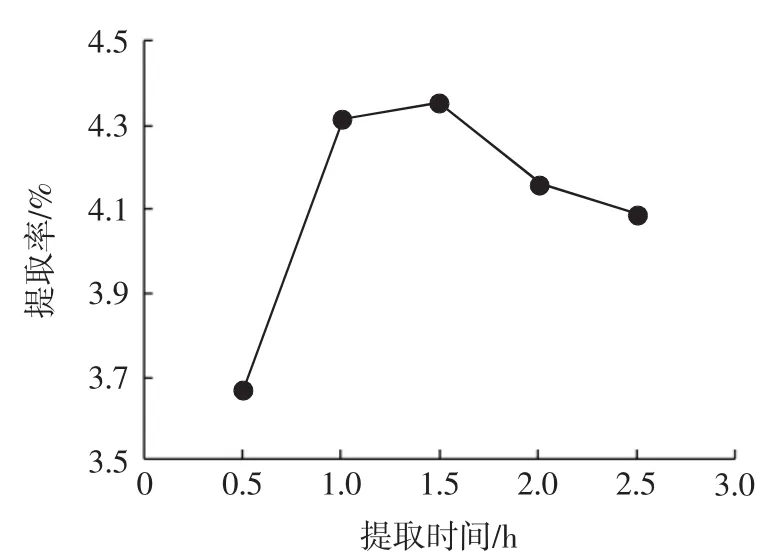
图1 提取时间对PC提取率的影响Fig.1 Influence of extraction time on the yield of PC
由图1可知,提取时间小于1.5 h时,随提取时间延长,葡萄籽PC提取率逐渐增加,但增幅逐渐减小,这是由于葡萄籽粉末与溶剂中PC的浓度差逐渐缩小所致。提取时间超过1.5 h后,PC提取率反而略降。提取时间1.0 h时,PC在葡萄籽粉末与溶剂中的传质基本上达到动态平衡。
2.2 提取温度对PC提取率的影响
提取温度对PC提取率的影响见图2。

图2 提取温度对PC提取率的影响Fig.2 Influence of extraction temperature on the yield of PC
由图2可知,当提取温度低于70℃时,葡萄籽PC提取率随提取温度增加呈增加趋势,温度升高利于传质效率增加,可加快有效成分溶出速度,但杂质的溶出也会增加。同时,由于葡萄籽PC热稳定性较差,高温处理如90℃超过12 h或50℃超过24 h,葡萄籽提取物中PC含量明显减少。提取温度超过70℃后,PC提取率不升反降,90℃时反应液微有沸腾现象,PC提取率明显下降。提取温度为70℃时,PC的提取率相对最大。
2.3 乙醇浓度对PC提取率的影响
根据天然产物萃取中的相似相溶原理,乙醇溶液与PC极性越接近越利于PC从葡萄籽粉末溶出到乙醇溶液中。乙醇浓度对PC提取率的影响见图3。

图3 乙醇浓度对PC提取率的影响Fig.3 Influence of ethanol volume on the yield of PC
由图3可知,PC提取率随浓度增加呈先增大后减小的趋势,乙醇浓度为50%~60%时,PC提取率相对较大。
2.4 液料比对PC提取率的影响
液料比对PC提取率的影响见图4。

图4 液料比对PC提取率的影响Fig.4 Influence of liquid-solid ratio on the yield of PC
溶剂用量与PC提取率呈正相关关系,由图4可知,随溶剂用量的增加,PC提取率逐渐增大,液料比达到15∶1(mL/g)时,PC提取率达到最大。溶剂用量再增大,对目标产物的提取率影响很小,负面作用是在增加溶剂成本的同时杂质溶出量增加不利于后续精制提纯,因此液料比以 15∶1(mL/g)为宜。
2.5 响应面优化试验
2.5.1 试验方案及试验结果
根据Box-Behnken中心组合试验设计原理,在单因素试验基础上,提取时间、提取温度、乙醇浓度、液料比各优选3个水平,采用四因素三水平响应面分析法优化PC提取条件。响应曲面试验设计方案及试验结果见表2,其中,第25至29号试验是各因素中心点组合的重复试验,用于评估试验误差。

表2 响应曲面试验设计方案及试验结果Table 2 The experimental design and results of response surface analysis
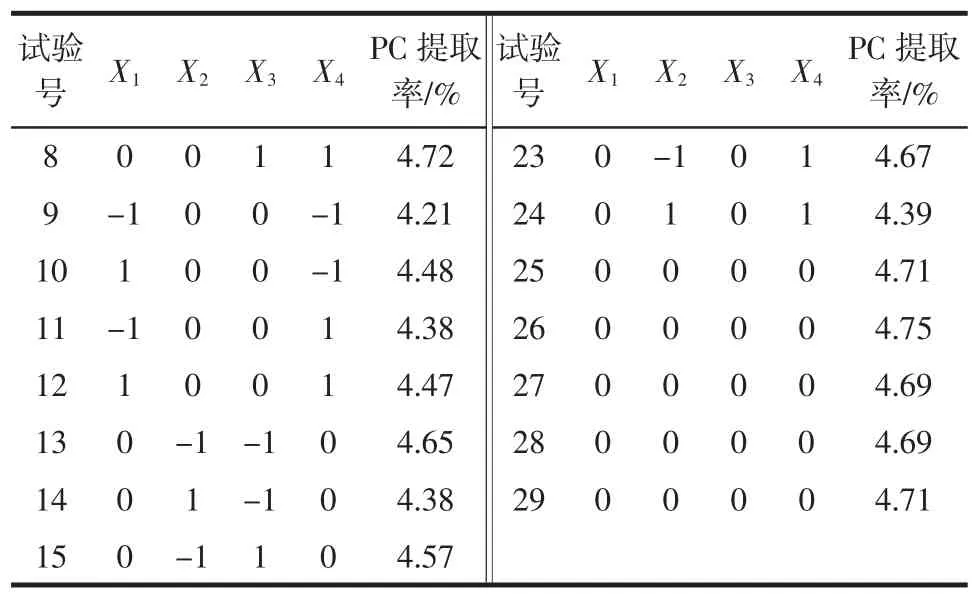
续表2 响应曲面试验设计方案及试验结果Continue table 2 The experimental design and results of response surface analysis
2.5.2 回归模型及方差分析
通过对响应面优化试验结果数据进行多元回归分析,建立PC提取率与提取时间、提取温度、乙醇浓度、液料比这4个因素的回归模型。PC提取率回归方程:Y=-5.23+2.98X1+0.17X2+0.02X3+0.27X4+0.004X1X2-0.01X1X3-0.03X1X4+0.000 4X2X3-0.000 6X2X4+0.000 1 X3X4-0.95X12-0.000 1X22-0.000 4X32+0.009X42。
回归模型方差分析结果见表3。

表3 方差分析结果Table 3 ANOVA results of quadratic model
由表3可知,显著性检验中,回归模型P<0.000 1,失拟项P=0.174 3,即回归模型极显著而失拟不显著,说明PC提取率与各因素的回归模型有统计学意义,而且没有其它对PC提取率影响显著的因素被忽略。R2和调整R2均在0.95以上,模型拟合度较好且有良好的预测性,可在模型基础上进行结果分析和方案优化,明确超声辅助提取葡萄籽PC的最优工艺。
PC提取率与各因素的回归模型中,X1、X2的一次项和二次项的P值均小于0.000 1;X4的一次项的P值小于0.001,二次项的P值小于0.000 1;X3的一次项的P值远大于0.05,二次项的P值小于0.01;说明提取时间、提取温度是影响葡萄籽PC提取率的主要因素,液料比次之,乙醇浓度对葡萄籽PC提取率的影响相对较小。提取时间与乙醇浓度、提取时间与液料比、乙醇浓度与液料比的交互作用对葡萄籽PC提取率有显著影响。其它因素间的一级交互作用P值均大于0.05,对PC提取率无显著影响。
2.5.3 响应曲面分析
各因素交互作用响应曲面图及其在底面的投影(即等高线图)见图5。
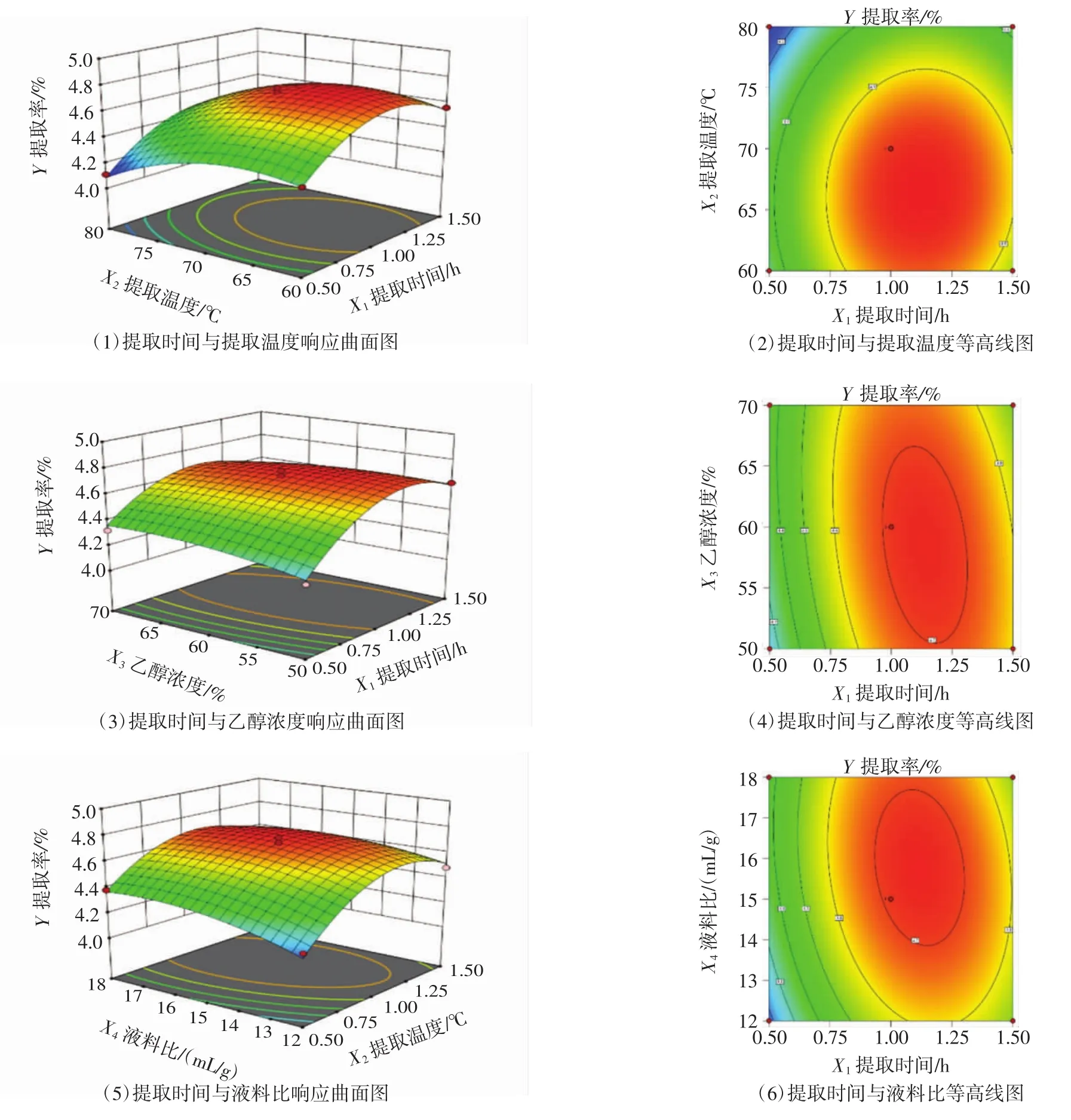
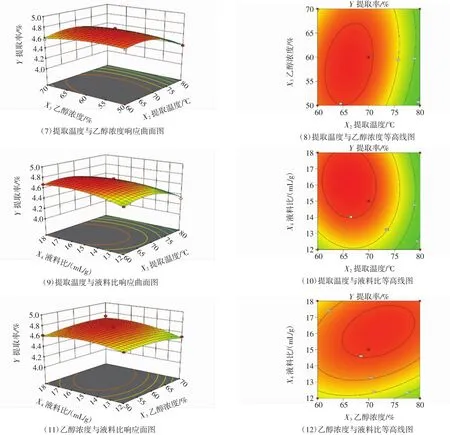
图5 各因素交互作用响应曲面图和等高线图Fig.5 The interaction effect and contour on extraction rate of PC between two factors
由图5可知,随提取时间延长、提取温度升高,葡萄籽PC提取率均呈逐渐增大的趋势,到达因素中心值以后,提取率随时间延长、温度升高反而减小,提取温度升高导致的PC提取率下降更为明显。随乙醇浓度、液料比增大,PC提取率基本均呈逐渐增加的趋势。对比响应曲面图的陡缓趋势,提取时间对提取率的影响较大,其次是提取温度,再次是液料比,而乙醇浓度响应曲面相对平缓,说明乙醇浓度对提取率的影响相对较小。对比各因素交互作用的等高线图,提取时间与乙醇浓度、提取时间与液料比的交互作用影响较大,等高线为椭圆形,其次是提取温度与乙醇浓度、乙醇浓度与液料比的交互作用,等高线为近似椭圆形;而提取时间与提取温度、提取温度与液料比的交互作用影响较小,等高线近似圆形。这与回归模型方差分析的结果一致,利用响应面优化设计可明确提取时间、提取温度、乙醇浓度和液料比等因素对葡萄籽PC提取率的影响。
在研究范围内,响应面分析回归模型预测葡萄籽PC提取率最高的工艺条件为室温(20℃)下超声处理20 min后,水浴热回流提取时间1.15 h,提取温度67.78℃,乙醇浓度 50.06%,液料比 15.92∶1(mL/g),回归模型预测此条件下的PC提取率为4.713%。其次为室温(20℃)下超声处理20 min后,水浴热回流提取时间1.0 h,提取温度70℃,乙醇浓度60%,液料比15∶1(mL/g),回归模型预测此条件下的PC提取率可达4.710%。两种工艺条件下PC提取率相差很小,仅为0.003%,兼顾试验条件实际操作,确定最优工艺条件为室温(20℃)下超声处理20 min后,水浴热回流提取时间1.0 h,提取温度70℃,乙醇浓度60%,液料比15∶1(mL/g)。最优工艺条件下重复3次试验,葡萄籽PC提取率为4.68%,与模型预测值4.71%接近,RSD为1.22%。说明响应面优化工艺可重复性较好,工艺可靠。
3 结论
超声辅助结合恒温水浴萃取葡萄籽PC的过程中,提取时间对葡萄籽PC提取率的影响较大,其它依次是提取温度、液料比,乙醇浓度对提取率的影响相对较小。响应面优化的最佳工艺条件为室温(20℃)下超声处理20 min,水浴热回流提取时间1.0 h,提取温度 70℃,乙醇浓度 60%,液料比 15∶1(mL/g)。在此条件下3次验证试验,PC提取率均值为4.68%,与模型预测值4.71%接近,RSD为1.22%。该提取工艺设备要求不高,且工艺有良好的重现性和可操作性。PC作为天然的抗氧化剂,应用前景和开发潜力较大。下一步工作考虑分离PC低聚物单体,研究其抗氧化活性,探索PC低聚体中对抗氧化活性贡献较大的主要单体。
