糙米酒低温后发酵期的菌种演替及挥发性风味物质变化
2021-08-27欧阳德文宁亚丽吴跃
欧阳德文,宁亚丽,吴跃
(中南林业科技大学食品科学与工程学院,稻谷及副产品深加工国家工程实验室,湖南 长沙 410004)
糙米酒是以糙米为原料,在蒸煮的米饭或熬煮的糙米浆中添加酒曲或者接入多菌种微生物发酵而成的低酒精度产品,其营养和风味成分较常规米酒更为丰富,米香浓郁、酒味清爽、柔和适口,富含谷胱甘肽等多种功能性营养成分[1]。但由于其发酵变化更为复杂,产品品质较难控制,所以一直以来较难形成产业规模。
这些年随着发酵等相关科学的进一步发展,国内外研究学者再次关注糙米酒的研发,其主要是对糙米酒工艺的研究,比如苏佳佳等[2]利用模糊数学感官评价法对糙米酒的制备工艺进行优化,并利用气相色谱-嗅闻-质谱(gaschromatography-olfactometry-massspectrometry,GC-O-MS)对其挥发性成分进行分析,经过对比得出糙米酒风味物质比糯米酒更加丰富。Kuo等[3]将挤压膨化处理过的糙米,加入酒曲发酵,通过与浸泡蒸煮后的糙米制备的糙米酒进行对比,发现挤压膨化处理过的糙米制备出的糙米酒,其酒精产量提高了12.4%。Park等[4]用发芽糙米和辣椒制备糙米酒,发现添加10%~50%的辣椒较为适宜,其中20%的添加量接受度高,既增加了风味又平衡了口感;辣椒糙米酒中主要挥发类物质为乙酸乙酯、1-丙醇、2-甲基-1-丙醇、3-甲基丁醇和苯乙醇。日本早前也有利用糙米为原料,添加乳酸与葡萄酒酵母制成糙米葡萄酒,成品风味酸甜适中,果香宜人[5]。
制作发酵酒会经历3个主要阶段,包括发酵(fermentation)、后发酵(postfermentation)和陈化(aging)。对于一些葡萄酒的生产,也会将后发酵和陈化过程合二为一。在糙米酒发酵过程中,之所以能够保持一定的酒精度,并产生适宜的风味口感,是因为大量微生物的生理作用,其中主要的微生物种类为霉菌、酵母菌、乳酸菌及醋酸菌等[6]。霉菌、酵母和细菌能产生大量的酶,用于细胞代谢和小分子生成,这些酶也有助于最终产品的风味形成[7]。糙米酒在发酵和后发酵过程中,微生物的代谢和生长对糙米酒的风味起到了决定性的作用。新酿造的糙米酒,酯类的香气成分刺鼻,口感具有一定刺激性,经过一定时间低温后发酵期,新酒的刺激性气味方可消失,取而代之的是香气浓厚、口感清爽。因此短时间低温后发酵对糙米酒最终产品品质有至关重要的作用。酒的陈化过程可以促进醇分子之间的缔合,也可以促进醇分子与水分子的缔合,醇类和酸类的酯化反应也会加快[8]。酒的后发酵与陈化机理类似,主要区别在于后发酵中酒精度更低且主要风味物质成分的产生和变化主要依赖于微生物的代谢作用。典型的陈化作用是依赖于高酒精度下发生的一系列化学变化,这些变化会影响挥发性化合物和酚类化合物,例如葡萄酒在陈化过程中成分的复杂性会增加,感官特征也发生了变化[9-10]。
本文借助高通量测序和气质联用技术,对不同后发酵期的糙米酒菌种和挥发性物质进行对比研究,确定后发酵期的优势菌种和具有独特风味的挥发性物质,以及糙米酒最佳后发酵期,为多菌种发酵糙米酒提供新的思路和科学借鉴,也为糙米酒生产提供技术支持和理论指导。
1 材料与方法
1.1 材料与试剂
有机糙米:黑龙江省和粮农业有限公司;霉菌(米根霉、总状毛霉)、酵母(酿酒酵母、库德里阿兹威毕赤酵母Ⅰ、库德里阿兹威毕赤酵母Ⅱ、库德里阿兹威毕赤酵母Ⅲ)、乳酸菌(戊糖片球菌、干酪乳杆菌Ⅰ、干酪乳杆菌Ⅱ、短乳杆菌):中南林业科技大学食品学院A304实验室在酒曲中筛选所得;DNA抽提试剂盒:美国Omega Bio-Tek公司;2%琼脂糖凝胶:西班牙biowes公司;FastPfu DNA聚合酶:北京全氏金生物科技公司;DNA片段回收试剂盒:美国Axygen公司;土壤基因组DNA提取试剂盒:美国MP Biomedicals生物医学公司。
1.2 仪器与设备
NanoDrop2000超微量分光光度计:美国Thermo Fisher Scientific公司;DYY-6C电泳仪:北京六一仪器厂;ABI GeneAmp®9700型PCR仪:美国ABI公司;Biotek ELx800酶标仪:美国Biotek公司;Illumina Miseq测序仪:美国 Illumina公司;65 μmPDMS/DVB 固相微萃取头、手动固相微萃取装置:美国Supelco公司;7890B-7000C气相色谱串联质谱-质谱联用仪:安捷伦科技有限公司。
1.3 方法
1.3.1 糙米酒样品制备
称取一定量的糙米浸泡12 h,米水比为1∶5(质量比)置于电饭煲进行熬煮4 h,趁热分装至蓝盖瓶中,每瓶分装100 g米汤混合物。将总状毛霉和米根霉按3∶2(体积比)的比例接种入瓶内,总接种量为5%,先在28℃下发酵2 d;后将酿酒酵母、库德里阿兹威毕赤酵母Ⅰ、库德里阿兹威毕赤酵母Ⅱ、库德里阿兹威毕赤酵母Ⅲ4 种酵母菌按 5∶2∶2∶1(体积比)接种入瓶,总接种量为10%,后在28℃下发酵3 d;再将戊糖片球菌、干酪乳杆菌Ⅰ、干酪乳杆菌Ⅱ、短乳杆菌4种乳酸菌按1∶1∶1∶1(质量比)接种入瓶,总接种量为 10%,在 37 ℃发酵下发酵2 d。最后样品置于4℃下分别进入后发酵期 7、14、18、21、28 d,取不同后发酵时间的样品进行菌种和风味物质含量测定。
1.3.2 糙米酒样品总DNA提取及聚合酶链式反应(polymerase chain reaction,PCR)扩增
将后发酵样品混匀后,吸取15 mL离心(4 000×g,10 min),收集沉淀在-80℃冷冻备用。
DNA的抽提和PCR扩增:根据土壤基因组DNA提取试剂盒说明书进行总DNA抽提,利用1%琼脂糖凝胶电泳检测DNA抽提质量;用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 806R(5′-GGACTACHVGGGTWTCTAA-3′)对细菌16S的V3-V4可变区进行PCR扩增,用引物 ITS1F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS2区域进行PCR扩增。
扩增反应体系(20 μL):5×FastPfu Buffer 4 μL,2.5 mol/L dNTPs 2 μL,DNA 模板 10 ng,DNA 聚合酶0.4 μL,5 μmol/L 上下游引物 0.8 μL,ddH2O 补至 20 μL。
扩增反应程序:95℃预变性3 min,95℃变性30 s,48℃退火 30 s,72℃延伸 4 s(30次循环),最后 72℃延伸10 min。
1.3.3 糙米酒样品中微生物Illumina Miseq测序
使用2%琼脂糖凝胶回收PCR产物,利用DNA片段回收试剂盒纯化,Tris-HCl洗脱,2%琼脂糖电泳检测,利用QuantiFluorTM-ST进行检测定量。再将纯化后的扩增片段构建基因文库。最后在Miseq PE300平台进行上机测序,在上海美吉生物医药科技有限公司完成。
1.3.4 测序数据处理
将原始测序序列优化后,使用UPAR SE软件(version7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类,利用核糖体数据库项目分类器(ribosomal database project classifier,R DP classifier)(http://rdp.cme.msu.edu/)对每条序列比对细菌SILVA数据库(SSU123)和真菌UNITE数据库进行分类学注释。
1.3.5 挥发性物质提取
将65 μm的PDMS/DVB固相微萃取头在气相端进样口于250℃老化至无杂峰,取6mL酒样置于20mL样品瓶中,加入2.0 g氯化钠,压紧瓶盖,于60℃磁力搅拌器上10 min,然后将固相微萃取(solid phase micro extraction process,SPME)头插入到样品瓶中顶空吸附40 min,随后取出萃取头,立即插入气相端进样口中于250℃解吸2 min。
1.3.6 GC-MS分析
色谱条件:HP-5 MS色谱柱(30 m×0.25 mm×0.25 μm),载气 He(纯度 5 个 9),流量 1 mL/min,MMI进样口,直接进样,进样口温度250℃,柱温:起始温度40℃,保持2min,以5℃/min升温至250℃,保持5min。质谱条件:接口温度250℃,离子源温度230℃,电离方式电子电离源,电子能量70 eV,扫描质量范围40 amu~400 amu,扫描时间300 ms。将 GC-MS检测的数据用MassHunter定性软件打开,通过软件自动积分,按质谱图解和NIST14.L谱库检索(美国国家标准研究院2014谱库)对化合物进行卷积和分析(匹配度大于80),并使用面积归一化法计算各成分相对百分含量。
1.4 数据处理
根据Barcode标签将下机数据拆分成不同样品,去除Barcode序列和PCR扩增引物序列。使用FLASH(version 1.2.7)软件,通过对所有参与拼接的序列进行两两对比,计算其序列间的重叠关系,并对每个样品的序列进行拼接,得到原始序列标签数据(Raw Tags),再使用Trimmomatic(version 0.33)软件,对原始序列标签数据进行过滤,得到高质量的序列标签数据,最后使用UCHME v4.2软件,鉴定并去除嵌合体,得到最终有效数据。
将最终有效数据用QIIME(version 1.8.0)软件中的UCLUS集群方法在97%的相似度水平下进行OTU聚类,利用 Mothur(version v.1.30)软件对样品的 α-多样性进行评估,并基于细菌SILVA和真菌UNITE分类学数据库对OTU进行分类学注释,生成不同分类水平上的物种丰度表,再利用Origin绘制样品各分类学水平下的群落结构图。
2 结果与分析
2.1 α-多样性分析
α-多样性反映了单个样品内部物种的多样性,指标有 Sobs指数、Shannon指数、Simpson指数、Ace指数、Chao指数和Coverage指数等,通过这些指标可对样品微生物物种的丰富度和多样性进行评估[11-12]。其中,Sobs指数用来估计群落中的操作分类单元(operational taxonomic units,OTU)数目,OTU值是为了便于系统分析,人为给某一个分类单元(品系、属、种、分组等)设置的统一标志。通过对样本序列进行聚类,将序列按照彼此的相似性分归为许多小组,每个小组就是一个OTU;Shannon指数用于衡量群落的异质性;Simpson指数代表随机取样的两个体系属于不同种的概率,其值越小,代表样品物种分布越均匀;Ace指数和Chao指数越大,群落的丰富度越高;Coverage指数用来测量通过检测和测序得到的物种覆盖率[13],Coverage指数越高,代表样品的序列在文库中检出的程度越高。在后发酵期的5个糙米酒样品共获得细菌优化序列227 207条,共聚合了108个OTU,真菌优化序列357 823条,共聚合了33个OTU。
所有样品的α-多样性指数如表1所示。
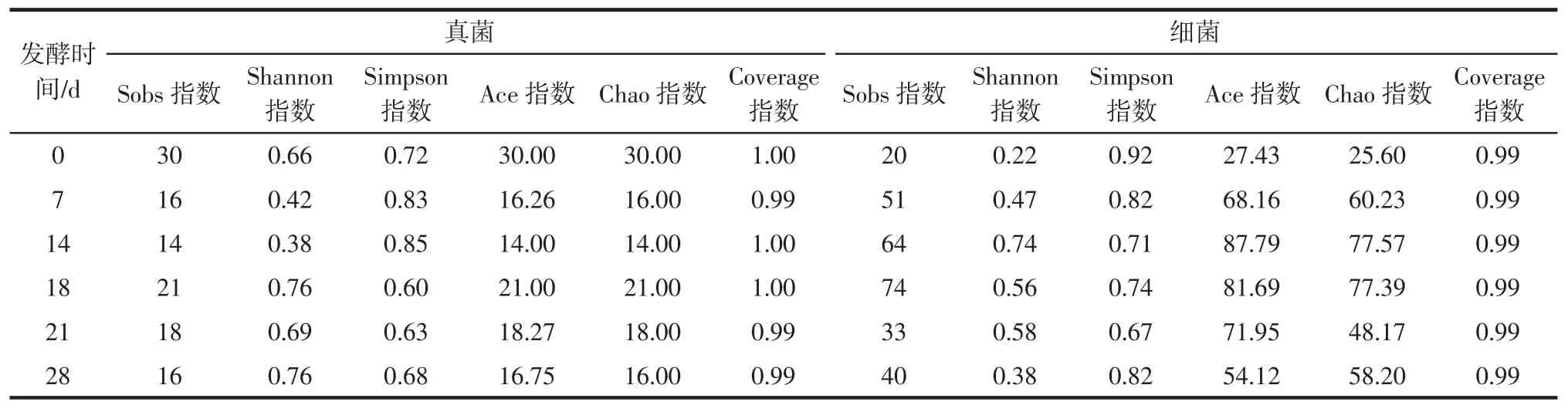
表1 不同后发酵期糙米酒样品的微生物α-多样性指数Table 1 Microbial α-diversity index of brown rice wine at different postfermentation stages
由表1可知,不同后发酵期样品中真菌和细菌α-多样性均存在明显波动。其中,后发酵18 d样品中真菌Sobs、Shannon、Ace和 Chao指数均最大,而 Simpson指数最小,说明后发酵18 d样本的真菌群落物种丰富度、生物多样性和物种的均匀程度都是最好。与真菌相同,细菌的最大Sobs值也出现在18 d。有区别的是,细菌最大Shannon、Ace和Chao指数出现在14 d,而最小的Simpson指数出现在21 d。总体来说,细菌和真菌群落的Coverage指数都大于0.9,证明样品中的序列基本能在文库中检出,样本的测序结果也更具分析价值。后发酵期的样品中真菌的Shannon指数和Simpson指数不断在波动,但总体是不断向微生物多样性更高和分布更均匀方向波动的。但样品的细菌Shannon指数和Simpson指数是先升后降和先降后升,代表细菌的微生物多样性和物种丰富度是先升后降的,与真菌有所区别。
2.2 糙米酒后发酵期真菌菌种演替
不同后发酵期的糙米酒样品内真菌菌种在门、属、种水平下的结构分布见图1。
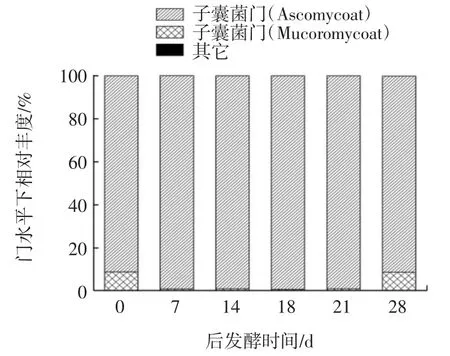
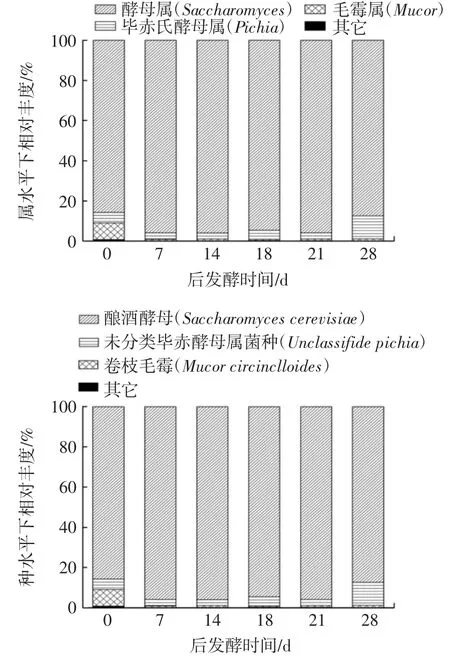
图1 不同后发酵期糙米酒样品真菌门、属、种水平下结构分布Fig.1 Fungal structure of phylum,genus,and species levels of brown rice wine samples at different postfermentation stages
由图1中门水平下真菌相对丰度可知,真菌隶属的两个门分别为子囊菌门(Ascomycota)和毛菌亚门(Mucromycota),发酵最初接种的霉菌米根霉和总状毛霉均隶属于毛菌亚门,发酵接种的酵母菌属于子囊菌门,其中子囊菌门在所有样品的平均丰度值最高,为99%左右,而毛菌亚门丰度值在0.6%~1.07%之间波动,说明子囊菌门在糙米酒后发酵期的真菌菌种结构占有重要地位,为绝对优势菌种。在属水平下,图中给出了丰度前3的菌种,其他丰度占比较小的均合并在其它类。如图1所示,糙米酒中主要真菌菌种有酵母属(Saccharomyces)、毕赤氏酵母属(Pichia)和毛霉属(Mucor),其中酵母属占绝对优势地位为93.90%左右,在28 d后发酵期毕赤氏酵母属相对丰度从3%提升到了11%,提高近4倍;毛霉属在糙米酒中后发酵初期含量为8.32%,而随着糙米酒后发酵的进行,毛霉属14 d时丰度低至0.8%左右,且后期一直保持不变。总体而言,酵母属在整个后发酵阶段都占有绝对主导地位,毕赤氏酵母属在后发酵第28天相对丰度较前期呈波动性增加,毛霉属处于低水平。
在种水平下,主要的真菌菌种为酿酒酵母(Saccharomyces cerevisiae)、未分类毕赤氏酵母属菌种(Unclassified pichia)、卷枝毛霉(Mucor circinelloides)。其中,酿酒酵母菌为绝对优势菌种,平均丰度达到了93.90%。而随着后发酵的延长,毕赤氏酵母属菌种的相对丰度呈现增加趋势,在后发酵第28天时,未分类毕赤氏酵母属菌种的相对丰度增长了4倍左右,达到了11.47%。而卷枝毛霉在后发酵期的14 d丰度显著降低,后一直保持不变,可能是由于酿酒酵母的生长抑制了卷枝毛霉的活性,后发酵期的风味变化应该主要取决于真菌中的酵母。酿酒酵母除了会将原料中的糖转化为酒精外,还能将原料中的氨基酸等前体物质转换为酯、酸、高级醇等风味物质[14]。但有研究表明,酿酒酵母会抑制产香酵母的生长,产香酵母也会抑制酿酒酵母的发酵能力,通常认为是酿酒酵母的代谢产物造成了产香酵母生长的不利条件,包括产酸与乙醇,同时高密度的细胞也对产香酵母的增殖造成了消极影响,但是两者混合发酵时总体的发酵水平下降不多,但乙酸乙酯等风味物质却大幅增加[15-16]。但根据研究结果,二者在分批接种发酵时,前期酿酒酵母占优势菌种地位,毕赤酵母属在前5 d未发现,在6、7 d增加,增加至5.21%,到了后发酵期,酿酒酵母仍是主要优势菌种,毕赤氏酵母属菌种的相对丰度也略有增加。酿酒酵母在酒类产品的应用十分广泛,不同菌株的组合还能使酿酒酵母的代谢发生变化,如酿酒酵母与植物乳杆菌和Oenococcus oeni菌株组合还对苹果酸消耗和代谢物生产有影响[17]。
2.3 糙米酒后发酵期细菌菌种演替
不同后发酵期的糙米酒样品内细菌菌种在门、属、种水平下的结构分布见图2。
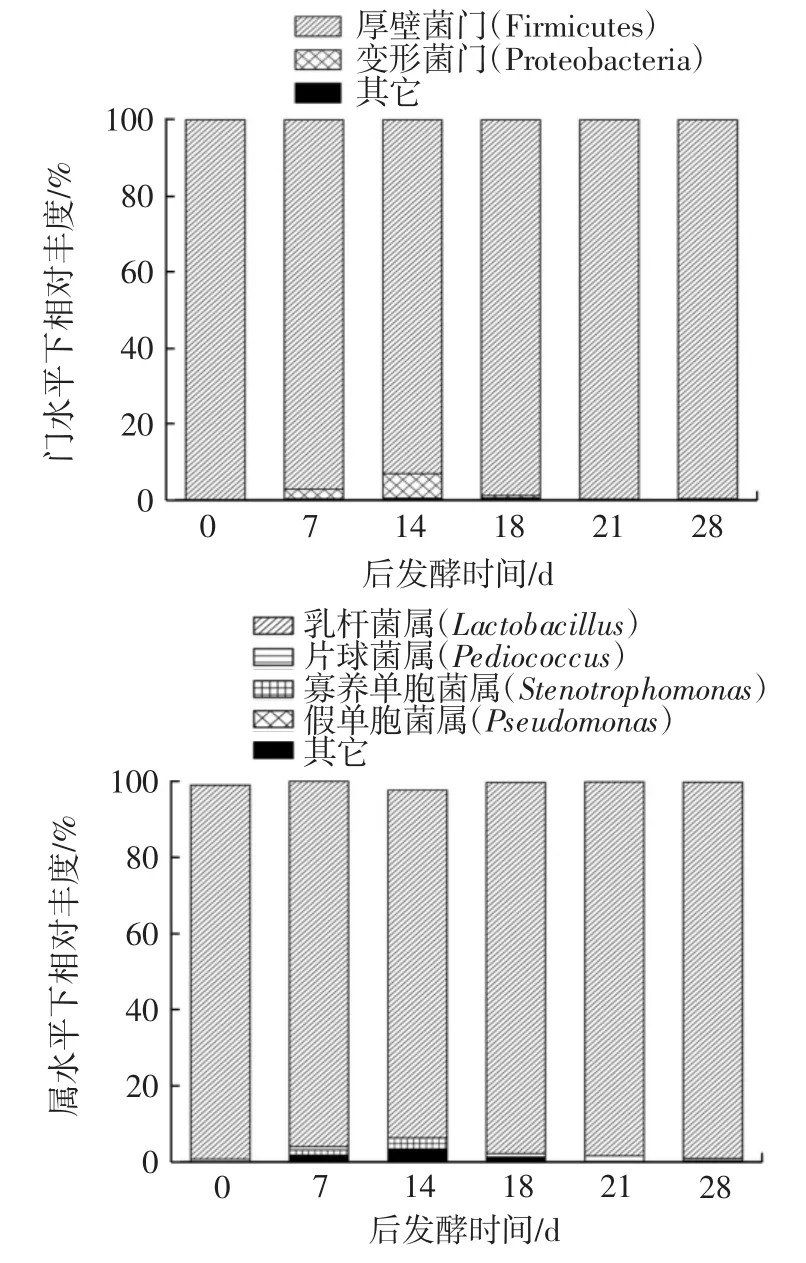
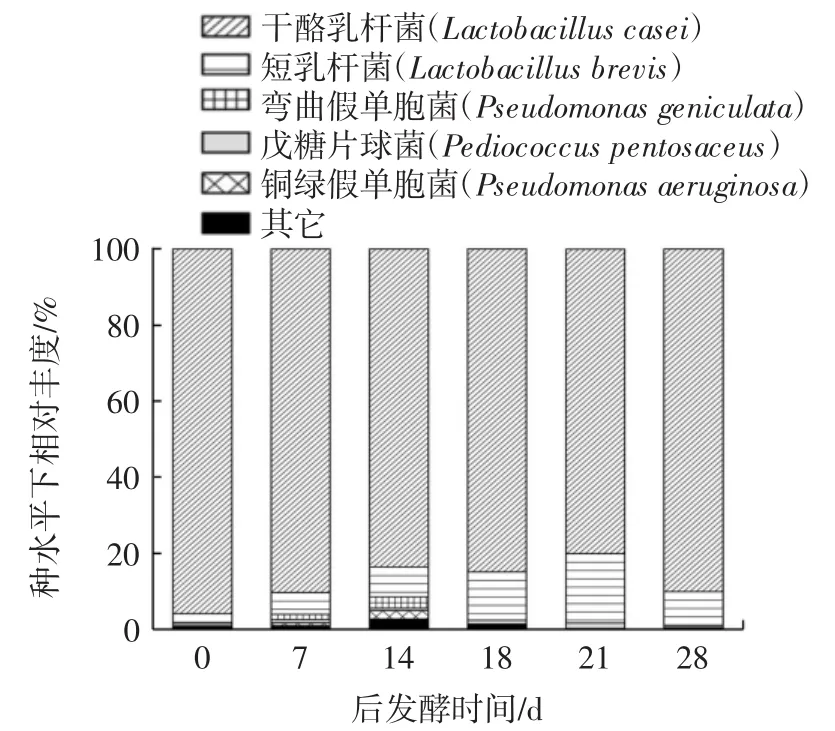
图2 不同后发酵期糙米酒样品细菌门、属、种水平下结构分布Fig.2 Bacterial structure of different phylum,genus,and species levels of brown rice wine samples at different postfermentation stages
由图2中门水平下细菌相对丰度可知,主要细菌优势菌门分别是厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),发酵最初接种的细菌为1株戊糖片球菌、2株干酪乳杆菌和1株短乳杆菌均隶属于厚壁菌门,且厚壁菌门是米酒后发酵期的绝对优势菌种,平均相对丰度达到了97.90%,而变形菌门是污染的外来菌种相对丰度由最初的0.029%升至第14天的6.50%,第18天急剧下降至0.6%,到后发酵21 d几乎不能被检出。在属水平下,糙米酒中后发酵期主要细菌菌属为发酵时添加的乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)以及外来污染的寡养单胞菌属(Stenotrophomonas)和假单胞菌属(Pseudomonas)。其中整个后发酵期的乳杆菌属是绝对优势细菌种,而且在糙米酒发酵过程中,乳杆菌属也是优势菌种,有研究表明其与米酒的酸度高度相关,是发酵中产生酸的关键细菌[18]。而发酵添加的片球菌属从发酵结束一直到整个后发酵期的丰度极低,最高值是21 d的1.40%。后发酵第14天,寡养单胞菌属和假单胞菌属的相对丰度达到最高,分别平均为2.14%和1.48%,但在后期骤然递减至几乎没有,可能是由于寡养单胞菌属和假单胞菌属都属于专性需氧菌,后发酵过程中,体系氧气不断被消耗,二者丰度降低。也有研究表明,假单胞菌减少的原因可能是它不能发酵葡萄糖,所以后发酵的后期糖源减少时假单胞菌属相对丰度也随之减少[19]。
在种水平下,主要细菌菌种为干酪乳杆菌(Lactobacillus casei)、短乳杆菌(Lactobacillus brevis)、戊糖片球菌(Pediococcus pentosaceus)、弯曲假单胞菌(Pseudomonas geniculata)、铜绿假单胞菌(Pseudomonas aeruginosa)。其中,发酵时添加的干酪乳杆菌在后熟期相对丰度一直处于80%以上,为绝对优势菌种。有研究表明,在利用固定化酿酒酵母生产葡萄酒时,通过添加固定化的干酪乳杆菌使得葡萄酒中的苹果酸降解,乙酸乙酯浓度显著增加[20]。干酪乳杆菌在食品生产中的应用十分广泛,可发酵产生有机酸、细菌素等多种抑菌物质[21],还可能对改善肠道健康有所帮助。
发酵时添加的短乳杆菌在后发酵期丰度存在明显波动,由0 d的5.77%增长至18 d的18.20%,但在21 d时显著降回了8.88%,且戊糖片球菌在发酵结束后和整个后发酵期丰度极低,最高值出现在21 d为1.4%,说明可能是其它菌种创造出不利于戊糖片球菌生长的环境,或是其它乳酸菌产生的细菌素对其生长产生了抑制作用[22]。
作为杂菌的弯曲假单胞菌和铜绿假单胞菌在发酵结束后,其丰度极低几乎检测不到,但随着后发酵期的延长,在第14天时二者丰度明显增加达到最大,分别为2.94%和2.26%。但到后发酵第18天,二者丰度骤减,与属水平下丰度变化相似,可能是由于后发酵过程中氧气消耗或是由于不能利用糖源,使得这两类专性好氧菌数量减少。后发酵期第7天时能检测到外来细菌,此后几乎检测不到,细菌多样性的结果说明,污染的外来细菌在适当的后发酵期内自然被抑制,说明选择合适的后发酵期可以避免杂菌的滋生,有利于产品安全。
2.4 糙米酒后发酵期挥发性风味物质变化
糙米酒后发酵期挥发性风味物质变化见表2。
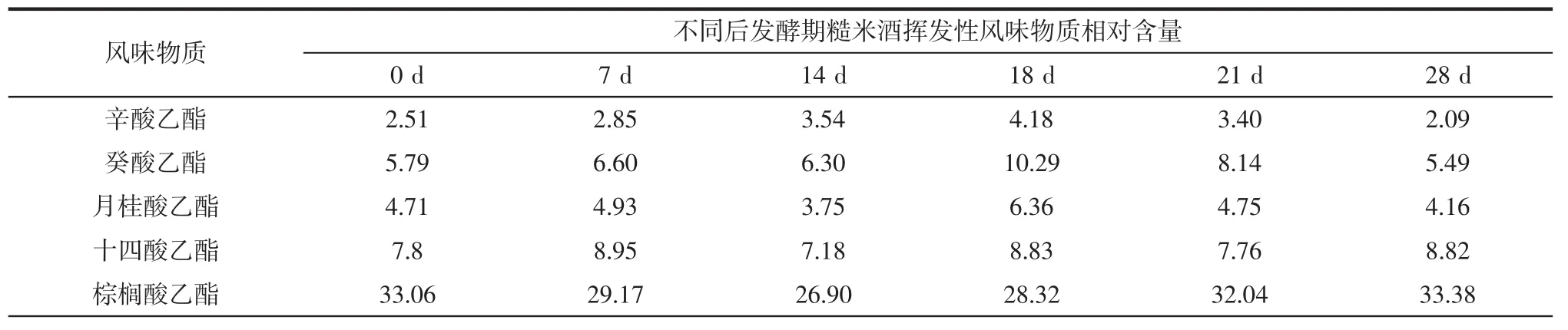
表2 不同后发酵期糙米酒样品挥发性风味物质Table 2 The volatile flavor substances of brown rice wine samples at different postfermentation stages %

续表2 不同后发酵期糙米酒样品挥发性风味物质Continue table 2 The volatile flavor substances of brown rice wine samples at different postfermentation stages %
如表2所示,利用气相色谱-质谱技术分析糙米酒后发酵阶段样品共检测出45种挥发性物质,其中相含量最高、种类最多的化合物是酯类,其次是醇类,最后分别是酮类和酚类。
酯类物质主要有11种,包括辛酸乙酯、癸酸乙酯、月桂酸乙酯、十四酸乙酯、棕榈酸乙酯、亚油酸乙酯、油酸乙酯、松香酸乙酯、硬脂酸乙酯、琥珀酸二乙酯、异氰酸甲酯,这些化合物大部分属于乙酯类,说明乙酯类化合物在挥发性物质组成上占有十分重要的地位。相对含量最高的棕榈酸乙酯在后发酵阶段的含量先降后升,0~14 d由33.06%降至 26.90%,14 d~28 d增加至33.38%;亚油酸乙酯0~7 d在6~7%之间波动,后发酵第28天为12.36%;油酸乙酯仅存在于后发酵第7天和第21天样品中,相对含量分别为4.38%和4.39%。棕榈酸乙酯、亚油酸乙酯、油酸乙酯通常被称为白酒中三大高级脂肪酸酯,广泛存在白酒中,能使酒体变得清甜醇香、舒适优雅[23]。其中,棕榈酸乙酯普遍含量最高,与本研究结果一致,其具有微弱蜡香、奶油香气,可以增加酒体的醇厚感,降低酒的涩味,增加余味。癸酸乙酯具有椰子香型香气,其相对含量在后发酵期内先增加后降低,峰值出现在第18天样品中,为10.29%。具有花果香气的月桂酸乙酯也呈现波动性变化,峰值同样出现在第18天样品中,为6.36%。同样具有水果香气的辛酸乙酯的峰值也出现第18天的样品中。香气分值(odour threshold values in air,OVA)代表了复合浓度与其感官检测阈值的比值,有研究表明,在白酒和樱桃酒中辛酸乙酯与癸酸乙酯的香气分值较大,呈香也较为明显,表现出这两种酯对整体香气的贡献度较高[24-25]。酯类化合物能提供水果味和花香味,且随着酯类物质碳原子的增加,水解速率常数降低,酯类化合物也愈发稳定[26],而检测出的酯类物质碳原子都在8个及以上,都相对不容易水解。另外,有研究报道,发酵酒包括米酒、黄酒中会广泛产生一种致癌物氨基甲酸乙酯(ethyl carbonate,EC)[27],是米酒酿造过程中主要通过尿素与乙醇的自发反应而产生,在本研究中未检测到此挥发性酯类物质。
糙米酒后发酵样品中醇类物质主要有β-苯乙醇、正癸醇、2-甲基-1-丁醇。其中,β-苯乙醇在样品中普遍相对含量最高为13.84%~23.94%,峰值出现在第14天的样品中。正癸醇的最高和最低相对含量分别为1.23%、0.37%。而2-甲基-1-丁醇在后发酵的14 d出现,相对含量为8.55%,此后又消失。β-苯乙醇是白酒、黄酒、葡萄酒、米酒等各类酒类中重要的风味物质,是老白干水溶性组分中香气贡献最大的香气物质,具有优雅、醇香的玫瑰花香味还是其他风味物质的前体物质[28]。β-苯乙醇主要是由酵母菌生长代谢合成,可以由不同的产香菌株合成,其中有多种酵母具有合成β-苯乙醇能力,如酿酒酵母、毕赤酵母和异常汉逊酵母等,有研究表明,毕赤酵母可以通过艾氏途径生成β-苯乙醇且对于β-苯乙醇的产生能力最为优秀,还可以生成己酸乙酯等一系列风味物质[29]。正癸醇通常也存在于黄酒、白酒、葡萄酒等各种发酵酒中,略有玫瑰和橙花气味。醇类物质在酒类风味中占重要的地位,是酒的助香剂,也是形成其他香类物质的前体,虽然含量少,但是为酒提供了十足的风味。
酮类和酚类挥发性物质在糙米酒中含量比较低,且大多数在整个后发酵阶段并非一直存在。2,2,3-三甲基环丁酮在后发酵第0天样品中出现为8.89%,此后未检测出。甲基乙烯基酮含量在第7天样品中出现为8.21%,此后也未检测出。甲基酮具有成熟奶酪特有的香味,可由脂肪酸通过酶氧化脱羧(β-氧化)形成。因此,糙米中大量的脂肪酸可能是发酵糙米样品中甲基酮产量增加的原因[30]。2,5-二叔丁酚在后发酵期第18天至第28天出现,相对含量均在1.0%左右。
酒的香气特征是决定其质量和价值的重要指标,挥发性特征和感官特性影响了消费者对酒的偏好[31]。从结果可知,随糙米酒后发酵时间的延长,酯类和醇类是其主要的香气成分。酯类物质相对含量在60%~80%左右变化,醇类物质相对含量在15%~30%左右变化,其中棕榈酸乙酯、β-苯乙醇、十四酸乙酯、亚油酸乙酯、癸酸乙酯、月桂酸乙酯、辛酸乙酯对糙米酒香味贡献较大。同时结合感官评价认为,在后发酵期第18天为本研究下的最佳后发酵期,其糙米酒样品,其口感清爽、香气浓郁并适合饮用。
3 结论
通过分批接种霉菌、酵母和乳酸菌发酵而成的糙米酒,在后发酵过程中占主导地位的是酵母和细菌,其中绝对优势菌种分别为酿酒酵母菌和干酪乳杆菌。在后发酵过程中发生的物理化学变化以及产生的风味物质都可能与这些菌种相关,这些菌种对糙米酒的风味和品质起到了至关重要的作用,而毕赤酵母是酒品中主要的产香和产酯酵母,为主要提供糙米酒风味的一类菌种。后发酵期内也出现了弯曲假单胞菌和铜绿假单胞菌杂菌,但随着后发酵的进程又出现消失的可能,因此,合适的后发酵期也有利于避免杂菌的滋生。糙米酒后发酵时主要风味物质为棕榈酸乙酯、β-苯乙醇、十四酸乙酯、亚油酸乙酯、癸酸乙酯、月桂酸乙酯、辛酸乙酯。通过整体的风味分析并结合感官评价可知,糙米酒后发酵期为18 d时风味最优,无明显杂菌生长,被认为是最佳后发酵期。这些结果对指导糙米酒的工业化生产开发,增强糙米酒酒香和风味提供了借鉴性数据,为开发出品质优良,口感丰富的糙米酒提供了理论支撑。
