小米酒对小鼠血清中相关抗氧化酶活性的影响
2021-08-27马吉瑶邹晓郑程远郭成宇石俊魏鸾萱张晓山王平
马吉瑶,邹晓,郑程远*,郭成宇,2,石俊,魏鸾萱,张晓山,王平
(1.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161000;2.黑龙江省果蔬杂粮饮品工程技术研究中心,黑龙江 齐齐哈尔 161000;3.黑龙江省北大仓集团有限公司,黑龙江 齐齐哈尔 161000)
小米又称为粟,北方称谷子,谷子脱壳为小米,其粒小,直径1 mm左右。小米是世界上最古老的栽培农作物之一,起源于中国黄河流域,是中国古代的主要粮食作物,在我国的农耕文明中占有举足轻重的地位[1-2]。小米营养价值高,营养全面均衡,主要含有碳水化合物、蛋白质及氨基酸、脂肪及脂肪酸、维生素、矿物质等[3-6]。研究表明,小米具有健脾胃功效,还可以治疗口臭,一定程度上缓解脚气,并兼具有美容功效[7-9]。中国最早的酒就是采用小米进行酿造的[10]。
小米酒是以小米为原料,基于传统酿造方法,采用现代工艺自主研发的一款黄酒,有文献表明,小米酒中富含碳水化合物、氨基酸、维生素和矿物质等营养物质,具有独特的生理功能[11-12]。本文旨在探究小米酒对小鼠血清中相关抗氧化物酶活性的影响,以期为小米酒的进一步开发提供理论依据。
1 材料与方法
1.1 材料与仪器
小米:黑龙江省齐齐哈尔市龙江县;小米原汁、小米酒:齐齐哈尔大学果蔬饮品研发中心;无水乙醇:重庆川东化工有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(glutathione,GSH)测定试剂盒:南京建成科技有限公司。
SPF级健康KM小鼠:重庆恩斯维尔生物科技有限公司,体重(20±2)g,6~8 周龄,36 只。
BS224S电子分析天平:赛多利斯科学仪器(北京)有限公司;101-1A型电热恒温鼓风干燥箱:天津市泰斯特仪器有限公司;HH-1数显电热恒温水浴锅:金坛市盛蓝仪器制造有限公司;85-1型恒温磁力搅拌器:深圳天南海北有限公司;XY-880型酒精密度计、0-100型100摄氏度的温度计:浙江余姚镇玻璃厂;DHG-9123A型电热恒温鼓风干燥箱:上海博讯实业有限公司;OSJ-DI-15L型纯水仪:苏州赛恩斯仪器有限公司;RT-6000酶联免疫检测仪:美国宝特Bio-Tek公司。
1.2 方法
1.2.1 小米酒的酿造
参考文献[13]的工艺流程进行小米酒的酿造。

1.2.2 小米酒酒精浓度测定
采用任凯等[14]酒精密度计法测定小米酒的酒精浓度。
1.2.3 剂量分组及动物处理
动物房昼夜交替,保持动物自由饮水、进食,温度23℃~25℃,湿度为(60±5)%,光照12 h/d,适应性喂养1周后进入实验。36只小鼠随机分成6组进行灌胃处理:空白组(0.2 mL生理盐水)、酒基对照组(0.2 mL 16.2%乙醇生理盐水)、阳性对照组(0.2 mL小米原汁,水米质量比2∶1,水温20℃~25℃,浸泡24 h得到小米原汁)、低剂量组(0.2 mL小米酒)、中剂量组(0.4 mL小米酒)、高剂量组(0.8 mL小米酒)。每天灌胃1次,连续灌胃30 d。
1.2.4 检测指标及方法
灌胃结束后,小鼠禁食不禁水12 h,10%水合氯醛(3 mL/kg)麻醉,腹主动脉取血,注入空白洁净试管内,4℃3 000 r/min离心15 min,分离血清,-70℃冻存待检[15]。应用全自动生化分析仪测定血清中SOD活力、GSH、MDA含量,检测时按试剂盒说明书进行具体操作。
1.3 数据处理
利用Origin8.0软件统计各参数的平均值和标准误差并作图,采用SPSS 18.0进行数据统计和单因素方差分析。组间差异性用t检验法分析。p<0.05为差异有统计学意义。
2 结果与分析
2.1 小米酒酒精浓度测定结果
经测定,小米酒酒精浓度为16.2% vol,用于后续酒基对照组浓度调控。
2.2 不同处理对小鼠体内GSH含量的影响
GSH是一种含γ-酰胺键和巯基的三肽,由谷氨酸、半胱氨酸及甘氨酸组成,几乎存在于身体的每一个细胞[16]。GSH分子具有活性巯基(-SH),是最重要的功能基团,可参与机体多种重要的生化反应,保护体内重要酶蛋白巯基不被氧化、灭活,保证能量代谢、细胞利用,因此,GSH含量越高说明机体抗氧化能力越强[17-18]。不同剂量小米酒对小鼠血清中GSH活性的影响见图1。

图1 不同剂量小米酒对小鼠血清中GSH含量的影响Fig.1 Effects of different doses of millet wine on GSH content in serum of mice
由图1可知,酒精会导致机体GSH含量下降,机体的抗氧化水平会减弱。但相较于酒基组,低剂量组显著升高(p<0.05),说明饮用同剂量的小米酒其抗氧化水平减弱程度要明显低于同等酒精浓度的酒基。随着小米酒灌胃剂量的增加,GSH含量越来越低。
2.3 不同处理对小鼠体内SOD活力的影响
SOD是生物体系中抗氧化酶系的重要组成成员,广泛分布在微生物、植物和动物体内[19-20]。SOD是生物体内存在的一种抗氧化金属酶,能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,与很多疾病的发生、发展密不可分。因此,机体内SOD活力越高其抗氧化能力越强[21-23]。不同剂量小米酒对小鼠血清中SOD活力的影响见图2。

图2 不同剂量小米酒对小鼠血清中SOD活力的影响Fig.2 Effects of different doses of millet wine on SOD activity in serum of mice
由图2可知,其变化趋势与GSH含量变化趋势相似,酒精的摄入会导致SOD活力下降,进而影响机体的抗氧化水平。但相较于酒基组,低剂量组会显著升高(p<0.05),SOD活力同样会随着小米酒摄入的量增加而递减,呈剂量依赖性。
2.4 不同处理对小鼠体内MDA含量的影响
生物体内自由基与脂质会发生氧化反应,生成具有细胞毒性的氧化终产物MDA,其会影响线粒体呼吸链复合物及线粒体内关键酶活性,加剧细胞膜受到的氧化应激损伤,因此,MDA含量越高说明机体的抗氧化能力越弱[24]。不同剂量小米酒对小鼠血清中MDA含量的影响见图3。
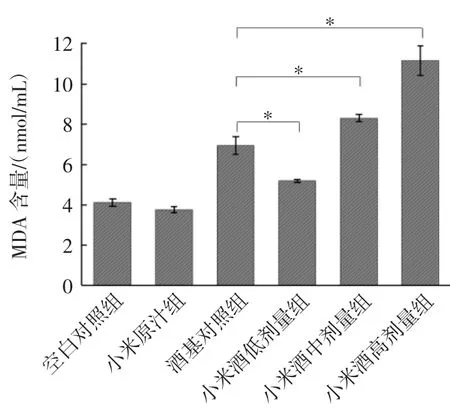
图3 不同剂量小米酒对小鼠血清中MDA含量的影响Fig.3 Effects of different doses of millet wine on MDA content in serum of mice
由图3可知,酒精的摄入会导致MDA含量的升高,机体的抗氧化能力减弱。但与酒基组相比,低剂量组MDA含量会显著降低(p<0.05),说明摄入同剂量的小米酒对机体造成的抗氧化损伤要显著低于同浓度的酒精。MDA含量同样与小米酒的摄入剂量呈依赖性,摄入越多,MDA含量越高,抗氧化能力越弱。
3 结论
以不同剂量的小米酒灌胃小鼠30 d后发现,酒精的摄入会降低机体GSH含量、SOD活力,提高MDA含量,进而导致机体抗氧化能力的减弱,且呈剂量依赖性。值得注意的是,与空白对照组和小米原汁组相比,无论是酒基组还是不同剂量的小米酒,都会显著降低机体的抗氧化能力,即饮酒会造成机体抗氧化能力损伤,增加疾病的风险。但与酒基组相比,低剂量的小米酒会显著减弱酒精对机体造成的抗氧化损伤,说明与同浓度的酒基相比,小米酒对机体的抗氧化损伤水平小于同浓度的酒精。因此,从机体抗氧化水平角度考虑,不饮酒好于饮酒,适当饮用小米酒好于同剂量浓度的酒精。
