古巴火烈鸟性别的鉴定
2021-08-27郭玉琦邓丽玲熊恒庆汪明权
郭玉琦,刘 浏,邓丽玲,熊恒庆,吴 磊,陈 蓉,汪明权*
(1.武汉市动物园,湖北 武汉 430050;2.南京市红山森林动物园,江苏 南京 210028)
火烈鸟,又名红鹳、红鹤,属于火烈鸟目,火烈鸟科,火烈鸟属,共三属六种,分别为大红鹳(Phoenicopterus roseus)(古巴火烈鸟)、智利火烈鸟(Phoenicopterus chilensis)、加勒比海红鹳(Phoenicopterus ruber)、小红鹳(Phoeniconaias minor)、秘鲁红鹳(Phoenicoparrus jamesi)、安第斯红鹳(Phoenicoparrus andinus)。火烈鸟外观多呈火红色、脖颈长而弯曲、体态优美,深受人们喜爱。火烈鸟属于非平胸类鸟,此类鸟不能从外观上判断雌雄,采用翻肛或者测定激素的方法困难较大,通常使用分子技术的手段鉴定性别。与哺乳动物不同,大多数鸟类的雌性染色体为ZW型,雄性染色体为ZZ型,因此既可以扩增W染色体上的特异序列,也可以比较Z、W上同源序列的差异。因此,扩增W染色体上特异性序列能够区分鸟类动物的雌雄。使用较多的性别连锁鉴定的基因主要有CHD基因和EE0.6序列。CHD基因基本上存在于所有非平胸类鸟类中,研究最为广泛,扩增成功率最高[1]。EE0.6是在鸡的W染色体上克隆的非传统型基因,包含EcoR1片段和一段类似外显子的序列ET15(很可能是一个假基因),由于其在W、Z染色体上有一段差异较大的同源序列,所以在很多鸟类性别鉴定中应用广泛[2]。武汉动物园自引进火烈鸟后一直未能繁殖,为探究缘由,本试验选取6对较为常用的鸟类性别鉴定引物,对武汉动物园未知性别的54只火烈鸟进行鉴定,并测试不同的反应条件和引物组也可以应用到其他鸟类的性别鉴定上,同时为武汉动物园火烈鸟的饲养管理和繁殖提供参考。
1 材料与方法
1.1 试验材料
54只来自武汉动物园未知性别的火烈鸟血样;3只已知性别的南京红山森林动物园的火烈鸟血样。
1.2 仪器与试剂
台式离心机(MIKRO)、PCR仪(AppliedBiosystem)、电泳仪(北京六一生物科技有限公司)、紫外分析仪(BIORAD)、DNA测序仪ABI3730(AppliedBiosystem)、磁珠纯化仪(Thermo)、分光光度计(Thermo)。
2×TaqPCRMasterMix(天一辉远生物科技公司)、PCR板(AXYGEN)、磁珠法口腔拭子基因组提取试剂盒(武汉纳磁生物科技公司)、Big Dye染料(AppliedBiosystem)、磁珠法PCR产物回收试剂盒(英芮城生化科技公司)。
1.3 试验方法
1.3.1 血样DNA的提取
血样收集到EDTA抗凝管中,加入200μL组织消化液GHA和20μL ProteinaseK。采用武汉纳磁生物科技磁珠法提取试剂盒提取血液中的DNA,产物经检测,OD值均在1.8~2.0之间,符合后续试验要求,DNA于4℃保存。
1.3.2 引物设计
采用鸟类通用的CHD基因引物对2550F/2718R、P2/P8;3007F/3112R及EE0.6基因3对引物SINT-F/SINT-R、USP1-F/USP1-R、CPE15F/CPE15R[1-2],引物设计见表1。对武汉动物园未知性别的54只火烈鸟和南京红山森林动物园已知性别的3只火烈鸟DNA进行特异性扩增。
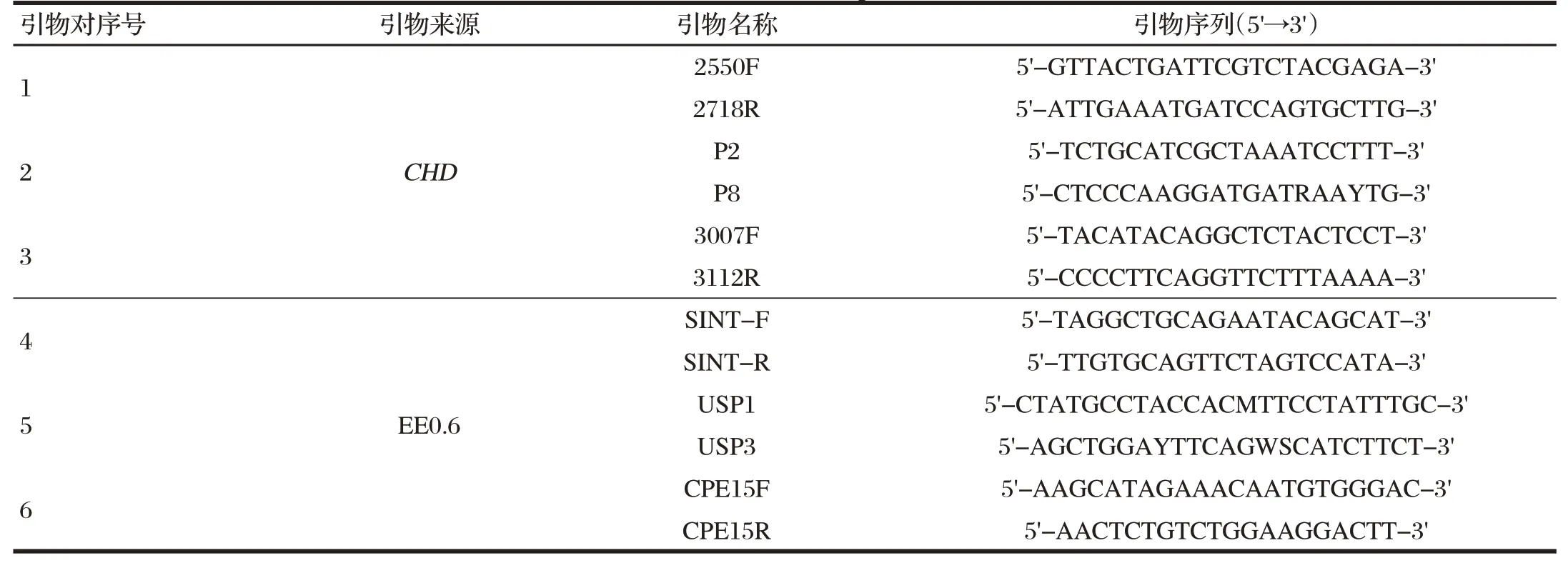
表1 引物设计Tab1 Primers design
1.3.3 PCR扩增体系
反应体系为2×PowerTaqPCRMasterMix 15μL、DNA 1μg、上下游引物各1μL、ddH2O 12μL,总体积为30μL。反应条件为95℃预变性5 min;94℃变性50 s、51.5℃退火50 s、72℃延伸50 s,循环35次;72℃末端延伸4 min,4℃保存。
1.3.4 PCR产物检测
采用1%的琼脂糖凝胶对样品进行检测,于凝胶成像分析仪中进行拍照,对得到的结果进行分析。
2 结果与分析
2.1 2550F/2718R引物扩增武汉和南京的火烈鸟的DNA结果(见图1、图2)
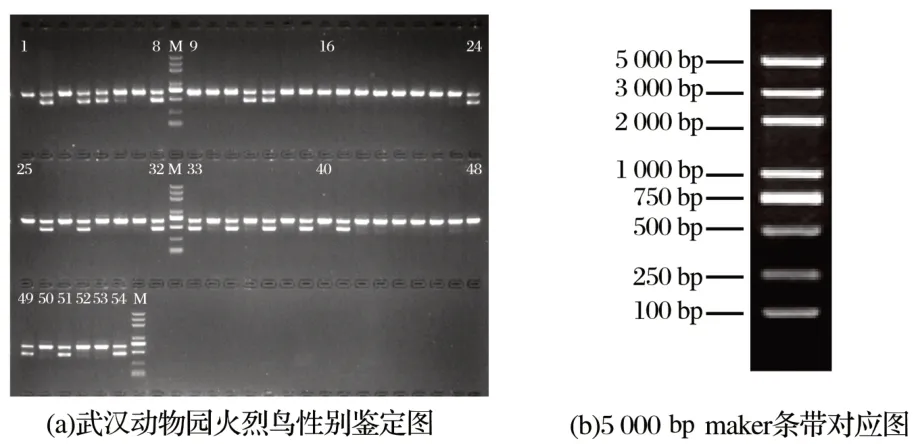
图1 武汉动物园54只火烈鸟电泳图(2550F/2718R)Fig.1 Electrophoresis of 54 flamingos in Wuhan zoo(2550F/2718R)
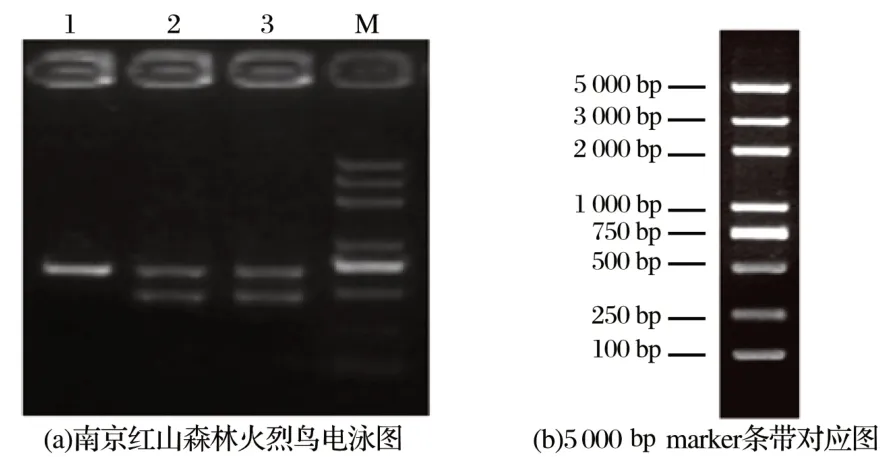
图2 南京红山森林动物园已知性别的火烈鸟电泳图(2550F/2718R)Fig.2 Electrophoresis of known sexes flamingos in Nanjing zoo(2550F/2718R)
由图1可知,Lane2、4、5、8、12、13、24、26、28、32、33、35、37、39、41、49、51、54均出现2条带,分别在500~750 bp和400~500 bp;其他样品只出现1条带,在500~750 bp,可以预判出现两条带的18只火烈鸟为雌性,只有一条带的36只火烈鸟为雄性,但是需要已知性别的火烈鸟进行验证,故向南京红山森林动物园借用3只已知性别的火烈鸟血样进行验证。
由图2可知,lane1表示南京红山森林动物园的雄性火烈鸟经CHD基因引物(2550F/2718R)扩增结果,只有一个条带,在500~750 bp,lane2和3代表其雌性火烈鸟扩增结果,出现了两条带,分别在500~750 bp和400~500 bp,说明不同性别的火烈鸟在CHD基因特异性引物对的扩增下的确出现了不同条带,条带大小也和武汉动物园54只火烈鸟电泳的条带大小一致,验证了图1预判的结果准确,故武汉动物园有18只雌性火烈鸟,36只雄性火烈鸟,雌雄比为1∶2。
2.2 多重PCR结果(见图3、图4)
采用多重PCR将两对引物同时加入反应体系中,图3代表了混合SINT-F/SINT-R、USP1/USP3两对引物PCR扩增结果。由图3可知,雌性火烈鸟中出现了两条带,在450 bp和200 bp,雄性火烈鸟仅在200 bp的位置有一条带。

图3 混合SINT-F/SINT-R、USP1/USP3两对引物后武汉动物园火烈鸟电泳图Fig.3 Electrophoresis of flamingo in Wuhan zoo after mixing SINT-F/SINT-R and USP1/USP3 primers
由图4可知,所有的火烈鸟经USP1/USP3、CPE15F/CPE15R两对引物扩增后基本上均出现两条带,但雌性火烈鸟的300 bp左右的条带更加明亮,雄性火烈鸟的300 bp的条带较暗,均在250 bp左右出现了第二条带。
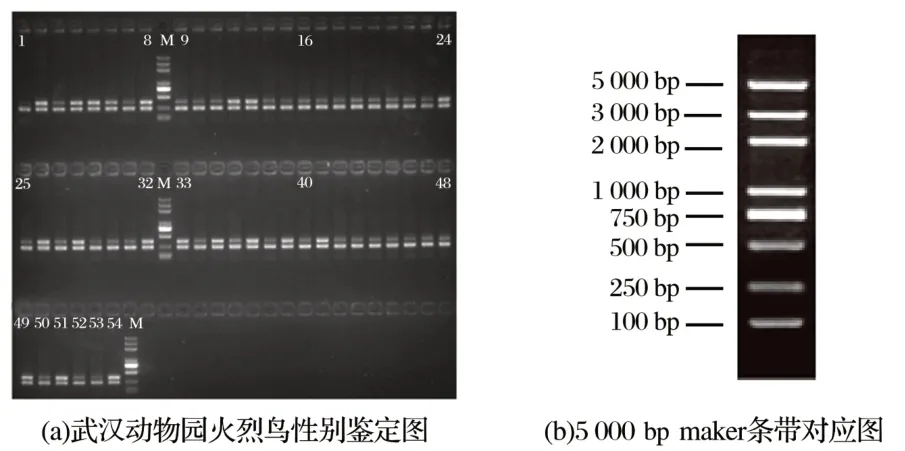
图4 混合USP1/USP3、CPE15F/CPE15R两对引物后武汉动物园火烈鸟电泳图Fig.4 Electrophoresis of flamingo in Wuhan zoo after mixing USP1/USP3 and CPE15F/CPE15R primers
2.3 P2和P8、3007F和3112R以及EE0.6基因3对引物扩增火烈鸟DNA
5对引物单独对火烈鸟DNA进行扩增,并未出现雌性火烈鸟两条带,雄性火烈鸟一条带的结果,不能通过该结果判断雌雄。
3 讨论
本次试验采用的引物对2550F/2718R是扩增CHD基因上的特异性片段,在非平胸目鸟类的性别鉴定中应用较广,方法也较为成熟。1996年,Griffiths等[1]首次发现在非平胸目鸟类中均含有CHD-W基因,由于CHD-Z、CHD-W基因中外显子相同,但内含子大小不同,根据这一原理能够准确鉴定鸟类的性别。扩增后雌性有2条带、雄性为1条带。胡锐颖等[3]采用2550F/2718R鉴定了9种86只国家一级保护鸟类的性别;陈蓉等[4]鉴定了南京红山森林动物园中的美洲红鹮和火烈鸟的性别。结合本试验和其他人研究结果,推测2550F/2718R引物可以大量使用在国内大多数珍稀鸟类的性别鉴定中,如火烈鸟、丹顶鹤、白鹤、东方白鹳等,后续也会继续使用该引物和已经成功摸索出的PCR条件来鉴定其他珍稀鸟类的性别,如美洲红鹮、白骨顶鸡、鹈鹕等,可以提高鸟类性别鉴定的效率。
另外,还有很多引物也能鉴定鸟类性别,如CHD基因上的P2/P8、3007F/3112R,EE0.6序列上的3对引物(SINTF/SINTR、USP1/USP3、CPE15F/CPE15R)也曾成功鉴定多种鸟类的性别[1,5-8]。本试验选用剩下5种引物进行试验,结果发现,除2550F/2718R引物能够准确鉴别火烈鸟性别以外,其他5种引物对的电泳结果无法判定本园古巴火烈鸟的性别,与其他文献中的结果不一致。此结果可能因为P2/P8这对引物更多试验成功在鸡、海鸥和金刚鹦鹉上[9-10],而黑美洲鹫、乌鸦上只出现一条带,雌雄鸟的电泳条带出现在不同的位置;3007F/3112R在白鹡鸰和白头翁两种鸟类上也未能鉴定性别,雌雄均在同样的位置出现条带,仅在山雀上区别了雌雄,出现了两条带[10]。上述研究结果表明,这两对引物在扩增不同物种的性染色体时,扩增出来的片段不一定具有特异性,有的雌雄片段大小相似,而有的鸟类雌雄片段无同源性。因此,是否能将P2/P8、3007F/3112R应用于鉴定武汉动物园其他珍稀鸟类的性别,需要进一步试验研究。
陈武等[11]使用CPE15F/CPE15R和AWS03/USP3扩增丹顶鹤的EE0.6序列,成功鉴定了丹顶鹤的性别;Owaga[2]成功使用EE0.6基因上的引物鉴定了11种鸟类的性别,但对于雌性的相思鹦鹉和王企鹅却无法扩增出两条带,说明单对引物扩增EE0.6序列存在操作缺陷,无法准确判断鸟类的性别,因此选择合适的引物组合较为关键[12]。本试验中,对EE0.6基因上的3对引物对采用多重PCR的方法,结果显示,SINT-F/SINT-R、USP1/USP3扩增出来的结果与预期一致,表明有18只雌性和36只雄性,条带分别在450 bp和200 bp,与李文斌等[12]结果较相似,但采用USP1/USP3、CPE15F/CPE15R两对引物扩增目的基因后,所有火烈鸟均出现了两条带,虽然亮度不一样,但无法说明性别之分,与李文斌的结果有差异。考虑到胡锐颖等[3]使用EE0.6序列上的引物扩增出来的结果与我园火烈鸟扩增出来的结果一致,因此不同物种不会影响结果。多重PCR对我园火烈鸟或是其他珍稀鸟类性别鉴定上的应用还需进一步的研究。
除了采血可以提取DNA,鉴定性别外,还可以通过羽毛来提取DNA。拔羽的时候需要获取带毛囊的羽毛,提取DNA的量不如血样提取的量大,但刺激较小,适用于美洲红鹮等应激性较强的鸟类,也适合晚成雏鸟在早期的鉴定性别[13]。故需要根据不同的情形使用不同的采样方法。
武汉动物园在2012年和2013年引进火烈鸟以后,一直未有成功繁殖的记录,仅在2019年7~8月份下了11枚蛋,但全部为未受精蛋。我园在火烈鸟的繁殖问题上一直未有突破。本试验初次鉴定了武汉动物园火烈鸟的性别,结果表明,雄性火烈鸟远大于雌性,雌雄比为1∶2。火烈鸟是一夫一妻制的配对形式[14],可能出现繁殖期未配对的火烈鸟对配对成功的火烈鸟夫妻进行干扰,或者打架争执,影响火烈鸟的整个繁殖季节[15-16]。后续会考虑隔离体重小、活力不强的雄性火烈鸟,使其雌雄比为1∶1,改善它们的配对环境,并在后续的研究中试图引进人工翻肛采精和授精的技术,突破我园火烈鸟多年的繁殖困难。
4 结论
本研究采用分子技术的手段,使用CHD基因上的引物对2550F/2718R成功鉴定了武汉动物园火烈鸟的性别,并用南京红山森林动物园的已知性别火烈鸟进行验证,结果表明,我园共有18只雌性和36只雄性火烈鸟,雌雄比为1∶2,采用多重PCR的方法发现混合SINT-F/SINT-R、USP1/USP3两对引物能够鉴定出火烈鸟的性别。
