急性冷暴露对仔猪多器官miR-383表达的影响
2021-08-27王晓媛
吴 优,王晓媛,甄 莉
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163000)
miRNA是发现的较晚的一类单链小分子非编码RNA,在植物到动物组织中广泛存在,在生物的发育、生殖、疾病、细胞凋亡、应激反应等过程中发挥调控作用。miRNA分子很小,仅由20~24个核苷酸组成,通过靶向抑制或降解mRNA在转录水平进行基因表达的调控[1]。生物的一切活动均与环境密不可分。低温作为一种最常见的非生物因素对动、植物生理机能产生直接影响。由低温引起的冷应激常发生于早春和晚秋季节,尤其是湿度大的天气,可导致畜禽生长发育迟缓,代谢紊乱,免疫力、生产性能、繁殖性能下降,甚至导致死亡[2]。冷应激研究过程中发现,松鼠、大鼠、蝙蝠、斑马鱼等动物的心脏、骨骼肌、肝脏、脂肪等器官和组织中有多种miRNA与冷应激反应密切相关,如miR-425、miR-483、miR-92b、miR-383等[3-5]。miR-383是miRNA家族的一员,主要参与细胞的氧化损伤、增殖、凋亡等生物进程[6],其表达失调已在癌症、不孕不育、神经退行性疾病等多种疾病中得到证实[7-8]。本研究通过qRT-PCR法检测急性冷暴露仔猪多器官中miR-383的表达量,以明确急性冷暴露是否能够影响miR-383在组织器官中的表达,从而揭示冷应激反应中miR-383的调控机制,为冷应激的防治提供参考。
1 材料与方法
1.1 试验动物
试验选取体况相近、健康的断奶仔猪(30日龄)16头,随机分为对照组(NT)和冷暴露组。对照组条件为(24±2)℃,相对湿度40%~50%;冷暴露条件为(4±2)℃,相对湿度40%~50%。冷暴露组又分为3个处理,分别进行2(CE 2 h)、6(CE 6 h)和12 h(CE 12 h)冷暴露,每组4头仔猪。饲养试验在人工气候室内进行。预试7 d后,进行冷暴露试验。试验期间自由采食和饮水。
1.2 仪器设备
Nanodrop 2000核酸蛋白定量仪(Thermo Fisher Scientific,美国)、移液器(Eppendorf,德国)、低温高速离心机(Hitachi,日本)、CFX96荧光定量PCR仪(Bio-Rad,美国)、MM400混合型球磨(Retsch,德国)。
1.3 测定指标及方法
1.3.1 血清中皮质醇(CORT)
冷暴露结束后,股动脉采血,制备血清,冻存于-80℃冰箱,使用猪皮质醇(CORT)ELISA检测试剂盒(mni.mAbs,美国)检测CORT含量。
1.3.2 组织中miR-383表达量
冷暴露结束后,将仔猪乙醚麻醉后处死,取肺、小肠、肌肉(背最长肌)、肾、脾和肝组织置于-80℃保存。使用5 min RNA纯化试剂盒(B0132,哈尔滨新海基因检测有限公司)提取总RNA,用反转录试剂盒(D0401,哈尔滨新海基因检测有限公司)制备cDNA。引物均由生工生物工程(上海)股份有限公司根据miRBase中登录的猪miR-383和U6的基因序列进行设计和合成。miR-383的反转录引物和上游序列为:5′-CAGTTGGTCAGCAGTTCTTGG TAT-3′和5′-ACCTCCCACAGCACTGCC-3′;U6的反转录引物和上游序列为:5′-AACGCTTCACGAATTT GCGT-3′和5′-CTCGCTTCGGCAGCACA-3′。荧光定量检测利用Fast DNA Probe qPCR Mix(A2301,哈尔滨新海基因检测有限公司)。反转录参数如下:37℃、15 min,85℃、5 s。PCR反应参数如下:95℃、30 s,95℃、5 s,60℃、30 s,40个循环。
1.4 数据统计与分析
数据应用SPSS 19.0进行单因素方差统计分析,结果以“平均值±标准差”表示,采用t检验进行组间比较,P<0.05表示差异显著。
2 结果与分析
2.1 冷暴露对仔猪CORT含量的影响(见图1)
由图1可知,断奶仔猪血清CORT含量在冷暴露2 h后开始上升,但差异不显著(P>0.05);冷暴露6 h CORT含量持续上升,极显著高于对照组(P<0.01);冷暴露时间延长到12 h,CORT含量迅速回落,与对照组无显著差异(P>0.05)。
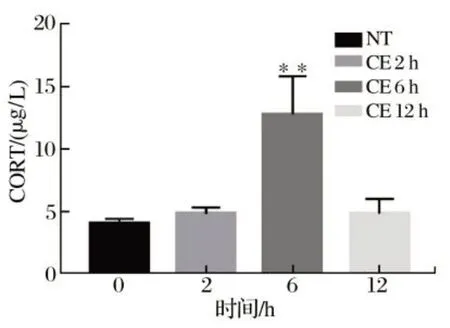
图1 冷暴露仔猪血清CORT含量的影响Fig.1 Effect of cold-exposed piglet serum CORT content
2.2 冷暴露对仔猪miR-383表达水平的影响(见图2)
由图2可知,冷暴露2 h后,肺和肌肉中miR-383表达量显著降低(P<0.05),肝和脾中则显著升高(P<0.05);冷暴露6 h后,肌肉中miR-383表达量持续下降(P<0.05),肝中继续上升(P<0.01),其他器官中miR-383表达量与对照组无显著差异(P>0.05),表明冷暴露对肌肉和肝脏中miR-383表达量的影响迅速且稳定;冷暴露12 h后,miR-383表达量在小肠显著上升(P<0.05),在肾显著下降(P<0.05),脾显著上升(P<0.05),肝中仍表现为持续上升(P<0.01),表明冷暴露对肝脏中miR-383表达量的影响较肌肉中更稳定。由此可以推测,miR-383有可能成为冷应激的临床诊断标志物,尤其是在肝脏中。
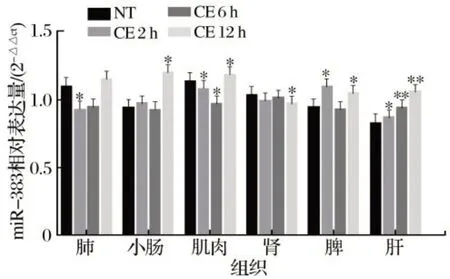
图2 冷暴露断奶仔猪组织中miR-383相对表达量的影响Fig.2 Effect of relative expression of miR-383 in cold-exposed weaned piglets
3 讨论
在本研究中,对30日龄断奶仔猪进行冷暴露时采用的温度是(4±2)℃,冷暴露时间分别设置为2、6、12 h。这一条件的选择是利用了本实验室在前期研究工作中建立的仔猪冷暴露模型。模型建立过程中检测了冷暴露断奶仔猪动脉血pH值、电解质、血气参数、多种血清激素,在这些指标检测结果的基础上对仔猪机体内环境是否处于稳态进行综合评价,最终筛选出适宜的冷暴露条件[9]。
在冷暴露条件下,仔猪多器官中miR-383表达量出现显著变化,尤其是在肌肉和肝脏中,表明其参与了多器官的冷应激反应。有研究表明,在成纤维细胞向神经元的转化过程中,miR-383水平的上升直接抑制LdhamRAN的表达[10]。Ldha在生物中普遍存在,表达产物为乳酸脱氢酶A,主要大量存在于肌肉组织中,实现将丙酮酸转化为乳酸,通过促进糖酵解过程起到为肌肉组织迅速供能的作用。当动物处于低温环境时,呼吸道黏膜和肢体末端的毛细血管发生收缩,从而影响呼吸和循环过程,进而引起血氧浓度下降。本试验中,冷暴露仔猪肌肉中miR-383表达量下降,可靶向调控Ldha表达量上升,从而加速肌肉组织中丙酮酸的乳酸发酵过程,从而使糖酵解加强,迅速产能,以适应寒冷环境。在肝脏中miR-383可抑制Pfkfb1的表达[11],Pfkfb1能够间接激活糖酵解关键酶PFK-1,因而仔猪冷暴露后,肝脏中miR-383表达量的上升抑制了糖酵解过程,同时可促进糖和脂肪的有氧氧化,从而适应寒冷环境。
4 结论
本研结果表明,4℃冷暴露6 h可使仔猪处于急性冷应激状态。从miR-383表达量的角度分析,肺、肌肉、肝和脾对冷刺激响应迅速(2 h),小肠和肾的响应时间较长(12 h),急性冷暴露(2~12 h)可使仔猪肝脏中miR-383表达量持续显著上升。
