非洲菊PR-1基因的克隆与表达分析
2021-08-26李乾玉王秀美倪珊珊王乐张舒婷夏朝水叶炜陈裕坤赖钟雄
李乾玉 王秀美 倪珊珊 王乐 张舒婷 夏朝水 叶炜 陈裕坤 赖钟雄


摘 要:以非洲菊‘G088為材料,基于本研究所测序得到的非洲菊转录组数据(SRA: SRR9937065)的基础上,采用RT-PCR技术克隆获得2个病程相关蛋白1(PR-1)基因,分别命名为GjPR-1-like1和GjPR-1-like2(GenBank登录号:MW057342和MW057343),GjPR-1-like1和GjPR-1-like2编码序列长度分别为534 bp和489 bp,可编码177和162个氨基酸。生物信息学分析表明,GjPR-1-like1属于碱性不稳定性蛋白,GjPR-1-like2属于弱酸性稳定蛋白;它们编码的蛋白质均含有CAP_PR-1和CAP superfamily保守结构域,属于富含半胱氨酸超家族蛋白,含有信号肽、跨膜结构和磷酸化位点;亚细胞定位表明均位于液泡中。PR-1基因在不同组织(叶、叶柄和根)、不同激素与逆境(SA、MeJA、ABA、NaCl)以及根腐病病原菌处理非洲菊的表达模式分析结果表明,GjPR-1-like1和GjPR-1-like2均在叶片中表达水平最高,在SA、MeJA、ABA和NaCl胁迫以及根腐病病原菌处理下,均显著影响GjPR-1-like1和GjPR-1-like2的表达水平。研究表明,GjPR-1-like1和GjPR-1-like2可能参与调控非洲菊生长发育过程,尤其是叶片的发育过程;且可能参与了非洲菊生物及非生物胁迫过程,尤其在响应非洲菊根腐病的抗病防御过程中发挥了一定的作用。
关键词:非洲菊;病程相关蛋白1;基因克隆;激素;根腐病
中图分类号:Q949.783.5 文献标识码:A
Cloning and Expression Analysis of PR-1 Genes in Gerbera jamesonii
LI Qianyu1, WANG Xiumei1, NI Shanshan1, WANG Le1, ZHANG Shuting1, XIA Chaoshui2, YE Wei2, CHEN Yukun1*, LAI Zhongxiong1*
1. Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2. Sanming Academy of Agricultural Sciences, Sanming, Fujian 365000, China
Abstract: In this study, based on the transcriptome database of Gerbera jamesonii (SRA: SRR9937065), we successfully cloned two PR-1 genes, named as GjPR-1-like1 and GjPR-1-like2 (GenBank accession number: MW057342 and MW057343), from G. jamesonii cv.‘G088 using the RT-PCR method. The coding sequence of GjPR-1-like1 and GjPR-1-like2 was 534 bp and 489 bp, encoding 177 and 162 amino acids. Bioinformatics analysis indicated that GjPR-1-like1 and GjPR-1-like2 were belonged to the basic unstable protein and acid stable protein; all the two GjPR-1s possessed CAP_PR-1 and CAP superfamily conserved domain, belonged to cysteine-rich secretory super family proteins and contained signal peptide, transmembrane structure and phosphorylation sites; subcellular localization indicated that they both located in the vacuole. The expression patterns of PR-1 in different tissues (including leaf, petiole and root), and under different adversity stresses (including SA, MeJA, ABA, NaCl treatments) and Phytophthora cryptogea treatments in Gerbera transplant seedlings, the results showed that both GjPR-1-like1 and GjPR-1-like2 showed the highest expression level in the leaf. Under stress conditions of SA, MeJA, ABA, NaCl treatments and P. cryptogea treatments, the expression level of GjPR-1-like1 and GjPR-1-like2 were significantly changed. GjPR-1-like1 and GjPR-1-like2 may participate in the regulation of the growth and development process of G. jamesonii particularly in leaf development, and were concerned with biotic stresses and abiotic stresses, especially play a certain role in the process of disease resistance and defense in response to the gerbera P. cryptogea interaction.
Keywords: Gerbera jamesonii; pathogenesis-related protein 1; gene clone; hormone; Phytophthora cryptogea
DOI: 10.3969/j.issn.1000-2561.2021.07.006
植物生长发育的过程中会面临多种病毒、真菌以及外界胁迫的侵袭。为了保护自己免受侵袭,植物细胞壁硬化并产生抗菌化合物(植物抗毒素)和抗菌蛋白[1-2],启动体内的防御机制。植物病程相关蛋白(pathogenesis-related proteins,PRs)是植物在受病原菌侵染过程中诱导产生的[3],在植物抗病过程中发挥重要作用。根据PRs蛋白家族的类型及特性主要归纳为17个家族[4-5],其中PR-1家族是PRs家族中重要的多基因家族,属于富含半胱氨酸的分泌蛋白、抗原5和病程相关蛋白1超家族(CAP superfamily)[6],并且进化上高度保守。PR-1基因通常被认为是植物抗病性和系统获得性抗性的标志基因[7-8],能够参与植物防御病原菌攻击的过程[9]。某些PR-1蛋白的防御功能通过在转基因植物中过量表达已得到证实,如过表达PR-1会增强植物对真菌[10]、卵菌[11]和细菌[12-13]的抗性,但对病毒的抗性没有增加[14]。对于多基因家族PR-1蛋白的研究表明,并不是所有PR-1基因都能够表现出一定的抗病性。番茄中与PR-1家族相关的3种不同的碱性14 kDa蛋白质P14a、P14b和P14c在体外和体内条件下均显示出抗真菌活性[15],而在苹果中转入PR-1a、PR-1b和PR-1c后,苹果幼苗并未表现出抗病特性[16]。PR-1蛋白除具有抗病功能以外,在植物正常的生长发育、响应激素诱导和非生物逆境胁迫等过程也发挥着重要作用。例如,PR-1蛋白被证明主要在成花植物衰老的叶子中[17]以及在正在发育的花的萼片中积累[18]。研究发现水稻OsPR1a和OsPR1b基因不仅响应茉莉酸(JA)、水杨酸(SA)、过氧化氢(H2O2)和稻瘟病菌(Magnapor theoryzae)等的诱导,还能够响应化学试剂和环境胁迫的诱导[19-21]。番茄PR-1家族在干旱胁迫下所有成员均上调表达,表明SlPR-1基因积极响应干旱胁迫并发挥了一定作用[22]。综上所述,PR-1基因不仅能增强多种植物的抗病性,还能提高抵御生物或非生物胁迫的能力,具有重要的研究意义。
非洲菊(Gerbera jamesonii)是多年生的草本花卉,属菊科(Compositae)大丁草属(Gerbera)。因花朵大、颜色艳丽等特点深受人们喜爱,但是随着其种植面积的扩大和管理粗放,病虫害问题也日益凸显。研究表明根腐病是影响非洲菊生长的重要病害之一[23],因此,研究非洲菊抗病相关基因有助于进一步解决非洲菊抗病机理的相关难题,对非洲菊根腐病防治策略的选择有重要意义。本研究以非洲菊‘G088移栽苗为材料,结合本研究所的转录组数据库,对非洲菊2个PR-1基因进行克隆及生物信息学分析,采用qRT-PCR技术检测在不同组织、不同激素、不同逆境处理和隐地疫霉菌处理下非洲菊PR-1基因的表达水平,以期为非洲菊抗病机制的后续研究提供理论依据。
1 材料与方法
1.1 材料
实验所用‘G088非洲菊移栽苗由福建省三明市农业科学研究院夏朝水提供。非洲菊根腐病病原菌隐地疫霉由本实验室从非洲菊病株分离鉴定[24]。
非洲菊不同处理试验方法如下:(1)分别取同一株非洲菊根、茎和叶片,备用。(2)水杨酸(SA)、茉莉酸甲酯(MeJA)和脱落酸(ABA)处理:分别使用5 mmol/L的SA、100 μmol/L的MeJA和100 μmol/L的ABA溶液噴施于非洲菊叶片,直至叶片滴水,于处理后0、6、12、24、48、72 h取叶片。(3)盐胁迫处理:使用200 μmol/L的NaCl溶液一次性浇灌移栽苗,于处理后0、4、8、12、48 h取叶片。(4)根腐病菌接种非洲菊:参考郝向阳等[25]的方法,将非洲菊移栽苗置于隐地疫霉菌液中2 h后移栽,并于处理后0、2、4、6 d取根系。所有处理材料取样后均置于液氮中,存放于?80 ℃冰箱中备用。
1.2 方法
1.2.1 总RNA的提取及cDNA合成 采用Trizol试剂盒提取非洲菊根、叶柄和叶片的总RNA,使用超微量分光光度计测定RNA浓度及吸光值(OD值),以OD500nm值1.8~2.0为最佳。参照Thermo Scientific RevertAid First Strand cDNA Synthesis Kit试剂盒说明书,反转录获得cDNA第一链用于PCR扩增;参照TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR试剂盒说明书反转录合成不同处理样品的cDNA用于qRT-PCR反应。
1.2.2 基因克隆 利用本实验室非洲菊转录组测序数据,通过转录组NT、NR和Swiss-Prot数据库进行关键词“Pathogenesis-related protein 1”的检索,获得2条PR-1基因序列c33369_g1和c40036_g1,并设计用于基因PCR扩增的引物(表1)。以非洲菊‘G088叶片cDNA为模板进行PCR扩增。PCR反应体系如下:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,共34个循环;72 ℃延伸10 min。PCR扩增获得目的条带后,使用Gel/PCR Extraction Kit试剂盒进行胶产物回收,pMD18-T载体连接目的片段后转化大肠杆菌感受态细胞DH5α的转化,随后挑选阳性克隆送至北京六合华大基因科技股份有限公司进行测序。
1.2.3 生物信息学分析 使用在线软件对克隆的2个PR-1基因编码蛋白进行基本理化性质分析(Expasy,https://web.expasy.org/protparam/)、保守结构域分析(CDD,https://www.ncbi.nlm.nih. gov/Structure/cdd/cdd.shtml)、信号肽预测(SignalP 5.0 Server,http://www.cbs.dtu.dk/ser?vi?ces/SignalP/)、亚细胞定位预测(Plant-mPLoc Server,http://www.csbio.sjtu.edu.cn/bioinf/plant- multi/#)、跨膜结构预测(TMpred,http://www.cbs. dtu.dk/ services/TMHMM/)、磷酸化位点预测(NetPhos 3.1 Sever,http://www.cbs.dtu.dk/serv?ices/Net?Phos/)蛋白二级结构预测(SOPMA,https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma. pl)。通过在线网站NCBI分析2个非洲菊PR-1基因的氨基酸序列;从TAIR下载拟南芥、莴苣、葡萄等14种物种的PR-1蛋白序列,其次利用在线网站NCBI Blastp比对并下载与非洲菊PR-1高度同源的12个不同物种的PR-1蛋白序列,利用MEGA-X软件,使用邻近法(Neighbor-joining method)构建系统进化树。
1.2.4 非洲菊PR-1基因荧光定量表达分析 参照郝向阳等[25]的方法,以非洲菊18sRNA为内参基因,以克隆获得的序列设计qRT-PCR的上、下游引物(表1),采用罗氏480(Light?Cycler480)仪器进行相对表达分析。qRT-PCR反应体系为20 μL,反应程序设置为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共45个循环。每个样品进行3次重复,检测不同处理下两个PR-1基因在非洲菊中的表达情况。相对表达量用2?CT法计算得出,并使用Excel软件进行数据统计、SPSS 24.0软件的Duncan法进行差异显著性分析(P<0.05)及Graphpad软件进行绘图。
2 结果与分析
2.1 非洲菊PR-1基因克隆
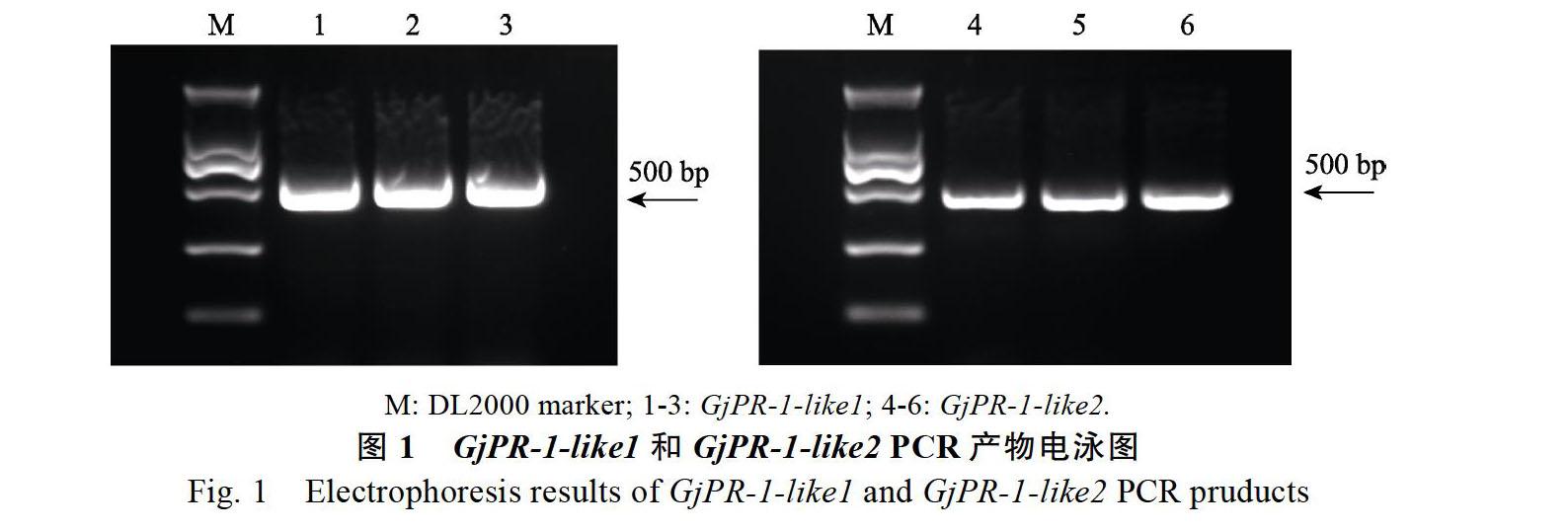
以非洲菊cDNA为模板,利用设计的引物进行PCR扩增,凝胶电泳结果显示(图1),在500 bp
左右处均有1条清晰的条带,大小与预期结果一致,胶回收、TA克隆、挑取单克隆后进行测序。利用DNAMAN 6软件,将测序获得的2条PR-1基因序列分别与非洲菊转录组对应的c33369_g1
和c40036_g1基因序列比對分析,相似度分别达99.26%和98.98%,CDS长度分别为534 bp和501 bp,预测可分别编码177和162个氨基酸(图2)。利用NCBI Blastn比对发现,c33369_g1与大蓟PR-1-like相似度最高,达到80.43%;c40036_g1与莴苣PR-1 type-like的相似度最高,达到80.90%,将c33369_g1和c40036_g1基因分别命名为GjPR-1-like1和GjPR-1-like2,GenBank登录号分别为MW057342、MW057343。利用软件DANMAN对拟南芥、水稻、番茄、向日葵和橡胶树等5种植物PR-1蛋白的氨基酸序列进行序列比对分析发现(图3),尽管不同植物PR-1蛋白的N末端氨基酸序列存在较大差异,但在其C末端氨基酸序列高度保守,均含有标志PR-1家族的6个保守的半胱氨酸,且不同植物PR-1基因的长度相差不大,进一步表明了PR-1基因在进化上的保守性。
2.2 生物信息学分析
蛋白理化性质预测分析表明,GjPR-1-like1蛋白分子式为C898H1371N263O239S12,蛋白分子量为20 060.10 Da,原子总数为2783,不稳定系数53.03,脂肪指数62.94,等电点为10.15,平均亲水系数为?0.356,属于碱性不稳定性蛋白。GjPR-1-like2蛋白分子式为C785H1176N222O239S10,蛋白分子量为17 867.92 Da,原子总数为2432,不稳定系数22.86,脂肪指数71.67,等电点为5.60,平均亲水系数为?0.301,属于弱酸性稳定蛋白。推测GjPR-1-like1和GjPR-1-like2均属于亲水性蛋白。GjPR-1-like1蛋白的甘氨酸(Gly)含量最高,达10.2%,其次是精氨酸(Arg)为9.6%;GjPR-1-like2蛋白的甘氨酸(Gly)含量最
高,达10.2%,其次是精氨酸(Arg),为9.6%。
由表2可知,GjPR-1-like1和GjPR-1-like2蛋白均有信号肽,GjPR-1-like1的信号肽序列在第1~26个氨基酸,GjPR-1-like2的信号肽序列在第1~23个氨基酸。蛋白的亚细胞定位预测发现GjPR-1-like1和GjPR-1-like均定位于液泡。GjPR-1-like1和GjPR-1-like2均有由内向外和由外向内的跨膜结构。磷酸化位点预测显示,GjPR-1-like1共有13个磷酸位点,GjPR-1-like2共有20个磷酸位点。蛋白二级结构预测发现GjPR-1-like1和GjPR-1-like2的主要组成原件均为α-螺旋、延伸链和无规卷曲。
保守结构域预测分析发现(图4),GjPR-1- like1和GjPR-1-like2都包含1个CAP_PR-1结构域,也包含1个CAP superfamily结构域,2个非洲菊PR-1蛋白均属于富含半胱氨酸超家族蛋白。对非洲菊GjPR-1-like1和GjPR-1-like2的motif预测发现,2个PR-1蛋白质含有相同的9个motif,推测非洲菊PR-1可能存在功能冗余。
系统进化树结果显示(图5),非洲菊GjPR-1-like1基因编码的蛋白与拟南芥PR-1-like聚类在一起,GjPR-1-like2基因编码的蛋白与烟草PRP-1聚类在一起;非洲菊PR-1与拟南芥PR-1亲缘关系更近,而与水稻和玉米2种单子叶植物亲缘关系相对较远,推测在生物学功能上有着一定联系。
2.3 GjPR-1-like1和GjPR-1-like2基因在不同组织的表达分析
为明确2个PR-1基因在非洲菊不同组织的表达情况,采用荧光定量PCR检测基因相对表达量。由图6A分析发现,在非洲菊不同组织中GjPR-1- like1和GjPR-1-like2的相对表达量存在显著差异。GjPR-1-like1和GjPR-1-like2基因均在叶片中表达水平最高,叶柄次之,根最少。GjPR-1-like1在叶柄和根的表达量约为叶片中的70.82%和26.21%,GjPR-1-like2在叶柄和根的表达量约为叶片中的40.38%和15.29%。
2.4 非生物胁迫下GjPR-1-like1和GjPR-1-like2的表达情况
SA处理下(图6B),GjPR-1-like1和GjPR- 1-like2基因的表达受SA显著诱导,总体呈现先升后降的趋势,且均高于对照组(0 h)的表达水平。GjPR-1-like1和GjPR-1-like2于处理后12 h表达量均达到峰值,分别约为对照组的6倍和7.8倍(P<0.05),随后逐渐降低。
MeJA处理下(图6C),GjPR-1-like1和GjPR-1-like2基因的表达均受到促进作用,但在响应MeJA的时间上存在差异。GjPR-1-like1于处理后6 h表达量达到峰值,约为对照组的9.5 倍(P<0.05),后逐渐下降,总体呈现出逐渐降低趋势。GjPR-1-like2于处理后12 h表达量达到峰值,约为对照组的5.3倍(P<0.05),总体呈现先升后降趋势。可见,GjPR-1-like1较GjPR-1-like2响应MeJA诱导表达更迅速。
ABA处理下(图6D),GjPR-1-like1的表达受到显著促进,12 h表达量达到峰值,约为对照组的6.6倍(P<0.05)。GjPR-1-like2在6 h时表达受抑制,表达量仅为对照组的62.86%,表达水平在处理12 h后开始回升,于24 h表达量达到峰值,约为对照组的5.73倍(P<0.05)。
盐胁迫条件下(图6E),GjPR-1-like1在表达早期受抑制,于处理8 h后回升达到表达量峰值,约为对照组的2.15倍(P<0.05),随后逐渐降低且24 h和48 h的表达量均低于对照组。GjPR-1-like2的表达总体呈现逐渐下降趋势,处理4 h和8 h的表达量分别为对照组的1.65倍和1.52倍,之后表达水平显著受到抑制作用且均低于对照组。
2.5 隐地疫霉处理下GjPR-1-like1和GjPR-1- like2的表达情况
非洲菊接种根腐病病原菌隐地疫霉不同时间后,GjPR-1-like1和GjPR-1-like2基因的表达均受显著诱导(图6F),且表达量均高于对照组。GjPR-1-like1于处理2 d的表达量达到峰值,约为对照组的14.8倍(P<0.05),GjPR-1-like2于处理4 d的表达量达到峰值,约为对照组的31.5倍(P<0.05),GjPR-1-like1较GjPR-1-like2响应隐地疫霉胁迫更迅速。以上结果说明GjPR-1-like1和GjPR-1-like2参与了非洲菊的抗病反应过程。
3 讨论
近年来,PR-1基因已在多种植物中被克隆得到,如小麦[26]、玉米[27]、牡丹[28]、桑树[29]和白菜[30]等,本研究利用RT-PCR技术克隆得到2个非洲菊基因GjPR-1-like1和GjPR-1-like2,可分别编码177和162个氨基酸,均含有标志PR-1家族的6个保守的半胱氨酸,且经同源性比对分析发现,非洲菊GjPR-1-like1和GjPR-1-like2序列与拟南芥、番茄和单子叶植物水稻都高度同源,这些结果进一步表明PR-1基因在不同植物中具有较高的保守性。本研究推测GjPR-1-like1蛋白为碱性,GjPR-1-like2蛋白为酸性,理论上PR-1家族中的碱性蛋白具有较强的抗真菌活性[5],如胡椒[31]中等电点约为8.5的碱性PR-1蛋白对病原体和生物逆境胁迫的抗性显著增强,而Niderman等[15]的研究表明番茄中的抗病PR-1蛋白是酸性蛋白。因此,不同物种中PR-1蛋白存在功能多样性,PR-1蛋白的抗病特性不能仅依据pI值或序列同源性来判断。
PR-1基因在许多植物的不同组织及不同生长发育阶段的表达情况存在差异。如在水稻正常叶片生长过程中PR-1家族蛋白分为苗期表达量最高及最低2种表达模式[32];在番茄根部和衰老叶片中SlPR-1基因的表达量相对较高,在茎、幼叶和成熟叶片中表达量相对较低[33]。本研究结果发现,非洲菊GjPR-1-like1和GjPR-1-like2基因在叶片中表达量相对较高。侯丽霞等[34]研究表明的葡萄叶片中VvPR-1表达量最高。2个非洲菊PR-1基因表达的组织特异性,表明其可能参与调控非洲菊的生长发育过程,在非洲菊叶片生长或免疫防御过程中可能发挥比较重要的作用。
PR-1是SA信号传导途径的SAR抗病机制的标志基因[35],該基因不仅能够响应植物激素(SA、JA和ABA等)和盐等多种非生物胁迫条件,还能够被病原菌诱导表达,在植物抗病防御过程中发挥着重要作用。研究发现,SA、JA和ABA均能诱导葡萄VvPR-1的表达,且对于3种植物激素存在响应速度的差异[34];Gao等[36]研究表明小麦PR-1基因能够积极响应乙烯(EH)、脱落酸(ABA)以及茉莉酸甲酯(MeJA)的诱导表达;此外,在费尔干猪毛菜研究中也同样显示出SfPR1a基因在脱落酸(ABA)、茉莉酸(JAs)、乙烯合成直接前体(ACC)等相关激素胁迫及盐处理下能够被诱导表达[37]。以上研究结果均表明PR-1基因参与了植物对逆境胁迫的应答。本研究结果显示,在SA、MeJA、ABA和盐胁迫条件下GjPR-1-like1和GjPR-1-like2确实能够积极响应表达,这与许多植物PR-1基因积极响应以上非生物胁迫的反应一致[38],推测PR-1基因可能在不同信号途径的复杂应答网络中起到联结作用,但不同植物的PR-1基因响应植物激素和胁迫条件的表达模式存在一定差异,推测可能与PR基因参与不同调控机制有关。
在植物抗病方面,研究证实将PR1-a转入烟草能显著增强烟草对霜霉病菌和黑胫病菌的抗性[11];将辣椒CaBPR1在烟草中过表达后能增强烟草对多种病菌的抵抗能力[12];转入桑树MuPR1-2基因的拟南芥对灰霉菌有较强的抗性[29]。本研究中,用根腐病病原菌隐地疫霉接种非洲菊,发现GjPR-1-like1和GjPR-1-like2均受隐地疫霉显著诱导,分别在接种2 d和4 d时的表达量达峰值,GjPR-1-like1较GjPR-1-like2响应隐地疫霉胁迫更迅速,说明它们均能响应根腐病病原菌的诱导表达,但这2个基因是否具有抗根腐病的功能,还需进一步研究PR-1基因在非洲菊抗根腐病中的作用机制。
综合以上研究表明:GjPR-1-like1和GjPR-1- like2基因主要在叶片中表达,可能参与调控非洲菊的生长发育过程,其还能对植物激素SA、MeJA和ABA、盐胁迫和隐地疫霉胁迫作出应答,推测GjPR-1-like1和GjPR-1-like2可能参与了非洲菊生物及非生物胁迫过程,但在非洲菊抗逆抗病反应中的具体功能与调控机制等需要进一步研究,以期为PR-1基因在非洲菊抗病育种研究中的应用提供理论依据。
参考文献
[1] Hammond-Kosack K E, Jones J D. Resistance gene- dependent plant defense responses[J]. Plant Cell, 1996, 8(10): 1773-1791.
[2] Yang Y, Shah J, Klessig D F. Signal perception and transduction in plant defense responses[J]. Genes and Deelopment, 1997, 11(13): 1621-1639.
[3] Van Loon L C, Rep M, Pieterse C M J. Significance of inducible defense-related proteins in infected plants[J]. Annual Review of Phytopathology, 2006, 44: 135-162.
[4] Van Loon L C, Pierpoint W S, Boller T, et al. Recommendations for Naming plant pathogenesis-related proteins[J]. Plant Molecular Biology Reporter, 1994, 12(3): 245-264.
[5] Van Loon L C, Van Strien E A. The family of pathogenesis-related proteins, their activities, and comparative analysis of PR-1 type proteins[J]. Physiological and Molecular Plant Pathology, 1999, 55(2): 85-97.
[6] Gibbs G M, Roelants K, Obryan M K. The CAP superfamily: cysteine-rich secretory proteins, antigen 5, and pathogenesis-related 1 proteins-roles in reproduction, cancer, and immune defense[J]. Endocrine Reviews, 2008, 29(7): 865-897.
[7] 牛吉山, 刘 瑞, 郑 磊. 小麥PR-1、PR-2、PR-5基因的白粉菌和水杨酸诱导表达分析及白粉病抗性研究[J]. 麦类作物学报, 2007, 27(6): 1132-1137.
[8] Xie X Z, Xue Y J, Zhou J J, et al. Phytochromes regulate SA and JA signaling pathways in rice and are required for developmentally controlled resistance to Magnaporthe grisea[J]. Molecular Plant, 2011, 4(4): 688-696.
[9] Seo P J, Lee A K, Xiang F N, et al. Molecular and functional profiling of Arabidopsis pathogenesis-related genes: Insights into their roles in salt response of seed germination[J]. Plant Cell Physiology, 2008, 49(3): 34-344.
[10] Kiba A, Nishihara M, Nakatsuka T, et al. Pathogenesis-related protein 1 homologue is an antifungal protein in Wasabia japonica leaves and confers resistance to Botrytis cinerea in transgenic tobacco[J]. Plant Biotechnology, 2007, 24(2): 247-253.
[11] Alexander D, Goodman R M, Gut-Rella M, et al. Increased tolerance to two oomycete pathogens in transgenic tobacco expressing pathogenesis-related protein 1a[J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(15): 7327-7331.
[12] Sarowar S, Kim Y J, Kim E N, et al. Overexpression of a pepper basic pathogenesis-related protein 1 gene in tobacco plants enhances resistance to heavy metal and pathogen stresses[J]. Plant Cell Reports, 2005, 24(4): 216-224.
[13] Shin S H, Pak J H, Kim M J, et al. An acidic PATHOGENESIS-RELATED1 gene of Oryza grandiglumis is involved in disease resistance response against bacterial infection[J]. Plant Pathology Journal, 2014, 30(2): 208-214.
[14] Cutt J R, Harpster M H, Dixon D C, et al. Disease response to tobacco mosaic virus in transgenic tobacco plants that constitutively express the pathogenesis-related PR1b gene[J]. Virology, 1989, 173(1): 89-97.
[15] Niderman T, Genetet I, Bruyère T, et al. Pathogenesis-related PR-1 proteins are antifungal. Isolation and characterization of three 14-kilodalton proteins of tomato and of a basic PR-1 of tobacco with inhibitory activity against Phytophthora infestans[J]. Plant Physiology, 1995, 108(1): 17-27.
[16] Bonasera J M, Kim J F, Beer S V. PR genes of apple: identification and expression in response to elicitors and inoculation with Erwinia amylovora[J]. BMC Plant Biology, 2006, 6: 23.
[17] Fraser R S S. Evidence for the occurrence of the “pathogenesis-related” proteins in leaves of healthy tobacco plants during flowering[J]. Physiological Plant Pathology, 1981, 19(1): 69-76.
[18] Lotan T, Ori N, Fluhr R. Pathogenesis-related proteins are developmentally regulated in tobacco flowers[J]. Plant Cell, 1989, 1(9): 881-887.
[19] Agrawal G K, Jwa N S, Rakwal R. A novel rice (Oryza sativa L.) acidic PR1 gene highly responsive to cut, phytohormones, and protein phosphatase inhibitors[J]. Biochemical and Biophysical Research Communications,2000, 274(1): 157-165.
[20] Agrawal G K, Rakwal R, Jwa N S. Rice (Oryza sativa L.) OsPR1b gene is phytohormonally regulated in close interaction with light signals[J]. Biochemical and Biophysical Research Communications, 2000, 278(2): 290-298.
[21] Agrawal G K, Rakwal R, Jwa N S, et al. Signaling molecules and blast pathogen attack activates rice OsPR1a and OsPR1b genes: a model illustrating components participating during defence/stress response[J]. Plant Physiology and Biochemistry, 2001, 39(12): 1095-1103.
[22] Akbudak M A, Yildiz S, Filiz E. Pathogenesis related protein-1 (PR-1) genes in tomato (Solanum lycopersicum L.): Bioinformatics analyses and expression profiles in response to drought stress[J]. Genomics, 2020, 112(6): 4089-4099.
[23] 李 越, 李 凡, 刘云龙, 等. 云南非洲菊根腐病病原鉴定[J]. 华南农业大学学报, 2008, 29(3): 21-24, 28.
[24] 郝向阳, 林 觅, 孙雪丽, 等. 福建非洲菊产区根腐病病原菌的分离与鉴定[J]. 福建农业学报, 2018, 33(4): 391-395.
[25] 郝向阳, 孙雪丽, 刘 范, 等. 非洲菊4个POD基因的克隆及表达分析[J]. 西北植物学报, 2018, 38(10): 1777-1786.
[26] 高 琳. 2个小麦PR蛋白基因的抗叶锈病相关性分析[D]. 保定: 河北农业大学, 2014.
[27] 王 静, 刘 丽, 张志明, 等. 玉米病程相關蛋白1基因的克隆与表达分析[J]. 浙江大学学报(农业与生命科学版), 2012, 38(1): 35-42.
[28] 杨德翠, 张玉喜, 郑国生. 牡丹病程相关蛋白1基因的克隆及表达分析[J]. 园艺学报, 2013, 40(8): 1583-1590.
[29] 张华梁, 王 红, 刘 琪, 等. 桑树病程相关蛋白基因MuPR1-2的克隆及功能分析[J]. 蚕业科学, 2015, 41(6): 979-988.
[30] 王彦华, 侯喜林, 申书兴. 白菜病程相关蛋白1基因cDNA全长的克隆与分析[J]. 园艺学报, 2006, 33(5): 985-988.
[31] Kim Y, Hwang B K. Pepper gene encoding a basic pathogenesis-related 1 protein is pathogen and ethylene inducible[J]. Physiologia plantarum, 2000, 108(1): 51-60.
[32] 李雪姣, 范 伟, 牛东东, 等. 水稻病程相关PR1家族蛋白质在叶片生长及与白叶枯病菌互作反应中的表达[J]. 植物学报, 2014, 49(2): 127-138.
[33] 胡宗利, 邓 磊, 姚 楠, 等. 番茄PR-1和PR-5基因的表达特性分析[J]. 西南大学学报(自然科学版), 2009, 31(8): 67-72.
[34] 侯丽霞, 高 超, 车永梅, 等. 葡萄病程相关蛋白1基因的克隆和表达分析[J]. 植物生理学报, 2012, 48(1): 57-62.
[35] 赵淑清, 郭剑波. 植物系统性获得抗性及其信号转导途径[J]. 中国农业科学, 2003, 36(7): 781-787.
[36] Gao L, Wang S, Li X Y, et al. Expression and functional analysis of a pathogenesis-related protein 1 gene, TcLr19-PR1, involved in wheat resistance against leaf rust fungus[J]. Plant Molecular Biology Reporter, 2015, 33(4): 797-805.
[37] 衡友强, 游西龙, 王 艳. 费尔干猪毛菜病程相关蛋白SfPR1a基因的异源表达增强了烟草对干旱、盐及叶斑病的抗性[J]. 作物学报, 2020, 46(4): 503-512.
[38] Wang L, Guo Z, Zhang Y, et al. Characterization of LhSorTGA2, a novel TGA2-like protein that interacts with LhSorNPR1 in oriental hybrid lily Sorbonne[J]. Botanical Studies, 2017, 58(1): 46.
责任编辑:黄东杰
