香蕉MaGA20ox4和MaGA20ox5基因克隆、表达及亚细胞定位分析
2021-08-26段雅婕陈经烨陈晶晶
段雅婕 陈经烨 陈晶晶


摘 要:以威廉斯香蕉(Musa spp. AAA group)‘8818及其突變体‘8818-1的假茎为试材,同源克隆MaGA20ox4和MaGA20ox5基因的gDNA及启动子序列,比较它们在基因组测序品种以及‘8818和‘8818-1中的序列差异。序列比对结果表明:MaGA20ox4和MaGA20ox5基因的gDNA相似性达93.82%,而二者的启动子序列相似性仅有40%,威廉斯品种与基因组测序品种间MaGA20ox4和MaGA20ox5基因无论gDNA还是启动子序列均存在较大差异,特别是启动子序列。威廉斯‘8818和‘8818-1间MaGA20ox4基因gDNA也存在一定的碱基序列差异,但启动子序列基本相同,MaGA20ox5结果同MaGA20ox4类似。启动子分析推测2个基因的启动子属于诱导性启动子,存在较多光响应和激素响应元件。进一步构建了MaGA20ox4和MaGA20ox5的亚细胞定位表达载体,定位结果显示,MaGA20ox4和MaGA20ox5蛋白均定位于细胞核上,可能定位于细胞质或细胞膜。在不同品种香蕉果实的不同发育时期qRT-PCR结果表明,MaGA20ox4和MaGA20ox5具有品种特异性,在威廉斯香蕉品种果实中可能不是主要的赤霉素合成调控基因。
关键词:香蕉;赤霉素20氧化酶;基因克隆;亚细胞定位
中图分类号:S668.1 文献标识码:A
Cloning, Expression and Subcellular Localization Analysis of MaGA20ox4 and MaGA20ox5 Gene from Banana
DUAN Yajie, CHEN Jingye, CHEN Jingjing*
Institute of South Subtropical Crop Research Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs / National Field Genebank for Tropical Fruit / Key Laboratory of Hainan Province for Postharvest Physiology and Technology of Tropical Horticultural Products, Zhanjiang, Guangdong 524091, China
Abstract: Using the false stem of Musa spp. AAA Group ‘8818 and its mutant ‘8818-1 as the materials, the gDNA and promoter sequences of MaGA20ox4 and MaGA20ox5 genes were cloned homogeneously, and the sequence differences in the genome-sequencing variety, ‘8818 and ‘8818-1 were compared. The results of sequence alignment showed that the gDNA similarity of MaGA20ox4 and MaGA20ox5 genes reached 93.82%, while the promoter sequence similarity of the two genes was only 40%. There were large differences in gDNA and promoter sequences of MaGA20ox4 and MaGA20ox5 genes between Williams varieties and genome-sequencing variety, especially the promoter sequence. The gDNA of MaGA20ox4 gene of Williams ‘8818 and ‘8818-1 also had difference in base sequence, but the promoter sequence was basically the same, and the result of MaGA20ox5 was similar to MaGA20ox4. Promoter analysis suggested that the promoters of the two genes belonged to inducible promoters, and there were more light response and hormone response elements. The subcellular localization vectors of MaGA20ox4 and MaGA20ox5 were further constructed. The localization results showed that MaGA20ox4 and MaGA20ox5 proteins were localized on the nucleus and might be localized on the cell membrane or cytoplasm. Quantitative RT-PCR results at different developmental stages of different banana fruits showed that MaGA20ox4 and MaGA20ox5 were species-specific, and may not be the main gene regulating gibberellin synthesis in Williams banana fruits.
Keywords: banana; GA20ox; gene clone; subcellular localization
DOI: 10.3969/j.issn.1000-2561.2021.07.001
赤霉素(GA)作为调控植物发育的重要激素,最明显的生理作用是促进伸长,但不增加节间[1]。赤霉素氧化酶是调控赤霉素代谢的关键酶,其中GA-20氧化酶(GA20ox)和GA3氧化酶(GA3ox)能将GA12和GA53催化合成有活性的GA1和GA4;而GA2氧化酶(GA2ox)能通过β-羟基化作用将活性GA1和GA4催化形成无活性的GA8和GA34,这些关键基因的表达同时受到活性赤霉素的反馈和前馈调节[1-3]。赤霉素氧化酶属于多基因家族,研究发现,水稻中存在8个GA20ox、2个GA3ox、11个GA2ox基因;拟南芥中存在5个GA20ox、4个GA3ox、8个GA2ox基因;大豆中存在8个GA20ox、6个GA3ox、10个GA2ox基因[4]。赤霉素氧化酶基因家族一般可分为GA20ox、GA3ox、C19-GA2ox、C20-GA2ox 4个亚类[3-5],但近年来通过进化分析发现有些基因不属于上面4个亚类,Huang等[3]提出了增加GAox-A、GAox-B、GAox-C和GAox-D 4个亚类的划分,例如水稻OsGA20ox5、OsGA20ox6、OsGA20ox7和OsGA20ox8分别属于这4类。对于GA20ox、GA3ox、C19-GA2ox、C20-GA2ox 4个亚类中的基因,均具有赤霉素氧化酶基因典型功能的特征,如GA20ox和GA3ox催化合成活性赤霉素,GA2ox降解活性赤霉素为无活性的形式,并且这4类基因的功能研究最多,其中与调控株高最相关的赤霉素基因在这4类基因中都有研究,而对于GAox-A、GAox-B、GAox-C、GAox-D等4个亚类的基因还没有很多的研究,对于其明确的基因功能还没有相关的研究报道。
我们前期研究发现香蕉威廉斯矮化突变体(8818-1)大部分器官中的GA含量均低于亲本(8818)的水平,且含量差异较大;用不同浓度的GA3对8818-1植株进行外源喷施处理,发现外源的GA3处理后对突变体8818-1株高有明显恢复作用,因此推测8818-1的矮化是由赤霉素含量降低引起[5-6]。在香蕉A基因组[7]查找了赤霉素所有合成代谢的基因,经同源进化分析发现了10个GA20ox-like (MaGA20ox 1-10)、4个GA3ox-like (MaGA3ox1-3)、14个GA2ox-like (MaGA2ox1-15)基因,并筛选出了在假茎中起主要调节作用的赤霉素氧化酶基因为MaGA20ox基因家族的MaGA20ox4、MaGA20ox5、MaGA20ox7和MaGA2ox基因家族的MaGA2ox7、MaGA2ox12、MaGA2ox14[5]。其中在假茎中明显差异表达的MaGA20ox4、MaGA20ox5和OsGA20ox5聚为一类,属于GAox-A亚类[5]。本研究在此基础上进一步通过qRT-PCR方法分析这2个基因MaGA20ox4和MaGA20ox5在不同香蕉品种果实发育不同阶段的表达模式,并克隆其在亲本和突变体中gDNA序列和启动子,分析其表达差异是否是突变体碱基序列存在突变引起,或是启动子元件存在差异导致。
1 材料与方法
1.1 材料
1.1.1 实验材料 4个香蕉品种威廉斯香蕉‘8818(‘8818,AAA)、突變体‘8818-1(‘8818-1,AAA)、巴西香蕉(‘BX,AAA)、贡蕉(‘GJ,AA)由本研究室提供,成年植株种植在中国热带农业科学院南亚热带作物研究所香蕉种质资源圃。果实取样:取同一生长时期的4个香蕉品种果实发育的3个不同生长阶段,即极幼果、幼果、七分熟果的果肉为材料。同时取‘8818和‘8818-112叶期的假茎部位作为克隆基因的材料。取样后放?80 ℃冰箱保存备用。
1.1.2 试剂 RNAprep pure植物总RNA提取试剂盒、DH5α感受态大肠杆菌,琼脂糖凝胶回收试剂盒购自天根生化(北京)有限公司;Qiagen植物DNA提取试剂盒购自北京绿源伯德生物科技有限公司;pMD19-T克隆载体、RNA反转录试剂盒(PrimeScript?RT reagent Kit和PrimeScript?RT reagent Kit with gDNA Eraser),LA Taq、dNTPs、DL2000 DNA Marker购自宝生物工程(大连)有限公司;Dynamo Color Flash SYBR Green qPCR Kit(Thermo Fisher)购自广州赛哲生物公司;内切酶AarI和BsaI购自广州萃本生物科技有限公司;酵母提取物、蛋白胨、琼脂糖、IPTG、X-Gal、氨苄青霉素等从上海生工生物工程技术服务有限公司购买。
1.2 方法
1.2.1 香蕉MaGA20ox4和MaGA20ox5gDNA和启动子克隆 参照Qiagen植物DNA提取试剂盒(DNeasy plant)的方法,提取威廉斯香蕉‘8818和‘8818-1假茎DNA。
在香蕉A基因数据库中下载小果野蕉(Musa acuminata,DH Pahang,AA)MaGA20ox4(GSMUA_Achr7T08230_001)和MaGA20ox5(GSMUA_Achr7T08240_001)的基因序列(包含內含子区和UTRs区),设计gDNA全长和启动子同源克隆的上下游引物(表1)。PCR模板为‘8818和‘8818-1假茎DNA,体系为25 μL(DNA 1 μL;上下引物各1 μL;dNTPs 0.5 μL;ddH2O 18.80 μL;Buffer 2.5 μL;LATaq0.2 μL)。扩增参数为:95 ℃预变性4 min;95 ℃变性40 s,50 ℃退火40 s,72 ℃延伸2 min,35个循环;72 ℃延伸7 min。最后PCR扩增产物回收,产物纯化后连接pMD-19T载体,阳性菌液送公司测序。
1.2.2 基因序列的生物信息学分析 将测序结果拼接获得MaGA20ox4和MaGA20ox5基因gDNA和上游启动子序列,利用DNAMAN(Ver. 6.0.3.99)软件进行序列比对,利用NCBI中的BLAST(http://blast. ncbi. nlm. nih. gov/)对MaGA20ox4和MaGA20ox5蛋白的保守结构域进行分析;利用PlantCARE软件(http://bioinfor?matics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件预测分析。
1.2.3 亚细胞定位分析 表达载体的构建与鉴定:根据MaGA20ox4和MaGA20ox5的ORF设计带有酶切位点的引物(表1),以MaGA20ox4和MaGA20ox5基因开放阅读框(ORF)正确的克隆产物提取质粒,基因用AarI进行酶切,载体用BsaI进行酶切,用T4DNA连接酶连接到pBWA(V) HS-ccdb-GLosgfp载体上,将获得的连接产物转化到DH5α感受态细胞,经PCR扩增、酶切筛选和测序验证正确后,筛选阳性克隆并提取质粒,获得GFP与目的基因的融合表达载体pBWA(V) HS-MaGA20ox4-GLosgfp和pBWA(V)HS-MaGA?? 20ox5-GLosgfp。
烟草叶片的瞬时转化及激光共聚焦显微观察:将构建好的载体质粒电转化法转入农杆菌EHA105,30 ℃培养2 d;将农杆菌从固体接于10 mL YEB液体培养基中悬浮培养,悬浮液重悬菌体,调OD600至0.6左右;注射烟草下表皮,弱光培养2 d,取标记的农杆菌注射的烟草叶片制作成玻片,用Nikon C2-ER激光共聚焦显微镜观察并拍照。
1.2.4 香蕉MaGA20ox4和MaGA20ox5基因在果实中的表达分析 参照RNAprep pure植物总RNA提取试剂盒中的方法,提取‘8818和‘8818-1不同品种香蕉果实中总RNA。采用TaKaRa公司PrimeScript?RT reagent Kit(用于基因克隆)和PrimeScript?RT reagent Kit with gDNA Eraser(用于qRT-PCR)反转录试剂盒,按照其说明书进行逆转录成第一链cDNA。
采用SYBR Green I染料法,利用荧光定量qRT-PCR探讨MaGA20ox4和MaGA20ox5基因在果实中的表达情况。根据克隆获得的香蕉MaGA20ox4和MaGA20ox5 CDS序列,在二者序列不一致区域设计定量引物(表1)。内参为Actin(AB022041)。qRT-PCR反应体系为:2×DyNAmo color Flash SYBR Green master mix 10 μL、模板cDNA 0.5 μL,上下游引物各0.6 μL,ddH2O补至20 μL。qRT-PCR反应程序为:95 ℃ 5 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 25 s(real time 荧光采集),40个循环;95 ℃ 5 s,65 ℃ 1 min,97 ℃(荧光采集结束),40 ℃ 30 s(冷却)。每个样品在同一板中重复3次。
1.3 数据处理
采用Microsoft Excel 2003软件进行作图和数据分析,实验数据用平均值±标准差(SD)表示。
2 结果与分析
2.1 MaGA20ox4和MaGA20ox5 gDNA序列差异及保守结构域分析
MaGA20ox4基因CDS区包含1077 bp,外显子加内含子的gDNA序列有1223 bp。同源克隆‘8118和‘8818-1中MaGA20ox4gDNA序列。序列比对发现(图1),三者MaGA20ox4gDNA序列长度一致,其中‘8818和‘8818-1MaGA20ox4gDNA序列有13处碱基序列不一致,小果野蕉核苷酸序列与‘8818有27处,与‘8818-1有21处不一致,与‘8818和‘8818-1均不一致碱基序列有16处。
MaGA20ox5基因CDS区包含1057 bp,外显子加内含子的gDNA序列有1205 bp。同源克隆‘8818和‘8818-1中MaGA20ox5gDNA序列,序列比对发现(图2),‘8818和‘8818-1MaGA20ox5序列有5处碱基序列不一致;小果野蕉核苷酸序列与‘8818有8处,与‘8818-1有8处不一致,与‘8818和‘8818-1均不一致序列有6处。
对MaGA20ox4和MaGA20ox5gDNA核苷酸序列进行比较,二者cDNA序列相似性93.41%,gDNA序列相似性93.82%。前期对香蕉赤霉素氧化酶基因家族进行进化分析发现,MaGA20ox4,
MaGA20ox5和水稻OsGA20ox5聚为一类,属于GAox-A亚类[5]。在NCBI上进行MaGA20ox4、MaGA20ox5和OsGA20ox5蛋白结构域分析,发现三者均有3个结构域(图3),包括2-酮戊二酸作为辅因子的含非血红素铁的氧化酶超家族(2OG-Fe(II) oxygenase superfamily),PLN02750(oxidoreductase, 2OG-Fe(II) oxygenase family protein,2-酮戊二酸作为辅因子的含非血红素铁的氧化酶家族蛋白),次级代谢合成相关的PcbC(Isopenicillin N synthase and related dioxygenases)。像OsGA20ox5蛋白一样,MaGA20ox4和MaGA20ox5均不具有典型赤霉素氧化酶基因与底物结合的的LPWKET基元,在分类上属于GAox-A亚类[3, 5],而对于这类赤霉素氧化酶基因的功能尚需要明确。
2.2 MaGA20ox4和MaGA20ox5启动子序列和顺式作用元件分析
根据小果野蕉GA20ox4基因启动子序列同源克隆‘8818和‘8818-1MaGA20ox4啟动子1574 bp。序列比对发现‘8818和‘8818-1之间有1处碱基序列不一致;小果野蕉基因组测序序列与‘8818和‘8818-1有25处1~2个碱基不一致,4处超过6个碱基不一致,其中2处超过80个碱基不一致。小果野蕉与威廉斯品种GA20ox4启动子碱基序列差异较大,而‘8818和‘8818-1间差异很小(图4)。同源克隆MaGA20ox5启动子1585 bp,序列比对发现‘8818和‘8818-1启动子序列有3处碱基不一致;小果野蕉基因组测序序列与‘8818有29处,与‘8818-1有30处碱基序列不一致;小果野蕉与‘8818‘8818-1均不一致碱基序列28处(图5)。比较MaGA20ox4和MaGA20ox5启动子序列发现二者的启动子序列相似性仅有40%。
经植物启动子元件分析软件PlantCARE预测,MaGA20ox4和MaGA20ox5启动子均存在大量顺式作用元件,结果见表2。MaGA20ox4和MaGA20ox5启动子序列都存在核心元件TATA-box和增强元件CAAT-box,符合真核生物基因启动子的基本结构特征。在小果野蕉和威廉斯2个品种中,MaGA20ox4和MaGA20ox5启动子中的TATA-box和CAAT-box的数量并不完全一致,但是威廉斯‘8818和‘8818-1中TATA-box和CAAT-box数量一样。MaGA20ox4中CAAT-box在‘8818和‘8818-1中比小果野蕉中多4个,MaGA20ox5中CAAT-box在‘8818和‘8818-1中比小果野蕉中多1个。
除基本的启动子结构元件外,MaGA20ox4和MaGA20ox5基因启动子中还存光调控元件、激素响应元件、胁迫响应元件和其他响应元件。其他响应元件包括昼夜节律、MYB结合位点、MYC结合位点、胚乳表达顺式作用元件等。在光调控元件中,2个品种中的MaGA20ox4启动子中都含有Box 4、Box II、GATA-motif、TCT-motifG-box、GT1-motif元件。AE-box存在小果野蕉中,在威廉斯中不存在;ACE只存在威廉斯中,在小果野蕉中不存在。2个品种中的MaGA20ox5启动子中都含有Box 4、I-box、G-box、GATA-motif、TCT-motif,小果野蕉中存在L-box,而威廉斯中不存在。在激素响应元件中,2个品种的MaGA20ox4启动子都含有茉莉酸甲酯响应元件CGTCA-motif、TGACG-motif;赤霉素响应元件GARE-motif;脱落酸响应元件ABRE、乙烯响应元件ERE;小果野蕉中存在生长素响应元件 TGA-element,威廉斯‘8818-1中存在水杨酸响应元件TCA-element。MaGA20ox5启动子仅含有茉莉酸甲酯、脱落酸以及乙烯响应元件,其中威廉斯品种还含有水杨酸相应元件。在胁迫诱导元件中,2个品种的MaGA20ox4启动子均存在厌氧诱导作用元件和响应干旱调控的MYB结合位点。MaGA20ox5启动子存在厌氧诱导作用元件和抗病及胁迫诱导顺式作用元件。除了基本启动子元件外,不同品种间均有的元件数量一致。
综上分析认为MaGA20ox4和MaGA20ox5基因启动子具有诱导型启动子特征,存着大量光响应元件和激素响应元件,推测其受光诱导及激素诱导的可能性较大。而二者启动元件数量和种类的不同暗示可能存在不同的诱导响应模式。
2.3 MaGA20ox4和MaGA20ox5亚细胞定位分析
将构建的植物融合表达载体pBWA(V)HS- MaGA20ox4-GLosgfp,pBWA(V)HS-MaGA20ox5- GLosgfp和空载体pBWA(V)HS-ccdb-GLosgfp分别转入农杆菌,注射烟草下表皮,弱光培养2 d,取标记的农杆菌注射的烟草叶片制作成玻片,在激光共聚焦显微镜观察绿色荧光信号的分布。结果显示:MaGA20ox4-GFP融合蛋白(图6A~图6D)及带有GFP的空载(图6E~图6H)在烟草叶片细胞的细胞核中均有表达,另外在细胞质或细胞膜中可能有表达,因烟草细胞质紧挨细胞膜,如果明确区分2个蛋白的是否细胞膜和细胞质定位,还需进一步进行细胞质和细胞膜的共定位分析。与MaGA20ox4蛋白类似,蛋白MaGA20ox5- GFP和带有GFP的空载在烟草叶片的细胞核中均有表达,在细胞质或细胞膜中可能有表达(图7)。表明MaGA20ox4和MaGA20ox5编码的蛋白均确定定位在胞核上,是否定位在细胞质或细胞膜需要进一步确定。
2.4 MaGA20ox4和MaGA20ox5在果实中的表达分析
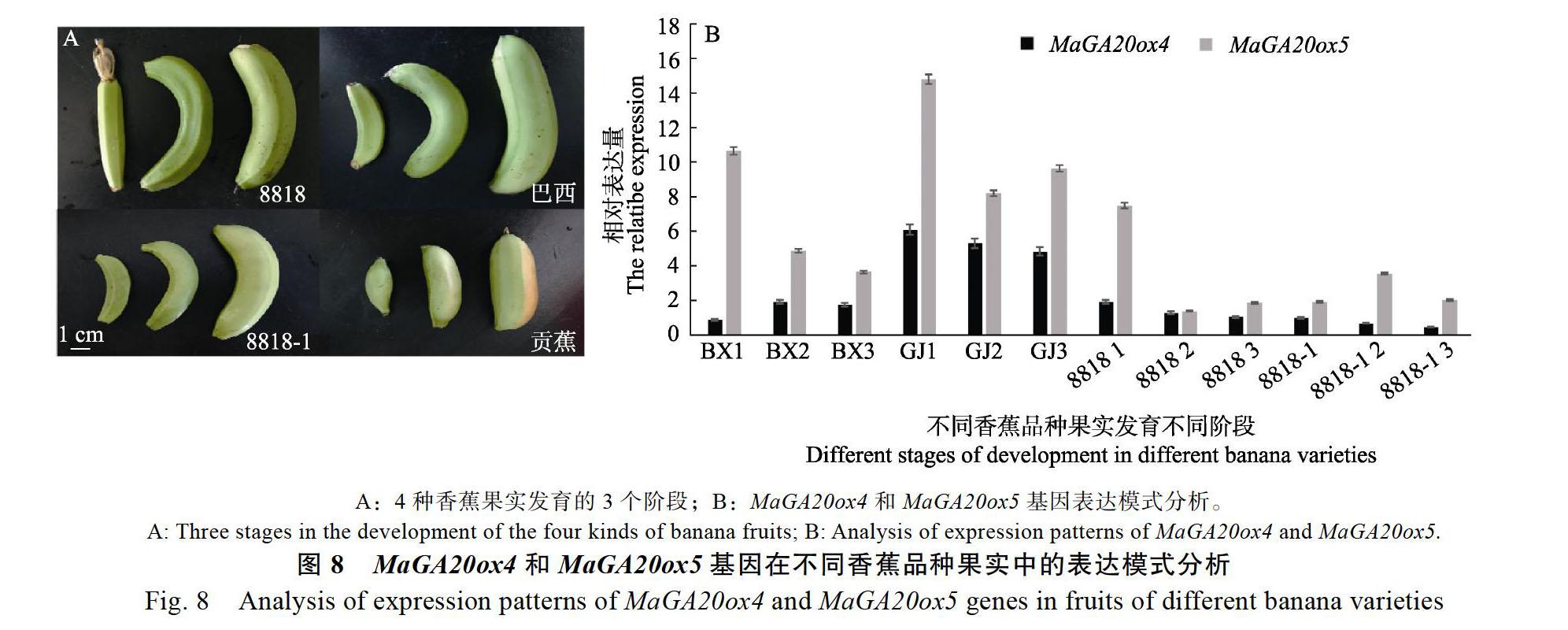
除了‘8818和‘8818-1,选取具有A基因组的巴西香蕉(‘BX)及贡蕉(‘GJ),分析MaGA20ox4基因在果实发育的3个不同时期(图 <!--[if gte vml 1]>
结果如8B所示,除了‘BX,MaGA20ox4在‘GJ‘8818和‘8818-1果實从小到大3个时期呈现下调表达趋势,MaGA20ox4在极幼果期表达量最高;而在‘BX中,在幼果和七分熟果中的表达量高于极幼果;整体而言,MaGA20ox4在‘GJ中的表达量最高,而在‘8818-1中的表达量最低。MaGA20ox5在‘BX‘GJ和‘8818中基本呈现下调表达趋势,同样在极幼果期表达量最高。而在‘8818-1中呈现波动表达,表达量低于‘BX‘GJ和‘8818的极幼果时期。MaGA20ox5基因在4种香蕉果实中的整体表达量均高于MaGA20ox4。以上结果表明MaGA20ox4和MaGA20ox5的表达不仅存在品种差异,在果实不同发育时期也存在差异,暗示其可能与MaGA20ox4和MaGA20ox5基因家族其他成员一起协同调控果实不同发育时期的赤霉素含量,其中MaGA20ox5的调控作用可能强于MaGA20ox4。在‘GJ果实发育过程中MaGA20ox4、MaGA20ox5或许是起主要作用的MaGA20ox基因。
而对比MaGA20ox4和MaGA20ox5在‘8818和‘8818-1中的表达,MaGA20ox4在‘8818-1中整体表达低于‘8818,MaGA20ox5在‘8818-1中的表达低于‘8818的极幼果时期,结合前期研究,在威廉斯香蕉果实的幼果中MaGA20ox3表达量最高,MaGA20ox4、MaGA20ox9、MaGA20ox6表达量其次[5],表明MaGA20ox4、MaGA20ox5可能协同其他MaGA20ox一起发挥作用,或许不是威廉斯香蕉果实中主要MaGA20ox基因。而前期对MaGA20ox基因家族在假茎中的表达进行筛选,发现MaGA20ox4在威廉斯香蕉假茎中表达量最高,其中‘8818-1假茎中的表达也明显低于‘8818[5],结合2个结果分析本研究认为MaGA20ox4在‘8818和‘8818-1果实和假茎表达中存在差异,其中MaGA20ox4是威廉斯香蕉假茎中起主要作用的MaGA20ox,可能是造成‘8818和‘8818-1假茎中赤霉素含量差异的原因;而在果实中MaGA20ox4可能参与了果实赤霉素含量的调控,但可能不是主要的基因。
3 讨论
MaGA20ox 4和MaGA20ox 5基因在同源进化分析上与水稻OsGA20ox5基因聚为一类,属于新划分的GAox-A亚类,不同于传统分类GA20ox、GA3ox、C19-GA2ox、C20-GA2ox均具有赤霉素氧化酶基因典型功能的特征,GAox-A亚类的功能尚未明确。本研究对威廉斯香蕉‘8818和‘8818-1中MaGA20ox 4和MaGA20ox 5的gDNA和启动子序列进行了克隆,与香蕉基因组测序序列进行比较,结果发现威廉斯品种与测序品种小果野蕉的MaGA20ox 4和MaGA20ox 5 gDNA序列有16处和6处碱基位点不一致,说明这2个基因在品种间存在着多态性。相对于gDNA,2个基因的启动子与基因组测序品种的启动子差异更大,特别是MaGA20ox 4基因的启动子,这种差异可能是基因组进化的结果,不同品种间赤霉素氧化酶基因家族成员在进化过程中功能逐渐进行了区分。而对于威廉斯‘8818和其突变体‘8818-1间MaGA20ox 4和MaGA20ox 5 gDNA序列分别有13个和5碱基与基因组测序序列不一致,2个基因的启动子在‘8818和‘8818-1中基本一致,表明EMS诱变可能导致了这2个基因部分碱基在‘8818-1中发生了改变,这些改变有没有影响其蛋白功能还未知,但是影响了其在‘8818和‘8818-1的表达量。其中MaGA20ox 4基因无论是品种间还是亲本和突变体间变异最大,根据前期研究发现MaGA20ox 4可能是造成‘8818和‘8818-1突变体中赤霉素含量差异的主要基因[5],推测其序列變异可能改变了其表达调控。启动子元件分析发现,2个基因的光调控元件较多,许多实验结果表明光质和光周期可以调节GA的生物合成和代谢[8-10]。在长日照下菠菜的GA20氧化酶基因的转录水平高于短日照下的,当拟南芥从短日照转到长日照后,其GA20氧化酶活性增加[11-12],说明这2个基因可能也受光的调控。
典型的赤霉素氧化酶,如GA20ox和GA3ox催化合成活性赤霉素,GA2ox降解活性赤霉素为无活性的形式,其与赤霉素含量密切相关,其中与调控株高最相关的赤霉素基因在这4类基因中都有研究,拟南芥5个AtGA20ox基因均属于GA20ox,研究发现AtGA20ox1在对株高的影响上起主要作用[13-14];水稻中,OsGA20ox2与株高密切相关[15-16]。而对GAox-A、GAox-B、GAox-C、GAox-D这4个亚类的赤霉素氧化酶基因功能尚未明确。在香蕉中,通过前期筛选得到在假茎中起主要调节作用的赤霉素氧化酶基因为MaGA20ox基因家族的MaGA20ox4、MaGA20ox5,进一步对其在不同品种果实中的表达模式进行分析发现,2个基因均存在品种表达差异,均在极幼果期表达量最高,这与幼果期果实生长发育快速的事实相符,而随后的表达量变化与其在不同品种间发挥作用的模式相关。结合在不同品种间的表达量以及MaGA20ox基因家族在威廉斯香蕉果实中的表达分析[5],MaGA20ox4和MaGA20ox5可能不是果实中主要的MaGA20ox基因。前期研究发现,MaGA2ox 12在‘8818和‘8818-1幼果中差异明显,其可能是果指中调控赤霉素含量的主要基因[5]。
在香蕉生产中,为了操作便利、防风等的需求,需要矮化香蕉品种,而矮化香蕉品种往往果指较短,影响了其商品性,因此得到假茎矮化而果指不变短的香蕉品种是生产上需求的,因此选取在假茎中起主要调控作用,而在果实中不起主要作用的赤霉素氧化酶基因是我们的目标,综上分析MaGA20ox4和MaGA20ox5,特别是MaGA20ox4符合此特点,这为后续进行分子设计育种打下了基础。
参考文献
<!--[if !supportLists]-->[1] <!--[endif]-->Yang Y H, Zhang F M, Ge S. Evolutionary rate patterns of the gibberellin pathway genes[J]. BMC Evolutionary Biology, 2009, 9: 206.
<!--[if !supportLists]-->[2] <!--[endif]-->岳 川, 曾建明, 曹红利, 等. 高等植物赤霉素代谢及其信号转导通路[J]. 植物生理学报, 2012, 48(2): 118-128.
<!--[if !supportLists]-->[3] <!--[endif]-->Huang Y,Wang X,Ge S, et al. Divergence and adaptive evolution of the gibberellin oxidase genes in plants[J]. BMC Evolutionary Biology, 2015, 15: 207.
<!--[if !supportLists]-->[4] <!--[endif]-->Han F, Zhu B. Evolutionary analysis of three gibberellin oxidase genes in rice,Arabidopsis, and soybean[J]. Gene, 2011, 473(1): 23-35.
<!--[if !supportLists]-->[5] <!--[endif]-->Chen J J, Xie J H, Duan Y J. Genome-wide identification and expression profiling reveal tissue-specific expression and differentially-regulated genes involved in gibberellin metabolism between Williams banana and its dwarf mutant[J]. BMC Plant Biology, 2016, 16(1): 123.
<!--[if !supportLists]-->[6] <!--[endif]-->陈晶晶, 胡玉林, 庞振才, 等. 威廉斯香蕉矮化突变体矮化原因初探[J]. 热带作物学报, 2014, 35(11): 2144-2150.
<!--[if !supportLists]-->[7] <!--[endif]-->DHont A, Denoeud F, Aury J M,et al. The banana (Musa acuminata) genome and the evolution of monocotyledonous plants[J]. Nature, 2012, 488: 213-217.
<!--[if !supportLists]-->[8] <!--[endif]-->Kamiya Y, Garcia-Martinez J. Regulation of gibberellin biosynthesis by light[J]. Current Opinion Plant Biology, 1999, 2(5): 398-403.
<!--[if !supportLists]-->[9] <!--[endif]-->Olszewski N, Sun T P, Gubler F. Gibberellin signaling: biosynthesis, catabolism, and response pathways[J]. Plant Cell, 2002, 14(suppl): S61-S80.
<!--[if !supportLists]-->[10] <!--[endif]-->黃先忠, 蒋才富, 廖立力, 等. 赤霉素作用机理的分子基础与调控模式研究进展[J]. 植物学通报, 2006, 23(5): 499-510.
<!--[if !supportLists]-->[11] <!--[endif]-->谈 心, 马欣荣. 赤霉素生物合成途径及其相关研究进展[J]. 应用与环境生物学报, 2008, 14(4): 571-577.
<!--[if !supportLists]-->[12] <!--[endif]-->Phillips A L, Ward D A, Uknes S,et al. Isolation and expression of three gibberellin 20-oxidase cDNA clones fromArabidopsis[J]. Plant Physiology, 1995, 108(3): 1049-1057.
<!--[if !supportLists]-->[13] <!--[endif]-->Rieu I, Ruiz-Rivero O, Fernandez-Carcia N,et al. The gibberellin biosynthetic genesAtGA20ox1andAtGA20ox2act, partially redundantly, to promote growth and development throughout theArabidopsislife cycle[J]. Plant Journal, 2008, 53(3): 488-504.
<!--[if !supportLists]-->[14] <!--[endif]-->吴建明, 陈荣发, 黄 杏, 等. 高等植物赤霉素生物合成关键组分GA20-oxidase氧化酶基因的研究进展[J]. 生物技术通报, 2016, 32(7): 1-12.
<!--[if !supportLists]-->[15] <!--[endif]-->Qin X, Liu J H, Zhao W S,et al. Gibberellin 20-oxidase geneOsGA20ox3 regulates plant stature and disease development in rice[J]. Molecular Plant-Microbe Interactions, 2013, 26(2): 227-239.
<!--[if !supportLists]-->[16] <!--[endif]-->Qiao F, Chen Z. Alteration of rice growth and development via antisense expression ofOsGA20ox2gene[J]. African Journal of Biotechnology, 2013, 12(25): 3898-3904.
责任编辑:黄东杰
